Слайд 2Проверка домашнего задания
Упражнение №5
Al2 (SO4)3+ KOH(нед) =
Al 2(SO4)3+ KOH(изб.) =

Упражнение №6
Al ? AlCl3 ? Al(OH)2 ? Al2 O3 ? NaAlO2 ? Al 2(SO4)3 ? Al(OH)3 ? AlCl3 ? NaAlO2
Слайд 3Ответы
Упражнения №5
1.Al2 (SO4)3 + 6KOH(нед.) = 2AL(OH)3 +3K2SO4
2. Al2 (SO4)3 + 8KOH(изб)

= 2KAlO2 + 3K2SO4 +
4H2O
Слайд 4Упражнение №6
2Al +3Cl2 = 2AlCl3
AlCl3 + 3NaOH =Al(OH)3 + 3NaCl
2Al(OH)3 = Al2O3

+ 3H2O
Al2O3 +2NaOH =2NaAlO2 + H2O
2NaAlO2 + 4H2SO4(изб.) = Na2SO4 + Al2 (SO4 )3 +4H2O
Al2 (SO4 ) + 6NaOH = 2Al (OH)3 + 3Na2 SO4
Al(OH)3 +3HCl =AlCl3 + 3H2O
AlCl3 + 4NaOH(избыт.)= NaAlO2 + 3NaCl + 2H2O
Слайд 5Изучение нового материала
Характеристика по плану:
1.Положение железа в ПСХЭ (период, ряд, группа, подгруппа,

порядковый номер)
2.Атомное строение(число электронов, протонов , нейтронов, относительная атомная масса)
3.Электронные слои, распределение электронов по слоям, электронная конфигурация.
Слайд 6Характеристика элемента
4-период, 4ряд, 8-группа, побочная подгруппа, порядковый номер 26
26 электронов, 26 протонов,

относительная атомная масса 56, 30 нейтронов.
4 электронных слоя, 2)8)14)2), электронная конфигурация 1s22s2p63s2p6d64s2
Степень окисления 0,+2, +3 ,+4 и иногда + 6; является восстановителем
Слайд 7Физические свойства железа
Серебристо-серый, мягкий металл, обладает хорошей пластичностью, ковкостью и способностью к

намагничиванию.
Плотность 7,864г/см3, температура плавления 1539 * С
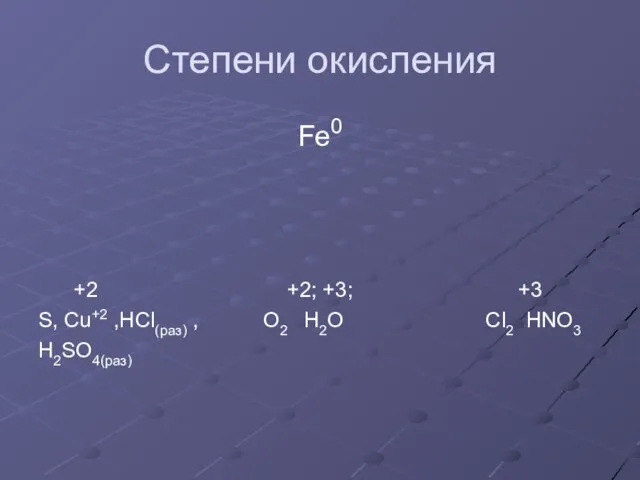
Слайд 8Степени окисления
Fe0
+2 +2; +3; +3
S, Cu+2 ,HCl(раз) , O2 H2O Cl2 HNO3
H2SO4(раз)
Слайд 9Химические свойства
При нагревании
2Fe + 3Cl2 =2FeCl3
3Fe +2O2= Fe3O4 (FeO Fe2O3)
Fe +S =FeS
При

очень высокой температуре
4Fe + 3C =Fe4C3
4Fe + 3Si =Fe4Si3
3Fe + 2P = Fe3P2
Слайд 10Химические свойства
Fe + CuSO4 = Cu + FeSO4
Fe + 2HClр =

FeCl2 + H2
Fe + H2SO4 p= FeSO4 + H2
Fe + H2SO4(k) =/=
Fe + HNO3 (к)=/=
Слайд 11При нагревании
2Fe + 6H2SO4(k)=Fe2(SO4)3 + 3SO2+6H2O
Fe+ 6HNO3(k)= Fe(NO3)3+ 3NO2+ 3H2O

Слайд 12
Химические свойства
Fe0 + HNO3 (p) = Fe +2(NO3 )2 + N20 +

H2 O
Fe0 + HNO3(р) = Fe+3 (NO3)3 + N+2 O + H20
Fe0 + HNO3(р) = Fe+2(NO3)2 + N-3 H4 N+5 O3+ H2O
Слайд 13Уравнивание реакций
5Fe0 + 12 HN+5 O3 (p) = 5Fe +3(NO3 )2 +

N20 +6 H2 O
вос-ль окис-ль
Fe0 - 2e = Fe+2 10 1
2N+5 + 10e = N20 2 5
Fe0 +4 HN+5 O3 = Fe+3 (NO3)3 + N+2 O + 2H20
Fe0 - 3e = Fe+3 3 1
N+5 + 3e = N+2 3 1
Fe0 – восстановитель
HNO3 – окислитель
4Fe0 +10 HNO3 =4 Fe+2(NO3)2 + N-3 H4 N+5 O3+ 3H2O
вос-ль окис-ль
Fe0 - 2e = Fe+2 8 4
N+5 + 8e = N-3 2 1
Слайд 14Минералы железо
Fe3O4 магнитный железняк или магнетит
Fe2O3 красный железняк или гематит
2Fe2O3.3H2O бурый

железняк или лимонит
FeS2 железный или серный колчедан
FeSO4.7H2O железный купорос
Слайд 15Применение
Магнитный, красный, бурый железняки –для производства черной металлургии (чугуна и стали)
Железный колчедан

– для производства серной кислоты
Железный купорос– для борьбы с вредителями растений, для приготовления минеральных красок, для обработки древесины
Соединение железа издавна применяют для лечения малокровия, при истощении, упадке сил.
Чугун и сталь в технике и в быту.
Хлорид железа(lll)– при очистке воды, в качестве протравы при крашении тканей.
Сульфат железа(lll) при очистке воды, в качестве растворителя в гидрометаллургии .
Слайд 16Источники железа
Шпинат
Салат
Капуста
Черная черешня
Говядина
Телятина
















 Приготовление и хранение индикаторов для исследований
Приготовление и хранение индикаторов для исследований Свойства алмаза
Свойства алмаза 1_Лекція Комплексн
1_Лекція Комплексн Вода. Классы неорганических соединений. 8 класс
Вода. Классы неорганических соединений. 8 класс Систематизация знаний по периодической системе химических элементов
Систематизация знаний по периодической системе химических элементов Применение личностно-ориентированного подхода в обучении химии
Применение личностно-ориентированного подхода в обучении химии Реакция хлорметилирования
Реакция хлорметилирования Гелий. История открытия
Гелий. История открытия Полный синтез метилового эфира - пенталенолактона
Полный синтез метилового эфира - пенталенолактона Особенности органических веществ
Особенности органических веществ Ацетиленди гидратациялау
Ацетиленди гидратациялау Производство концентрированной азотной кислоты (лекция 15)
Производство концентрированной азотной кислоты (лекция 15) Презентация на тему Углекислый газ CO2
Презентация на тему Углекислый газ CO2  Нефть: состав, свойства и переработка
Нефть: состав, свойства и переработка Соединения алюминия
Соединения алюминия Природный газ, состав применение в качестве топлива
Природный газ, состав применение в качестве топлива Презентация на тему Азот
Презентация на тему Азот  Сферы применения CaCO3
Сферы применения CaCO3 Термохимия
Термохимия Карбоксилденген этоксилаттар
Карбоксилденген этоксилаттар Классы неорганических соединений
Классы неорганических соединений Сложные эфиры. Жиры
Сложные эфиры. Жиры Классификация процессов коррозии
Классификация процессов коррозии Подготовка к контрольной работе
Подготовка к контрольной работе Витамины. Классификация витаминов
Витамины. Классификация витаминов Презентация на тему Электролитическая диссоциация (8 класс)
Презентация на тему Электролитическая диссоциация (8 класс)  Обобщение темы «Неметаллы» (Подгруппа азота)
Обобщение темы «Неметаллы» (Подгруппа азота) Образование первичной структуры белка
Образование первичной структуры белка