Слайд 2План
Комплексиметрия и ее классификация. Реакции комплексообразования, которые используют в титриметрии, требования к

ним.
Комплексонометрия. Способы комплексоно-метрического титрования.
Построение кривых титрования в методе комплексонометрии.
Индикаторы метода комплексонометрии. Использование комплексонометрии в фарманализе.
Слайд 3Комплексиметрическое титрование, или комплексиметрия -
В методе комплексиметрического титрования выделяют такие методы:
меркуриметрия
фторидометрия

цианидометрия
комплексонометрия
Слайд 4Требования к реакциям в комплексиметрии:
Реакция должна протекать стехиометрически.
Реакция должна протекать количественно и

до конца, константа стойкости комплекса должна быть больше β≥108.
Реакция образования комплексного соединения должна протекать быстро.
Должна быть возможность фиксации точки эквивалентности.
В условиях проведения титрования не должны протекать конкурирующие реакции.
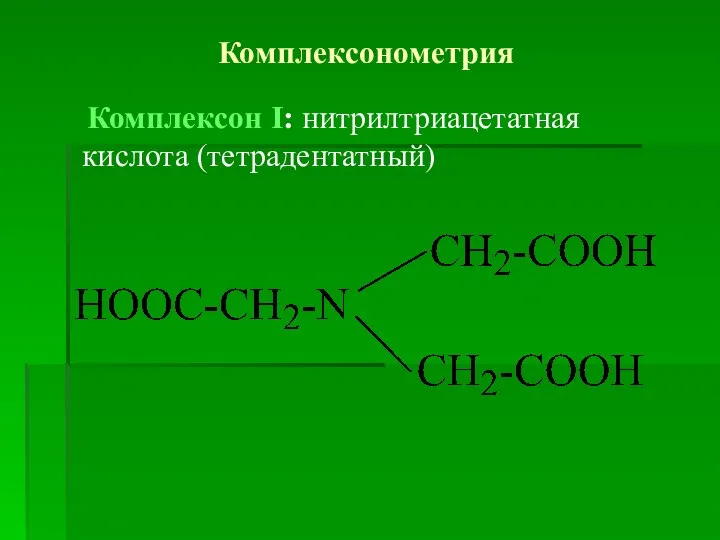
Слайд 5Комплексонометрия
Комплексон І: нитрилтриацетатная кислота (тетрадентатный)
Слайд 6 Комплексон ІІ: этилендиамминтетра-ацетатная кислота (ЭДТА)
Комплексон ІІІ: этилендиамминтетраацетат натрия (Na-ЭДТА, трилон Б,
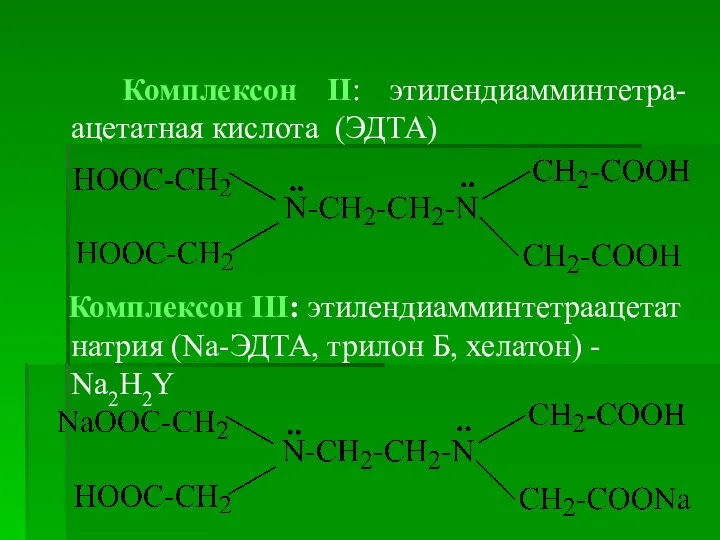
хелатон) - Na2H2Y
Слайд 7Комплексон ІV: циклогексилдиаммин-тетраацетатная кислота
Комплексоны вступают в реакции с катионами многих металлов в
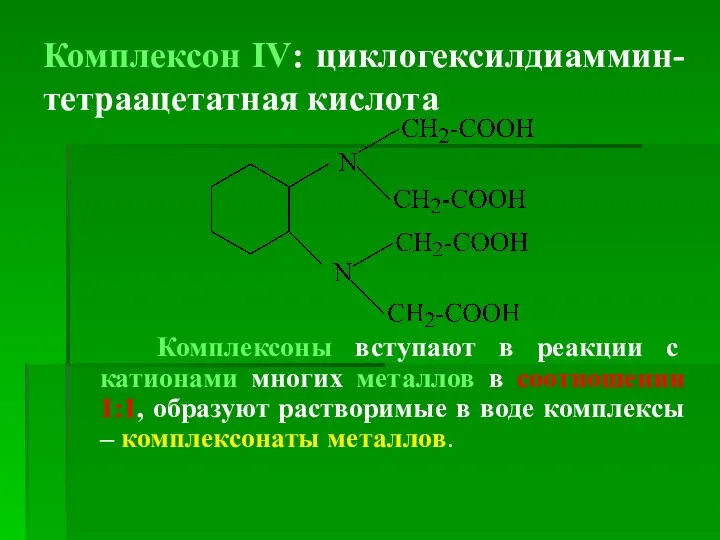
соотношении 1:1, образуют растворимые в воде комплексы – комплексонаты металлов.
Слайд 8Преимущества использования комплексонов
хорошо растворимы в воде и некоторых других органических растворителях
повышенная устойчивость

комплексов
реакции протекают стехиометрически (нет ступенчатого комплексообразования)
некоторые комплексоны являются специфическими реагентами на отдельные ионы металлов (избирательное действие)
широкое использование их как маскирующих реагентов
быстрота протекания реакции
Слайд 9Комплексонометрия
Титрант: 0,05 моль/л раствор натриевая соль эдта
Реакции метода:
Са2+ + H2Y2-

→ CaY2- + 2H+
In3+ + H2Y2- → InY- + 2H+
Th4+ + H2Y2- → ThY + 2H+
Слайд 10Комплексонометрия
Индикаторы: металлохромные
Общая реакция метода:
Men+ + H2Y2- → MeYn-4 + 2H+
Men+ +

Y4- → MeY(n-4)+
На концентрацию ионов металла влияет рН – образуются гидроксокомплексы
На концентрацию Y4- влияет рН среды
Слайд 11Условия комплексонометрического титрования
высокая устойчивость комплексонатов металлов (βст.)
придерживание конкретного значения кислотности среды
использование буферных

растворов (для связывания ионов Н+, которые выделяются)
только отдельные катионы (Fе3+, In3+, Sc3+, ZnIV, ТhIV), которые образуют очень устойчивые комплексы с комплексоном, титруются в кислой среде
Слайд 12Прямое комплексонометрическое титрование
Условия использования:
высокая скорость реакции
реакция проходит количественно, стехиометрически, до конца
есть индикатор,

который позволяет надежно фиксировать к.т.т.
можно титровать смесь катионов
Определяемые ионы: большинство катионов металлов
Слайд 13Способы повышения селективности прямого титрования:
Регулирование рН среды
ионы Fе3+, Ga3+, In3+, Tl3+, Ві3+,

при рН~2
при рН = 5 – Аl3+, Co3+, Ni2+, Cu2+, Zn2+, Cd2+
при рН = 9 – щелочноземельные металлы
2. Использование маскирующих реагентов:
ионы F-, P2O72-, CN-, Н2С4Н4О6 и др.
ионы Со(II), Ni(II), Zn(II), Cd(II) и Hg(II) могут быть замаскированы цианид-ионами
3. Изменение степени окисления
Fe3+ маскируют восстановлением до Fe2+
Слайд 14Требования к индикаторам в комплексонометрии
металл и индикатор должны давать комплекс в соотношении

1:1
окраска индикатора должна отличаться от окраски комплекса MeInd
комплекс MeInd должен быть достаточно устойчивым
устойчивость комплекса MeInd должна быть меньше устойчивости комплексоната металла MeY, который является продуктом титрования (разница в 10-100 раз)
комплекс MeІnd должен быть лабильным
изменение окраски при титровании должно быть контрастным
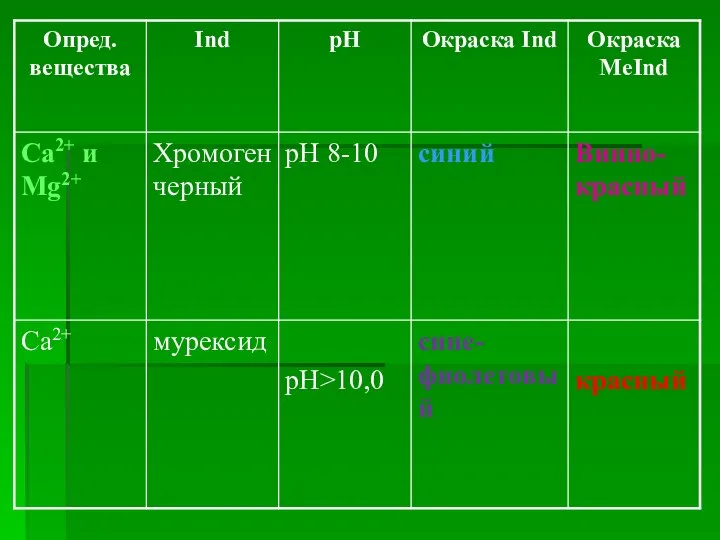
Слайд 15Металлоиндикаторы
сами не окрашены металлохромные
специфические:
Fe3+ - сульфосалициловая сами окрашены, поскольку
кислота (красная
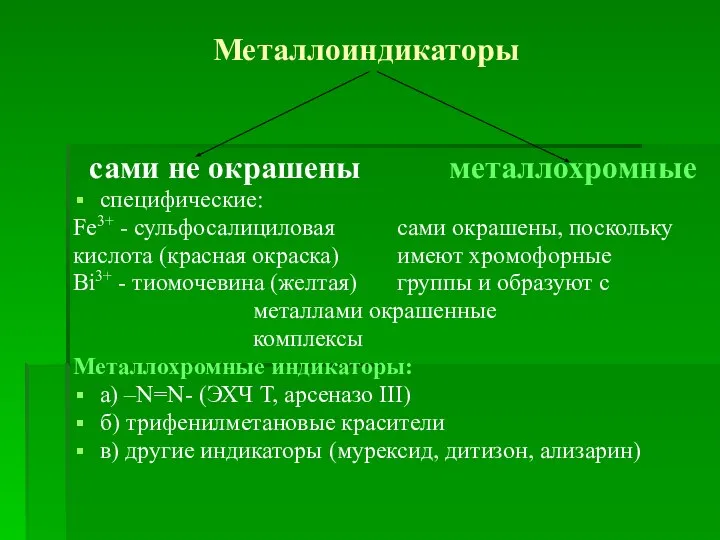
окраска) имеют хромофорные
Ві3+ - тиомочевина (желтая) группы и образуют с
металлами окрашенные
комплексы
Металлохромные индикаторы:
а) –N=N- (ЭХЧ Т, арсеназо ІІІ)
б) трифенилметановые красители
в) другие индикаторы (мурексид, дитизон, ализарин)
Слайд 16Механизм изменения окраски
металлохромных индикаторов
Me2+ + Іnd ⇔ MeІnd-
синий красный
MeІnd +

H2Y2- ⇔ MeY2- + H2Іnd
красный бесцветный синий















 Применение центрифугирования
Применение центрифугирования Получение формальдегида методом дегидрирования метанола
Получение формальдегида методом дегидрирования метанола Кислород
Кислород Химический элемент Li
Химический элемент Li Кислоты. Оксиды
Кислоты. Оксиды Амфотерность оксида и гидроксида алюминия
Амфотерность оксида и гидроксида алюминия Презентация на тему Неорганічні речовини живих організмів
Презентация на тему Неорганічні речовини живих організмів  Мышьяк. Висмут. Сурьма
Мышьяк. Висмут. Сурьма Соли как производные кислот и оснований. Цель урока: 1.Дать определение солей. 2. Рассмотреть состав и название солей. 3. Продолжить
Соли как производные кислот и оснований. Цель урока: 1.Дать определение солей. 2. Рассмотреть состав и название солей. 3. Продолжить Аминобензой қышқылы және оның туындыларының синтезі, өндіру әдісі және физика-химиялық қасиеттері
Аминобензой қышқылы және оның туындыларының синтезі, өндіру әдісі және физика-химиялық қасиеттері Термохимия. Термодинамические параметры
Термохимия. Термодинамические параметры Презентация на тему Озоновая дыра
Презентация на тему Озоновая дыра  СТЕПЕНЬ ОКИСЛЕНИЯ
СТЕПЕНЬ ОКИСЛЕНИЯ Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Урок №2
Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Урок №2 Основы кристаллографии
Основы кристаллографии ZhK_Prezentatsia_1
ZhK_Prezentatsia_1 Круговорот серы в природе
Круговорот серы в природе Карбоновые кислоты
Карбоновые кислоты Аминокислоты и их применение
Аминокислоты и их применение Обмен углеводов
Обмен углеводов Химия – наука, преобразующая мир для учеников. 7-8 классов
Химия – наука, преобразующая мир для учеников. 7-8 классов Химические уравнения
Химические уравнения Взаимодействие кислот с металлами
Взаимодействие кислот с металлами Обобщение свойств углеводородов
Обобщение свойств углеводородов Растворение при наличии инертных компонентов
Растворение при наличии инертных компонентов Химические свойства воды
Химические свойства воды Карбоновые кислоты
Карбоновые кислоты Интерактивный плакат Алканы
Интерактивный плакат Алканы