Содержание
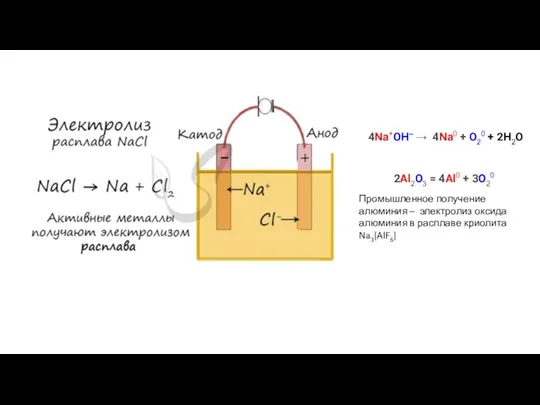
- 2. Электролиз
- 3. Электролиз - химическая реакция, происходящая при прохождении постоянного тока через электролит. Это разложение веществ на их
- 4. Процессы на катоде (-) К катоду притягиваются катионы (+ заряженные ионы) В зависимости от положения металла
- 5. Процессы на аноде (+) К аноду притягиваются анионы (- заряженные ионы)
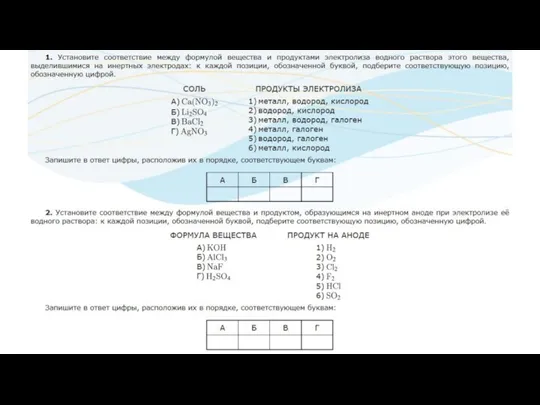
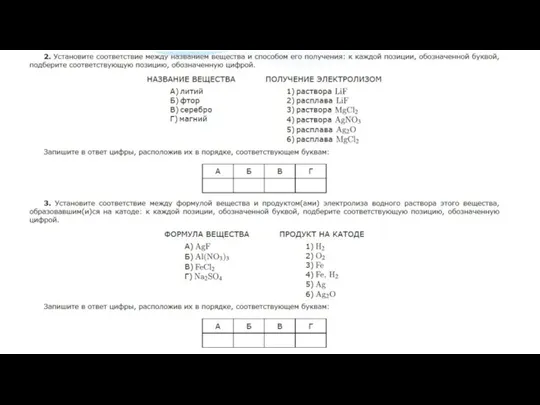
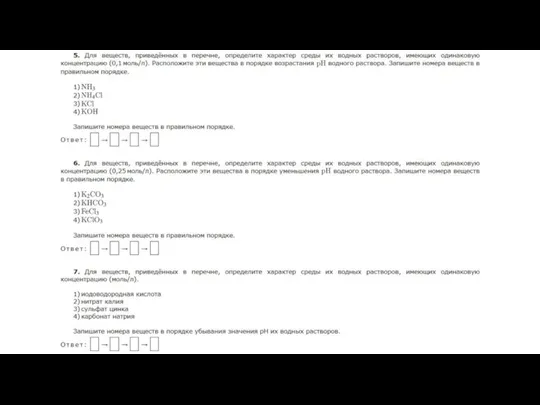
- 6. NaCl, AgNO3, CuCl2, KF, CH3COOK
- 7. 4Na+OH– → 4Na0 + O20 + 2H2O 2Al2О3 = 4Al0 + 3О20 Промышленное получение алюминия –
- 8. Если материал электродов выполнен из того же металла, который присутствует в растворе в виде соли, или
- 12. Гидролиз Гидролиз - процесс расщепления молекул сложных химических веществ за счет реакции с молекулами воды.
- 13. Гидролиз солей может протекать: → обратимо: только небольшая часть частиц исходного вещества гидролизуется. → необратимо: практически
- 14. Обратимый гидролиз солей 1. Соли, образованные сильным основанием и слабой кислотой, гидролизуются ПО АНИОНУ. Примеры таких
- 15. 2. Соли, образованные слабым основанием и сильной кислотой, гидролизуются ПО КАТИОНУ. Пример такой соли: NH4Cl, FeCl3,
- 16. 3. Соли, образованные слабым основанием и слабой кислотой, гидролизуются И ПО КАТИОНУ, И ПО АНИОНУ. Примеры
- 17. Необратимый гидролиз солей выделяется ↓,↑ или вода. Необратимый гидролиз является химической реакцией: 2МеCl2 + 2Na2CO3 +
- 21. Комплексные соединения
- 22. [Cu(NH3)4]SO4 – сульфат тетраамминмеди (II), [Ni(H2O)6]Cl2 – хлорид гексаакваникеля (II). Na2[Zn(OH)4] – тетрагидроксоцинкат (II) натрия; K4[Fe(CN)6]
- 24. Скачать презентацию
















![[Cu(NH3)4]SO4 – сульфат тетраамминмеди (II), [Ni(H2O)6]Cl2 – хлорид гексаакваникеля (II). Na2[Zn(OH)4] –](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1176372/slide-21.jpg)
 Альдегиды, гомология, изомерия, номенклатура
Альдегиды, гомология, изомерия, номенклатура Обобщение и повторение за курс основной школы по химии. 9 класс
Обобщение и повторение за курс основной школы по химии. 9 класс Арены. Электронное строение молекулы бензола. Гомологический ряд аренов, номенклатура, изомерия
Арены. Электронное строение молекулы бензола. Гомологический ряд аренов, номенклатура, изомерия 1_
1_ Алканы. Циклоалканы
Алканы. Циклоалканы Галогены и их соединения
Галогены и их соединения Расчеты по химическим уравнениям реакций
Расчеты по химическим уравнениям реакций Кислоты. Кислоты в животном мире
Кислоты. Кислоты в животном мире Коллоидные системы
Коллоидные системы Биохимия статическая, динамическая, функциональная
Биохимия статическая, динамическая, функциональная Презентация на тему Основные законы науки химии
Презентация на тему Основные законы науки химии  Основания. Классификация, состав и номенклатура оснований
Основания. Классификация, состав и номенклатура оснований Презентация на тему Нефть. Переработка нефти
Презентация на тему Нефть. Переработка нефти  Альдегиды и кетоны (часть 2)
Альдегиды и кетоны (часть 2) Строение органических молекул. (Лекция 2)
Строение органических молекул. (Лекция 2) Презентация на тему Гормоны
Презентация на тему Гормоны  Ovr-1
Ovr-1 Химические и физические свойства воды
Химические и физические свойства воды Алканы 10-класс
Алканы 10-класс Презентация на тему Химические свойства металлов
Презентация на тему Химические свойства металлов  Металлом называется светлое тело, которое ковать можно
Металлом называется светлое тело, которое ковать можно Конденсированные гетероциклы. Нуклеотиды. Нуклеиновые кислоты
Конденсированные гетероциклы. Нуклеотиды. Нуклеиновые кислоты Алкины. Пропин
Алкины. Пропин Применение алкенов
Применение алкенов Презентация на тему Кислород О2
Презентация на тему Кислород О2  Интеллектуальная игра по теме: «Периодический закон и система химических элементов Д.И. Менделеева». «Химический дом и его обитат
Интеллектуальная игра по теме: «Периодический закон и система химических элементов Д.И. Менделеева». «Химический дом и его обитат Криптон. Самостоятельная работа
Криптон. Самостоятельная работа Презентация на тему Классификация химических реакций (11 класс)
Презентация на тему Классификация химических реакций (11 класс)