Слайд 2Общее условие равновесия в гетерогенных системах
Равновесия в гетерогенных системах, в которых

не происходит химического взаимодействия между компонентами, а имеют место лишь фазовые переходы, т. е. процессы перехода компонентов из одной фазы в другую (или в другие), будем называть фазовыми равновесиями.
Компонентом, или составной частью системы называется каждое из содержащихся в ней химически однородных веществ, которое может быть выделено из нее и может существовать в изолированном виде длительное время.
Слайд 4Из какого бы числа компонентов и из какого бы числа фаз ни

состояла гетерогенная система, условием равновесия между фазами в ней: химический потенциал любого данного компонента должен быть одинаковым во всех фазах системы.
Если dG < 0, то μi(а) > μi(β). Следовательно, самопроизвольный переход любого данного компонента i из фазы а в фазу β может происходить только в том случае, если его химический потенциал в фазе а был больше, чем в фазе β. При продолжении процесса эти химические потенциалы будут все больше сближаться, и когда они станут равными, будет достигнуто состояние равновесии между фазами в отношении распределения между ними компонента i.
Слайд 5Равновесные соотношения при фазовых переходах

Слайд 9Уравнение содержит две индивидуальные (т. е. различные для разных веществ) постоянные (ΔH

и С). Если одна из них известна (ΔH испарения), то достаточно знать давление при одной температуре, чтобы определить С и иметь возможность применять уравнение для расчета давлении при других температурах или для расчета температур кипения при различных давлениях.
Возможность приведения какой-нибудь исследуемой зависимости к линейной форме всегда сильно облегчает задачу, так как для определения положения прямой достаточно знать всего две точки (т. е. в данном случае — давления пара при двух температурах). Положение других точек в этом случае определяется интерполяцией или частично экстраполяцией (графическим или аналитическим путем).
Слайд 10Если же ΔH неизвестна, то необходимо знать давления при двух температурах и,

подставив их в уравнение, получить два уравнения с двумя неизвестными (ΔH и С). Последние определяются путем решения системы этих двух уравнений.
Подставляя найденные значения в уравнение, получаем возможность применить его как для определения давлений при заданной температуре, так и для обратного расчета.
Вычисленные значения ΔH часто обладают практически такой же точностью, как получаемые непосредственным измерением теплоты испарения.
Слайд 11Зависимость температур плавления и полиморфного превращения от внешнего давления

Слайд 13Плавление почти всех веществ сопровождается увеличением объема, т. е. ΔV > 0.
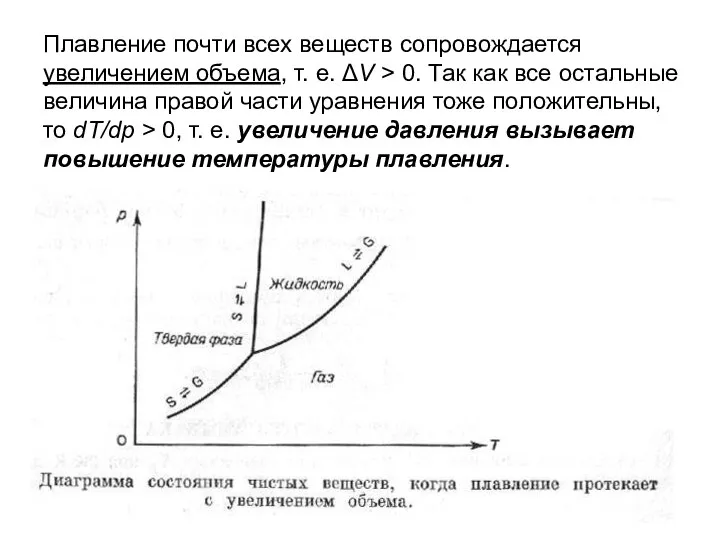
Так как все остальные величина правой части уравнения тоже положительны, то dT/dp > 0, т. е. увеличение давления вызывает повышение температуры плавления.












 Презентация на тему Электрохимический ряд напряжений металлов
Презентация на тему Электрохимический ряд напряжений металлов  Дисперсные системы с твёрдой средой и газообразной фазой
Дисперсные системы с твёрдой средой и газообразной фазой _Периодический закон. Распределение электронов по энергетическим уровням и подуровням (1)
_Периодический закон. Распределение электронов по энергетическим уровням и подуровням (1) Молярный объем
Молярный объем Щелочные металлы — это элементы главной подгруппы I группы
Щелочные металлы — это элементы главной подгруппы I группы Металлом называется светлое тело, которое ковать можно
Металлом называется светлое тело, которое ковать можно Презентация на тему Нанохимия
Презентация на тему Нанохимия  Элементы и атомы, В менделеевский взяты круг Сделали химию самой богатой И самой творческой из наук.
Элементы и атомы, В менделеевский взяты круг Сделали химию самой богатой И самой творческой из наук. Современная аналитическая химия.Учебная литература
Современная аналитическая химия.Учебная литература Урок № 4
Урок № 4 Фторопласты и их использование
Фторопласты и их использование Свойства солей, оксидов, оснований
Свойства солей, оксидов, оснований Криогенный разрыв пласта
Криогенный разрыв пласта Астат. Свойства астата
Астат. Свойства астата Презентация на тему Сведения о воде
Презентация на тему Сведения о воде  Стероиды. Дицетин-холестерин-ацилтрансферазная реакция
Стероиды. Дицетин-холестерин-ацилтрансферазная реакция Направление процесса. ОВР
Направление процесса. ОВР Гликолиз. Глюконеогенез. Пентозофосфатный путь
Гликолиз. Глюконеогенез. Пентозофосфатный путь Применение центрифугирования
Применение центрифугирования Основания. 8 класс
Основания. 8 класс Презентация по Химии "Строение и физические свойства металлов"
Презентация по Химии "Строение и физические свойства металлов"  Химические свойства металлов. Электрохимический ряд напряжения металлов
Химические свойства металлов. Электрохимический ряд напряжения металлов Звездный час. Конкурс химиков
Звездный час. Конкурс химиков Bool-doser team
Bool-doser team Вещество. Свойства вещества. Урок №2
Вещество. Свойства вещества. Урок №2 Титриметрический анализ
Титриметрический анализ Проточные реакторы непрерывного действия. (Лекция 5)
Проточные реакторы непрерывного действия. (Лекция 5) Химический анализ
Химический анализ