Слайд 2Углерод
Положение в ПС и особенности строения атома
Физические свойства углерода. Аллотропия.
Адсорбция
Химические

свойства
Углерод в природе. Применение углерода.
Слайд 3Строение атома углерода
Аr = 12
+6С (6 р; 6 n)6е
1S2 2S2

2P2
2S1 2P3
Степени окисления: -4, 0, +2, +4
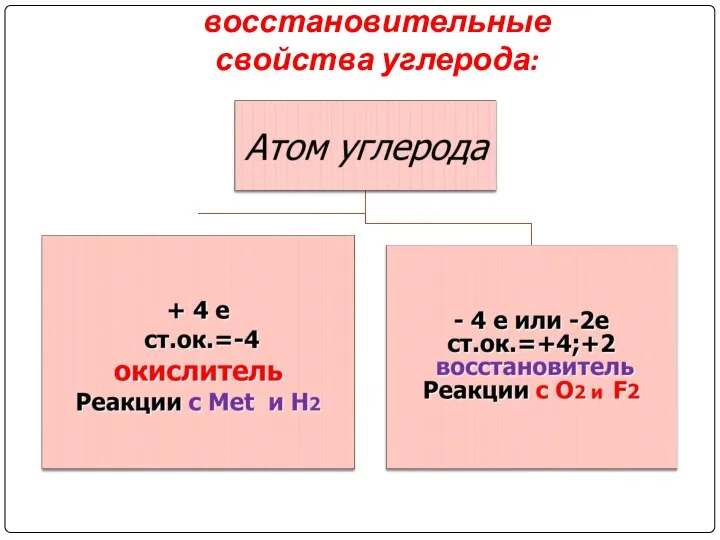
Слайд 4
Окислительно-восстановительные
свойства углерода:
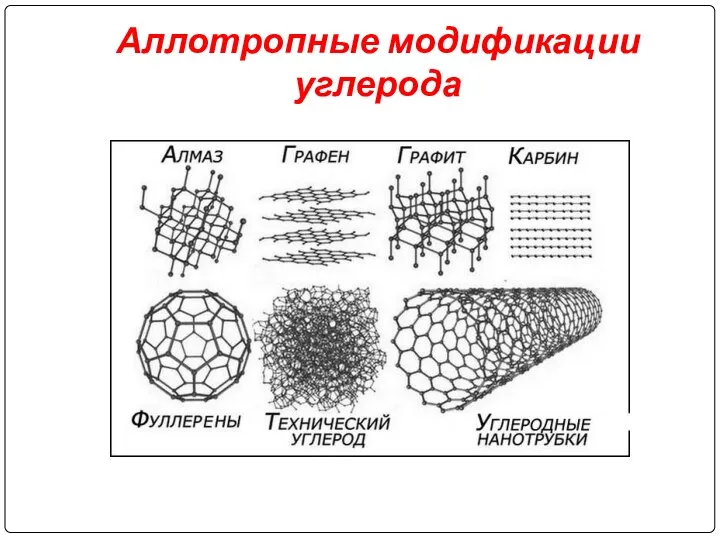
Слайд 5Аллотропные модификации углерода
Слайд 6Алмаз
Прозрачный (изредка окрашен)
Очень твердый
Преломляет свет (светится)
Не проводит ток
Плохо проводит тепло
Атомная кристаллическая решетка
При

10000С без доступа воздуха превращается в графит
Слайд 7
Искусственно ограненные алмазы называются бриллиантами

Слайд 8 Вес алмаза измеряется в каратах, сокращение ct.
Само слово «карат» происходит от

названия семян караибского дерева, которые служили в древности природной мерой веса алмазов.
Один карат соответствует 0,2 г.
Слайд 9Держава
и
Большой бриллиантовый букет

Слайд 10Колумбийский изумруд
и
Цейлонский сапфир

Слайд 14Графит
Темно - серое слоистое кристаллическое вещество
Слабый металлический блеск
Мягкий
Проводит электрический ток
Жирное на ощупь
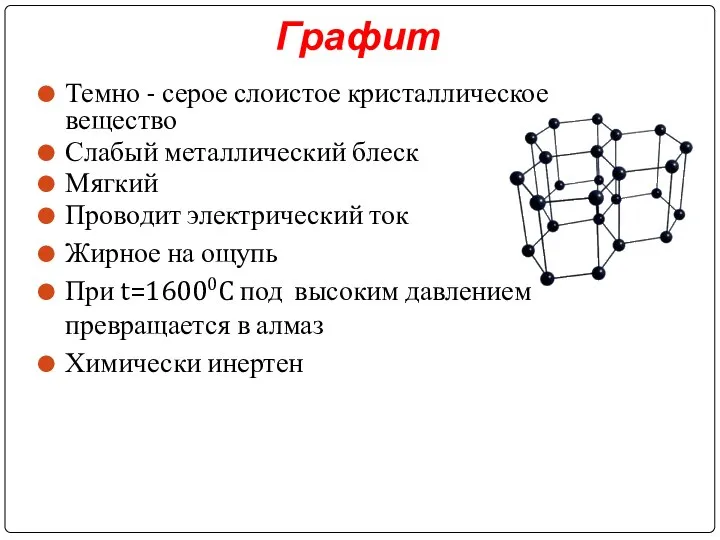
При t=16000C под высоким давлением превращается в алмаз
Химически инертен
Слайд 15Карбин
Мелкокристаллический порошок, черного цвета
Состоит из прямолинейных цепочек углеродных атомов
Полупроводник
При нагревании до высоких

температур без доступа воздуха превращается в графит
Слайд 16Фуллерены
Замкнутая сферическая структура
Образованна из определённого числа атомов углерода - С60, С70, С84

Молекула фуллерена представляет собой шар, поверхность которого состоит из пяти – и шестичленных циклов
Впервые фуллерены были синтезированы в 80-х годах XX века.
Слайд 17
Аморфный углерод
не является аллотропным видоизменением углерода, а представляет собой мелкокристаллический

графит.
Сортами этого углерода являются
древесный уголь,
кокс сажа
стеклоуглерод
Слайд 18
Адсорбция
явление адсорбции было открыто русским химиком ЛОВИЦЕМ

Слайд 19Адсорбция – свойства угля и других твердых веществ поглощать и удерживать на

своей поверхности газообразных или растворенных веществ
Адсорбенты – вещества , на поверхности которых происходит адсорбция
Десорбция - обратный адсорбции процесс -выделение поглощенных веществ
Слайд 20Н.Д.Зелинский
на основе адсорбционных свойств
древесного угля разработал
фильтрующий противогаз
Николай Дмитриевич Зелинский

(1861-1953)
профессор Московского Университета, академик
Слайд 21Химические свойства углерода
Углерод – окислитель:
Реакции с простыми веществами
C + 4Na →

Na4C
2C + Ca → CaC2
3C + 4Al → Al4C3
C + 2H2 → CH4
Слайд 22Химические свойства углерода
Углерод – восстановитель:
Реакции с простыми веществами
C + O2 →

CO2
2 C + O2 → 2CO
C + 2 Cl2 → CCl4
C + 2 S→ CS2
Реакции со сложными веществами
C + H2O → CO + H2↑
C + 2 CuO → 2 Cu + CO2
C + 4 HNO3 конц. → CO2 + 4 NO2 + 2 H2O
C + 2 H2SO4 конц. → CO2 + 2 SO2 + 2 H2O





















 Химический анализ
Химический анализ Строение бензола
Строение бензола Металлы. Повторение
Металлы. Повторение Классификация органических соединений. 10 класс
Классификация органических соединений. 10 класс Валентность
Валентность Аминокислоты. Классификация, номенклатура
Аминокислоты. Классификация, номенклатура Характеристика химического элемента на основании его положения в Периодической системе Д. И. Менделеева
Характеристика химического элемента на основании его положения в Периодической системе Д. И. Менделеева Классы неорганических веществ
Классы неорганических веществ Медь и ее сплавы
Медь и ее сплавы Простые и сложные вещества. Основные классы неорганических веществ
Простые и сложные вещества. Основные классы неорганических веществ валентность (1)
валентность (1) Химия в космосе Автор: Гриб Яна ученица 8а класса школа №484. Научный руководитель: Бирюкова Зоя Владимировна.
Химия в космосе Автор: Гриб Яна ученица 8а класса школа №484. Научный руководитель: Бирюкова Зоя Владимировна. Мыла и синтетические
Мыла и синтетические Теория химического строения А. М. Бутлерова
Теория химического строения А. М. Бутлерова Виды металлов, сплавы металлов, применение в промышленности и в быту
Виды металлов, сплавы металлов, применение в промышленности и в быту Графический диктант. Азот и Аммиак
Графический диктант. Азот и Аммиак lektsia_7
lektsia_7 Электролитическая диссоциация. 8 класс
Электролитическая диссоциация. 8 класс Электрокинетические явления. Электрофорез. Макро- и микроэлектрофорез. Лекция 9
Электрокинетические явления. Электрофорез. Макро- и микроэлектрофорез. Лекция 9 Презентация на тему Вещества и их свойства
Презентация на тему Вещества и их свойства  Химия в игре. Проектная работа
Химия в игре. Проектная работа Спирты. Непредельные спирты
Спирты. Непредельные спирты АТФ и другие органические соединения клетки
АТФ и другие органические соединения клетки Классификация видов износа
Классификация видов износа Свойства неметаллов и их соединений
Свойства неметаллов и их соединений Химическое равновесие и способы его смещения
Химическое равновесие и способы его смещения Материаловедение. Строение металлических материалов. Металлические сплавы
Материаловедение. Строение металлических материалов. Металлические сплавы Комплексонометрическое титрование. Часть 1. Лекция 6
Комплексонометрическое титрование. Часть 1. Лекция 6