Содержание
- 2. Кислород как вещество
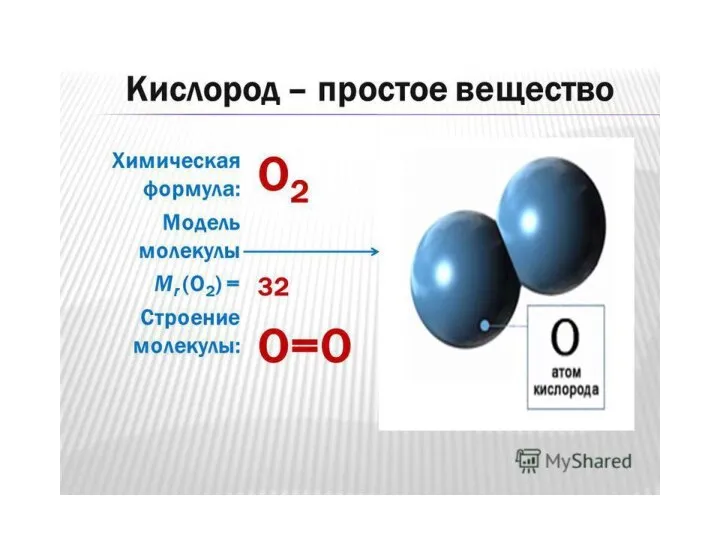
- 3. Кислород как вещество
- 4. Характеристика кислорода как вещества 1. Строение молекулы кислорода 2. Распространение вещества в природе. 3. Способы получения
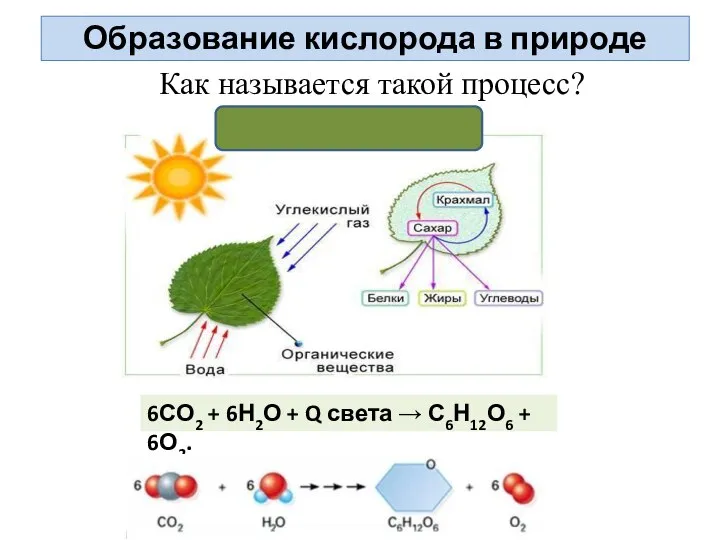
- 6. Как называется такой процесс? 6СО2 + 6Н2О + Q света → С6Н12О6 + 6О2. Образование кислорода
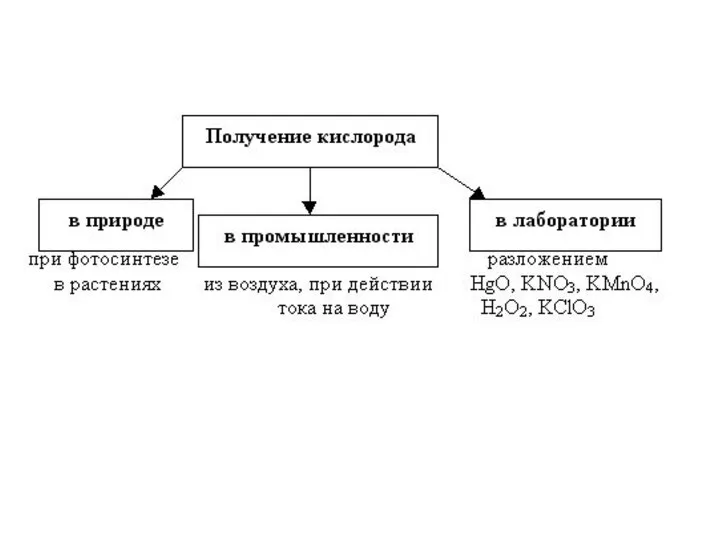
- 8. Получение кислорода в промышленности жидкий кислород В промышленности – из жидкого воздуха.
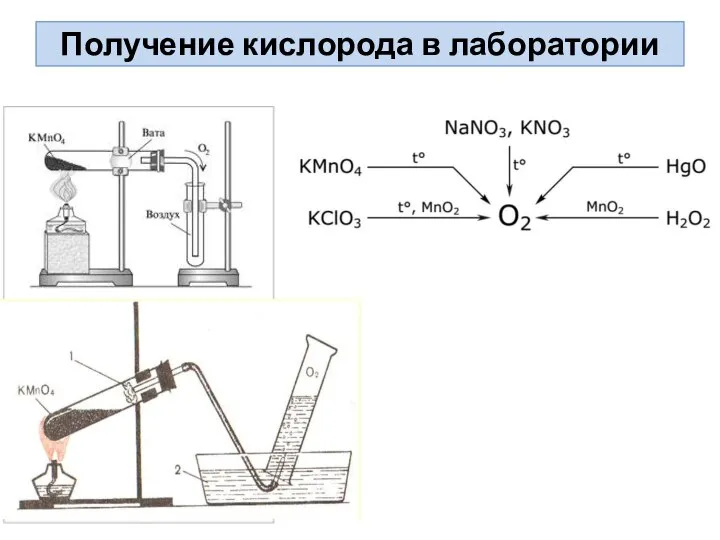
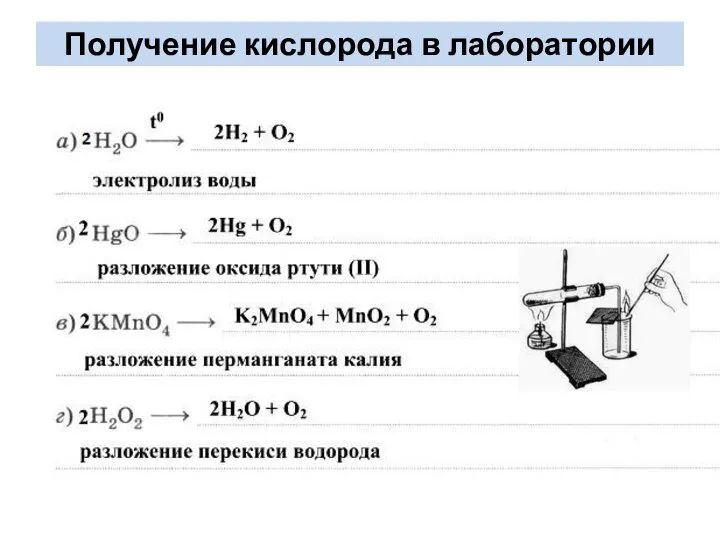
- 9. Получение кислорода в лаборатории
- 10. Способы получения кислорода Разложение перманганата калия при нагревании: 2KMnO4 –t°200 ° → K2MnO4 + MnO2 +
- 11. Получение кислорода в лаборатории
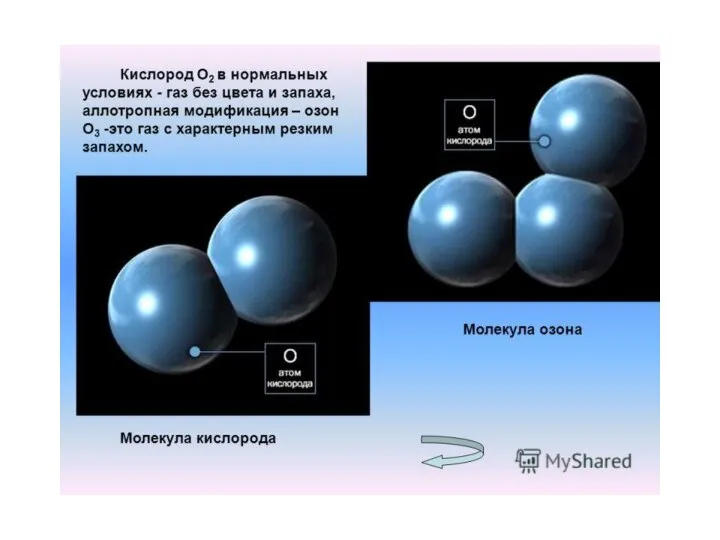
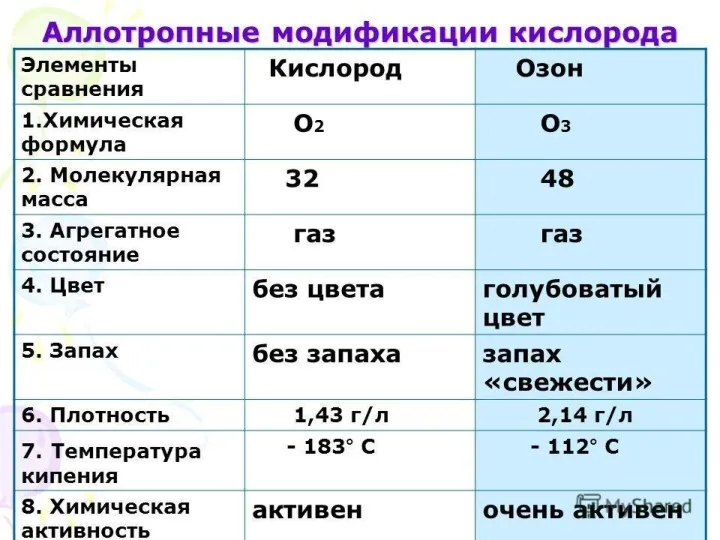
- 12. 16 ФИЗИЧЕСКИЕ СВОЙСТВА КИСЛОРОДА Кислород – газ, без цвета и запаха, мало растворим в воде –
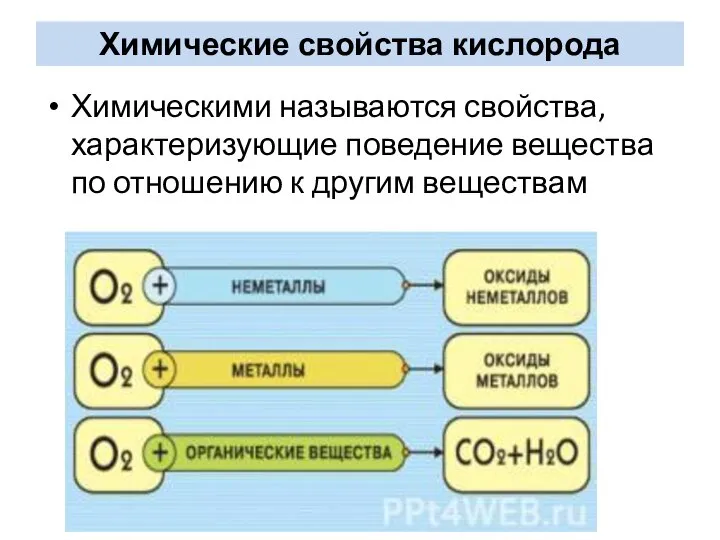
- 13. Химические свойства кислорода Химическими называются свойства, характеризующие поведение вещества по отношению к другим веществам
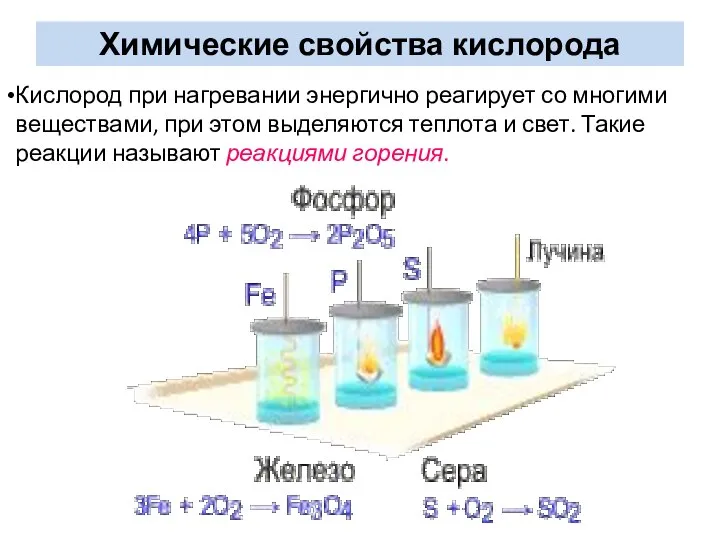
- 14. Кислород при нагревании энергично реагирует со многими веществами, при этом выделяются теплота и свет. Такие реакции
- 15. Составьте уравнения реакций горения в кислороде этих веществ.
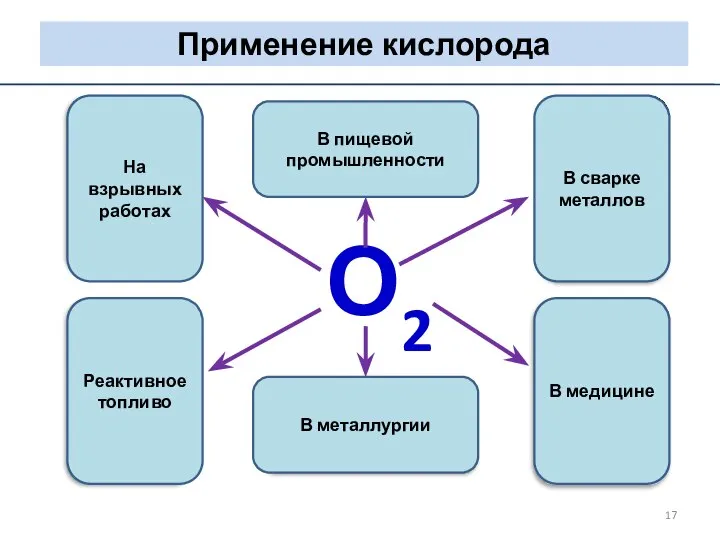
- 17. О2 Реактивное топливо В медицине На взрывных работах В сварке металлов В металлургии В пищевой промышленности
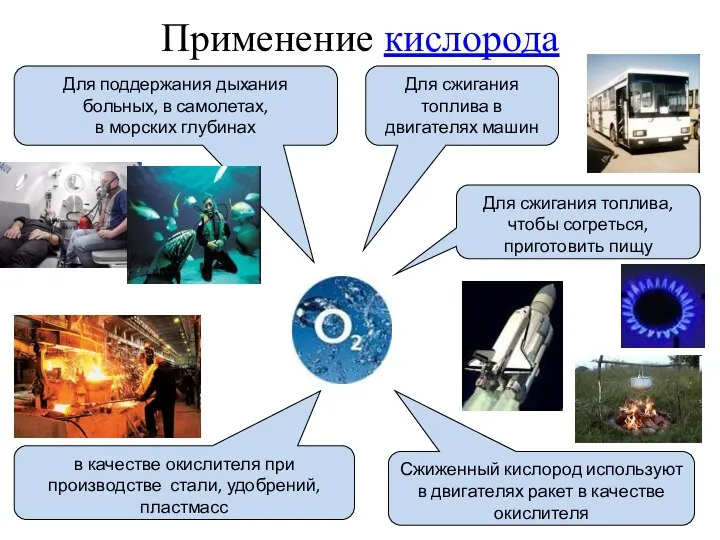
- 18. ПРИМЕНЕНИЕ КИСЛОРОДА
- 19. Применение кислорода Для поддержания дыхания больных, в самолетах, в морских глубинах Для сжигания топлива в двигателях
- 20. Окисление пищи – источник энергии. Кислород доставляется гемоглобином, который образует соединение – оксигемоглобин. Оно окисляет белки,
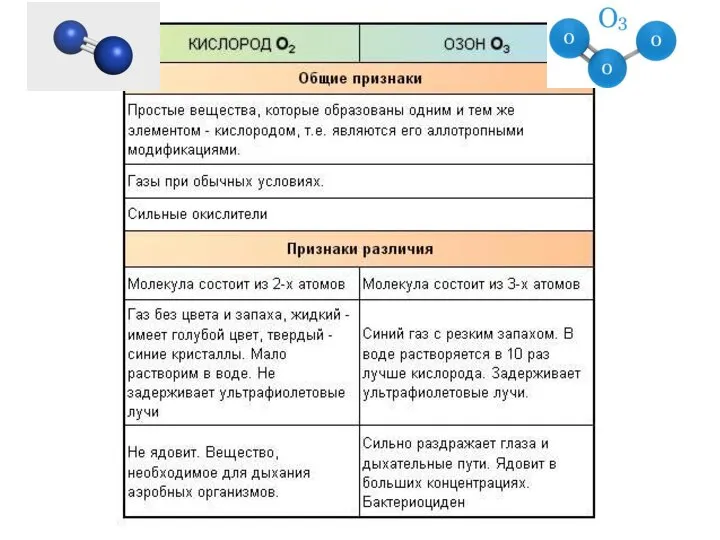
- 21. Нахождение в природе Кислород в природе Кислород О2 Озон О3
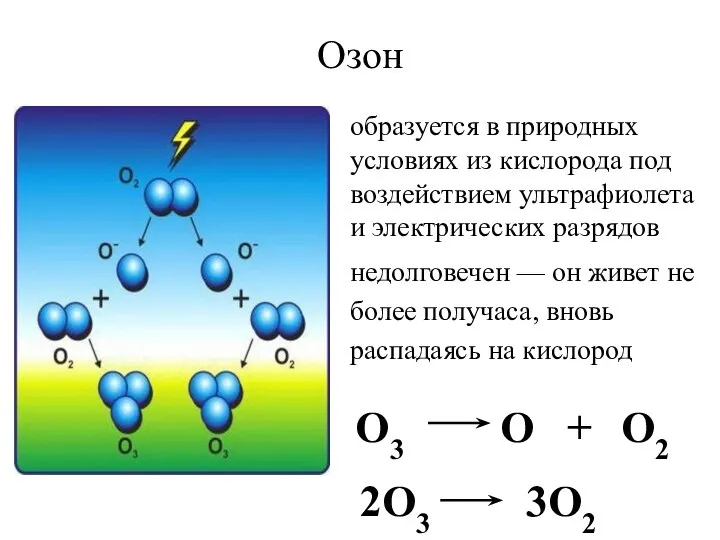
- 23. недолговечен — он живет не более получаса, вновь распадаясь на кислород Озон O3 O + O2
- 24. Озон- аллотропная модификация кислорода
- 27. снижение цветности и повышение прозрачности воды; удаление привкусов и запахов ионов железа, марганца и других металлов;
- 28. Озонирование воздуха в помещении позволяет избавиться от вредных микроорганизмов, бытовых клещей, тараканов и мышей. Озонатор для
- 29. Позволяет резко снизить обсемененность поверхности плодов и овощей гнилостной микрофлорой. Озонирование плодоовощной продукции
- 30. Используется для очистки овощей , фруктов, воды, обработки мяса. Озонатор бытовой
- 31. Характеристика кислорода
- 32. Как погасить горящую древесину? Загоревшуюся на человеке одежду? Горящую на поверхности воды нефть?
- 34. Скачать презентацию
















 Классификация органических веществ
Классификация органических веществ Ароматические углеводороды - Арены
Ароматические углеводороды - Арены Сильные и слабые кислоты и основания
Сильные и слабые кислоты и основания Алкины
Алкины Презентация по Химии "Sulfur"
Презентация по Химии "Sulfur"  Алкины
Алкины Процессы массопередачи в гомогенных средах
Процессы массопередачи в гомогенных средах Презентация на тему Вычисления массовой доли растворенного вещества
Презентация на тему Вычисления массовой доли растворенного вещества  Статистика в аналитической химии
Статистика в аналитической химии Мы́ло — жидкий или твёрдый продукт, содержащий поверхностноактивные вещества
Мы́ло — жидкий или твёрдый продукт, содержащий поверхностноактивные вещества Основания и кислоты в повседневной жизни
Основания и кислоты в повседневной жизни Железо
Железо Сокровища соляных дворцов
Сокровища соляных дворцов Типы реакций в неорганической химии. Гидролиз. Электролиз
Типы реакций в неорганической химии. Гидролиз. Электролиз kisloty
kisloty Углеводороды
Углеводороды Презентация на тему Чистые вещества и смеси
Презентация на тему Чистые вещества и смеси  Презентация на тему Применение спиртов
Презентация на тему Применение спиртов  химия конеч 3.0
химия конеч 3.0 Особенности базового курса органической химии издательства «ОЛМА»
Особенности базового курса органической химии издательства «ОЛМА» Эффект растворителя при определении пространственной структуры сложных гетероциклических соединений
Эффект растворителя при определении пространственной структуры сложных гетероциклических соединений Основания. 8 класс
Основания. 8 класс Характеристика химического элемента-неметалла на основании его положения в ПСХЭ Д.И.Менделеева. 9 класс
Характеристика химического элемента-неметалла на основании его положения в ПСХЭ Д.И.Менделеева. 9 класс Презентация на тему Алюминий и его соединения
Презентация на тему Алюминий и его соединения 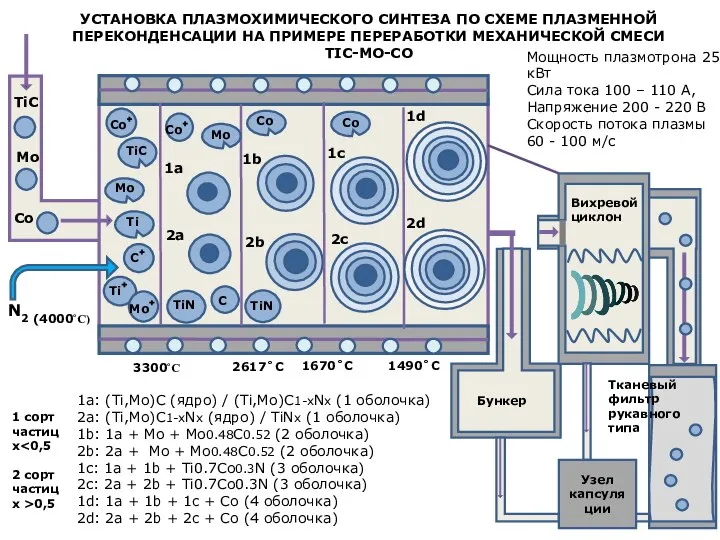 Установка плазмохимического синтеза по схеме плазменной переконденсации на примере переработки механической смеси tic-mo-co
Установка плазмохимического синтеза по схеме плазменной переконденсации на примере переработки механической смеси tic-mo-co Химические свойства металлов. Электрохимический ряд напряжения металлов
Химические свойства металлов. Электрохимический ряд напряжения металлов Изучение адсорбции аминокислот на поверхности гидроксилапатита при варьировании рН
Изучение адсорбции аминокислот на поверхности гидроксилапатита при варьировании рН Безопасная пластмасса
Безопасная пластмасса