Содержание
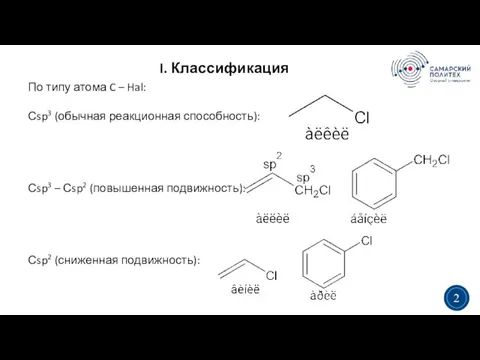
- 2. I. Классификация 3 2 По типу атома C – Hal: Сsp3 (обычная реакционная способность): Сsp3 –
- 3. Классификация 3 3 • По количеству атомов галогенов: моно/ди/три/тетра … • По типу галогена: бромиды, йодиды,
- 4. Номенклатура 3 4 Номенклатура - по JUPAC или рац.: радикал + бромид/хлорид, например этилхлорид. Нумерация заместителя,
- 5. Галогенпроизводные со связью Сsp3–Hal. Получение 3 5 1. Галогенирование алканов SR: При достаточном количестве хлора реакция
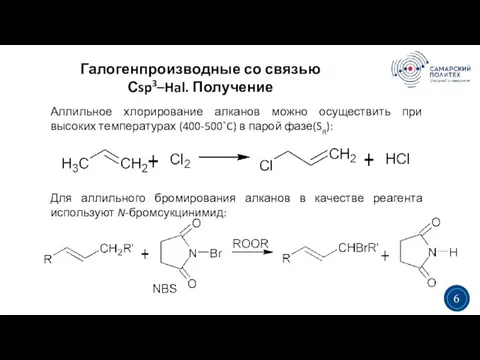
- 6. Галогенпроизводные со связью Сsp3–Hal. Получение 3 5 3 6 Аллильное хлорирование алканов можно осуществить при высоких
- 7. Галогенпроизводные со связью Сsp3–Hal. Получение 3 5 3. Присоединение к алкинам галогенводородов и галогенов: 4. Из
- 8. Галогенпроизводные со связью Сsp3–Hal. Получение 3 5 В качестве гидрогалогенирующих реагентов можно использовать комбинации «соль –
- 9. Галогенпроизводные со связью Сsp3–Hal. Получение 3 5 5. Из альдегидов и кетонов: 6. Замещение одного галогена
- 10. Фреоны (хладоны) 3 5 Фреоны (хладоны) — галогеноалканы, фтор- и хлорсодержащие производные насыщенных углеводородов (главным образом
- 11. Физические и химические свойства фреонов 3 5 Фреоны — бесцветные газы или жидкости, без запаха. Хорошо
- 12. Номенклатура фреонов 3 5 3 12 По международному стандарту ISO № 817-74 техническое обозначение фреона (хладона)
- 13. Номенклатура фреонов 3 5 3 13 число атомов хлора в соединении находят вычитанием суммарного числа атомов
- 14. Некоторые представители 3 5 3 14 1) Тетрафторметан CF4 — фреон-14, хладон-14. В микроэлектронике, отдельно, или
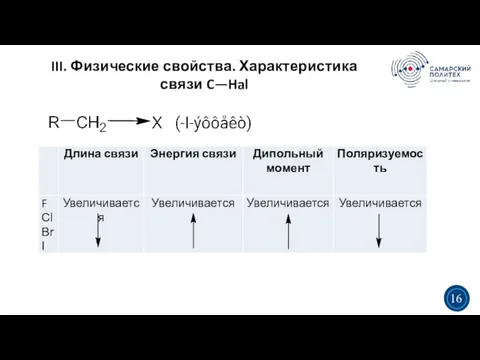
- 15. III. Физические свойства 3 5 3 15 ρ > 1, возрастает от F к I. Газы:
- 16. III. Физические свойства. Характеристика связи C—Hal 3 5 3 16
- 17. IV. Химические свойства 3 5 3 17 Взаимодействие с металлами: Элиминирование по правилу Зайцева (получение алкенов):
- 18. IV. Химические свойства 3 5 3 18 3. Восстановление: (или HI или Na+спирт) 4. Нуклеофильное замещение
- 19. IV. Химические свойства. Примеры 5 19 3 3 19
- 20. IV. Химические свойства 5 19 Нуклеофилом называется атом или частица, которая может отдать ē-пару любому элементу,
- 21. IV. Химические свойства 5 19 3 3 21 Нуклеофильные свойства зависят от ē-плотности на атоме и
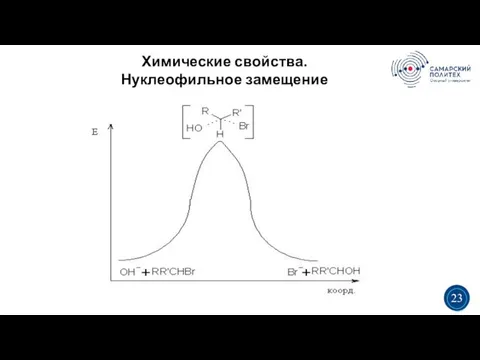
- 22. Химические свойства. Нуклеофильное замещение 5 19 Нуклеофильное замещение может протекать по механизмам SN1 и SN2. SN2:
- 23. Химические свойства. Нуклеофильное замещение 5 19 3 3 23
- 24. Химические свойства. Нуклеофильное замещение 5 19 SN2 — одностадийный синхронный процесс, сопровождается обращением конфигурации (вальденовское обращение):
- 25. Химические свойства. Нуклеофильное замещение 5 19 SN1. По механизму SN1 идёт гидролиз трет-бутилбромида, который состоит из
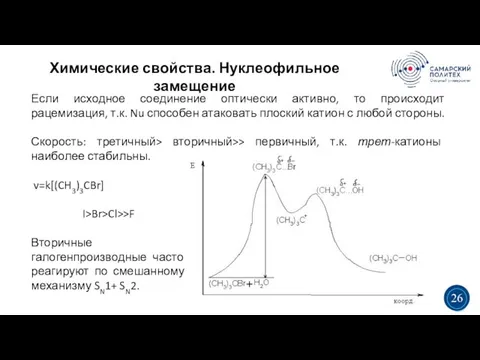
- 26. Химические свойства. Нуклеофильное замещение 5 19 Если исходное соединение оптически активно, то происходит рацемизация, т.к. Nu
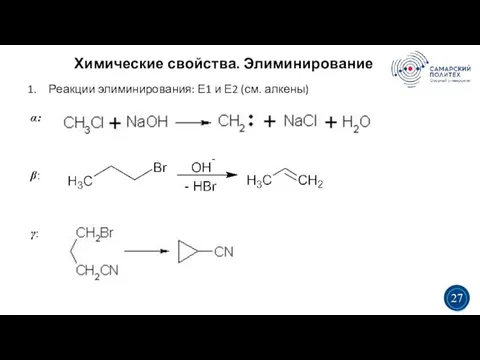
- 27. Химические свойства. Элиминирование 5 19 Реакции элиминирования: Е1 и Е2 (см. алкены) α: β: γ: 3
- 28. Химические свойства. Конкурирование нуклеофильного замещения и элиминирования 5 19 Конкурирующие реакции — Е2 и SN2. Реакции
- 29. Химические свойства. Конкурирование нуклеофильного замещения и элиминирования 5 19 Конкуренция Е1 и SN1: 1. Увеличение числа
- 30. Ненасыщенные галогенпроизводные 5 19 А) Винилгалогениды Получение: 3 3 30
- 31. Ненасыщенные галогенпроизводные 5 19 Химические свойства: По SN не реагирует из-за двойной связи. Характерны реакции AdE,
- 32. Ненасыщенные галогенпроизводные 5 19 Б) Аллилгалогениды 3 3 32 Получают реакцией аллильного замещения:
- 33. Ненасыщенные галогенпроизводные 5 19 3 3 33 Для введения брома – NBS – используют реакцию Воля-Циглера
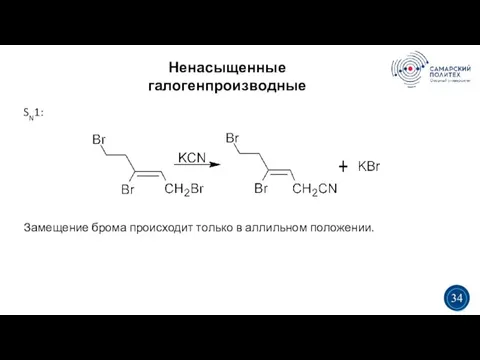
- 34. Ненасыщенные галогенпроизводные 5 19 3 3 34 SN1: Замещение брома происходит только в аллильном положении.
- 35. Ненасыщенные галогенпроизводные 5 19 3 3 35 В) Атом галогена изолирован от двойной связи: Нет взаимного
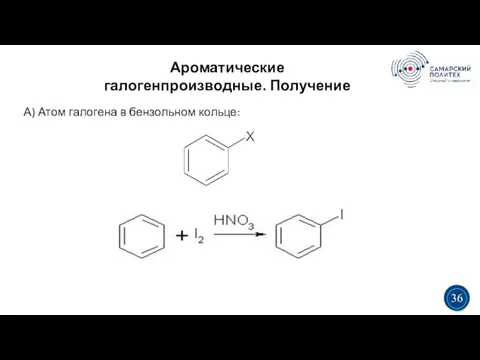
- 36. Ароматические галогенпроизводные. Получение 5 19 3 3 36 А) Атом галогена в бензольном кольце:
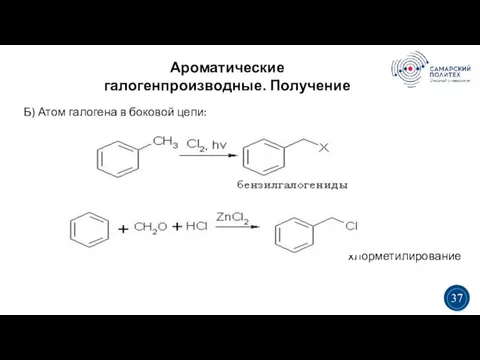
- 37. Ароматические галогенпроизводные. Получение 5 19 3 3 37 Б) Атом галогена в боковой цепи: хлорметилирование
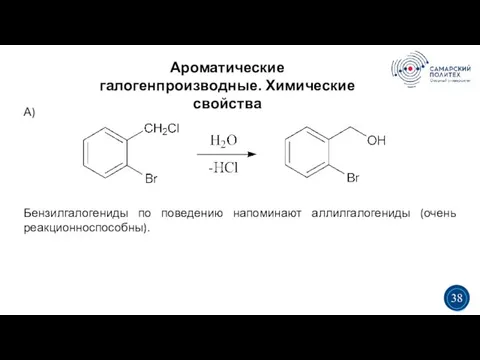
- 38. Ароматические галогенпроизводные. Химические свойства 5 19 3 3 38 А) Бензилгалогениды по поведению напоминают аллилгалогениды (очень
- 39. Ароматические галогенпроизводные. Химические свойства 5 19 3 3 39 Б) Ароматические галогенпроизводные не подвергаются реакциям замещения
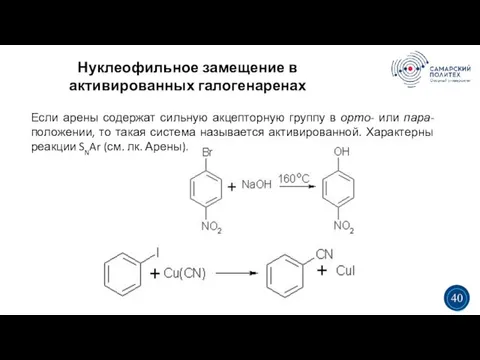
- 40. Нуклеофильное замещение в активированных галогенаренах 5 19 3 3 40 Если арены содержат сильную акцепторную группу
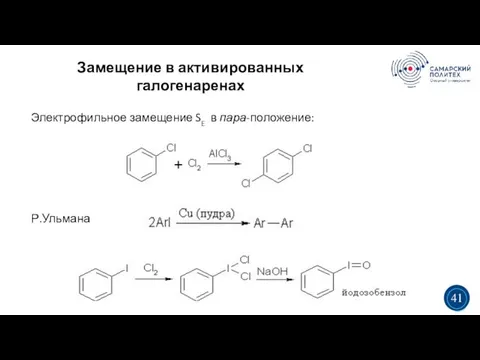
- 41. Замещение в активированных галогенаренах 5 19 3 3 41 Электрофильное замещение SE в пара-положение: Р.Ульмана
- 43. Скачать презентацию




























 Создание теплостойких эластомерных материалов на основе фторкаучуков
Создание теплостойких эластомерных материалов на основе фторкаучуков Скорость химических реакций
Скорость химических реакций Методы разделения смесей веществ
Методы разделения смесей веществ Технология одноступенчатого гидрокрекинга. Аппаратное оформление и основные технологические решения
Технология одноступенчатого гидрокрекинга. Аппаратное оформление и основные технологические решения Своя игра. Металлы и неметаллы
Своя игра. Металлы и неметаллы Взаимное влияние атомов в молекулах
Взаимное влияние атомов в молекулах Атом- сложная частица
Атом- сложная частица Характеристика химического элемента по его положению в периодической системе элементов Д.И. Менделеева
Характеристика химического элемента по его положению в периодической системе элементов Д.И. Менделеева Ароматические углеводороды - Арены
Ароматические углеводороды - Арены Методы выделения и разделения радионуклидов
Методы выделения и разделения радионуклидов Сырье химической промышленности
Сырье химической промышленности Степени окисления химических элементов
Степени окисления химических элементов Презентация на тему Количество вещества
Презентация на тему Количество вещества  Физические свойства металлов
Физические свойства металлов Выращивание кристаллов медного купороса с использованием воды различной степени очистки
Выращивание кристаллов медного купороса с использованием воды различной степени очистки Химическая кинетика. Экзаменационные вопросы
Химическая кинетика. Экзаменационные вопросы Галогены
Галогены Наука Химия на Великой Отечественной войне
Наука Химия на Великой Отечественной войне Кристаллы и кристаллизация. Виды загрязнений поликристаллов и способы их предотвращения
Кристаллы и кристаллизация. Виды загрязнений поликристаллов и способы их предотвращения Химическое сопротивление материалов
Химическое сопротивление материалов Амины
Амины Коррозионно-активное воздействие на РЭС. Оценка коррозионной стойкости. Лекция №11
Коррозионно-активное воздействие на РЭС. Оценка коррозионной стойкости. Лекция №11 Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Уравнения химических реакций
Уравнения химических реакций Калийные удобрения. Лекция 28
Калийные удобрения. Лекция 28 Химическая кинетика
Химическая кинетика Соли. 8 класс
Соли. 8 класс Скорость химической реакции
Скорость химической реакции