Содержание
- 2. Вода При разложении воды электрическим током образуются газы: водород (Н2) и кислород (О2). Образуется 2л водорода,
- 3. Вода Химические свойства воды. Вода вступает в реакцию со многими сложными и простыми веществами. С активными
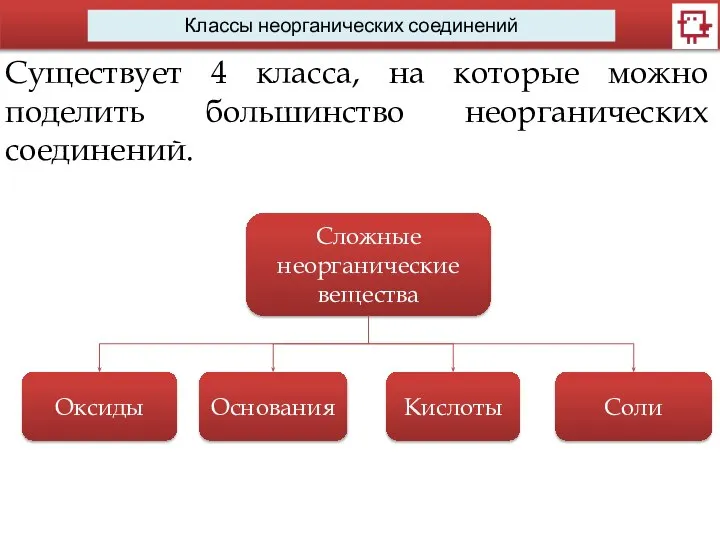
- 4. Классы неорганических соединений Существует 4 класса, на которые можно поделить большинство неорганических соединений. Сложные неорганические вещества
- 5. Классы неорганических соединений Оксиды Оксиды – это сложные вещества, которые состоят из двух элементов, одним из
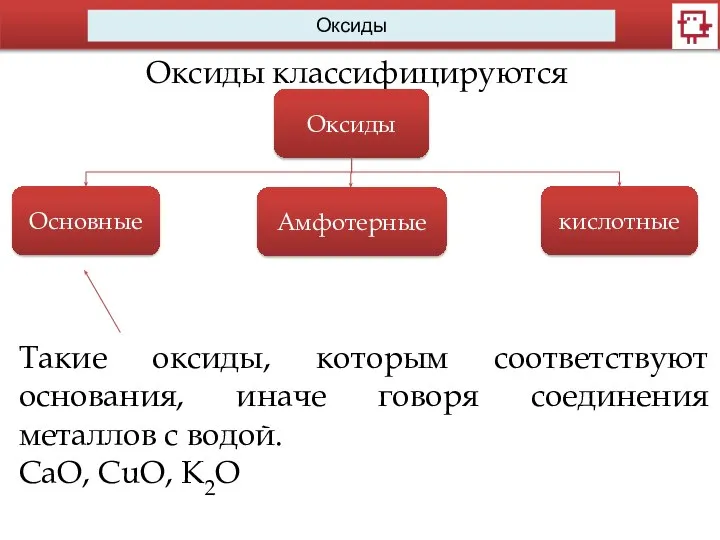
- 6. Оксиды Оксиды классифицируются Оксиды Основные Амфотерные кислотные Такие оксиды, которым соответствуют основания, иначе говоря соединения металлов
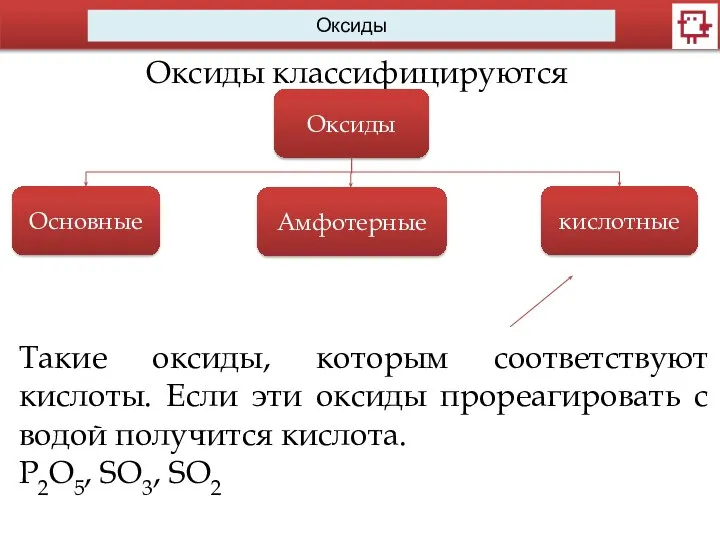
- 7. Оксиды Оксиды классифицируются Оксиды Основные Амфотерные кислотные Такие оксиды, которым соответствуют кислоты. Если эти оксиды прореагировать
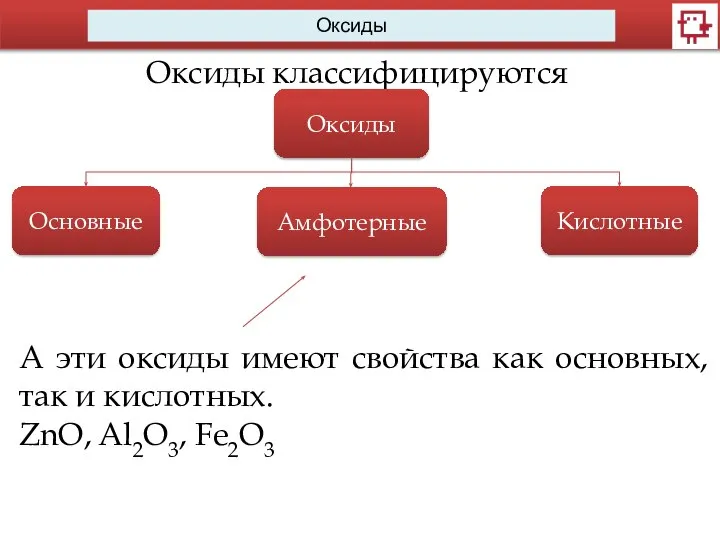
- 8. Оксиды Оксиды классифицируются Оксиды Основные Амфотерные Кислотные А эти оксиды имеют свойства как основных, так и
- 9. Оксиды Оксиды, которым соответствуют основания, называются основными. Na2O + H2O =2NaOH Как правило, основные оксиды образуют
- 10. Оксиды Названия оксидов. Если, это оксид, в который входит элементы с постоянной валентностью, о ней дополнительно
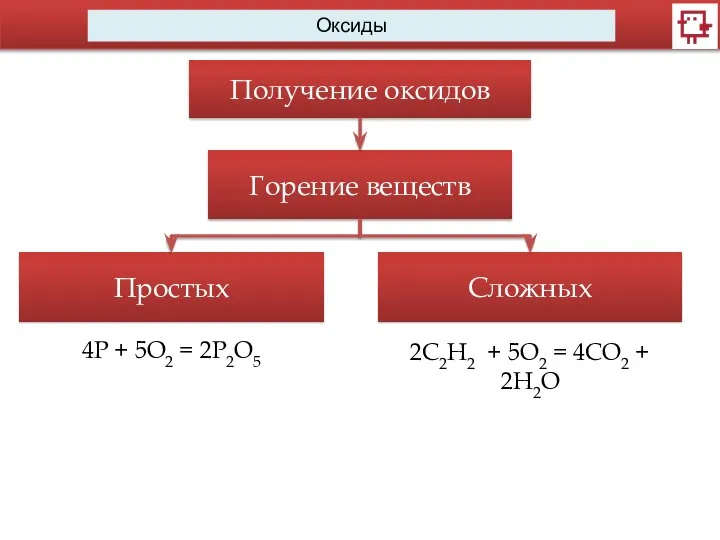
- 11. Оксиды Получение оксидов Горение веществ Простых Сложных 4Р + 5O2 = 2P2O5 2C2H2 + 5O2 =
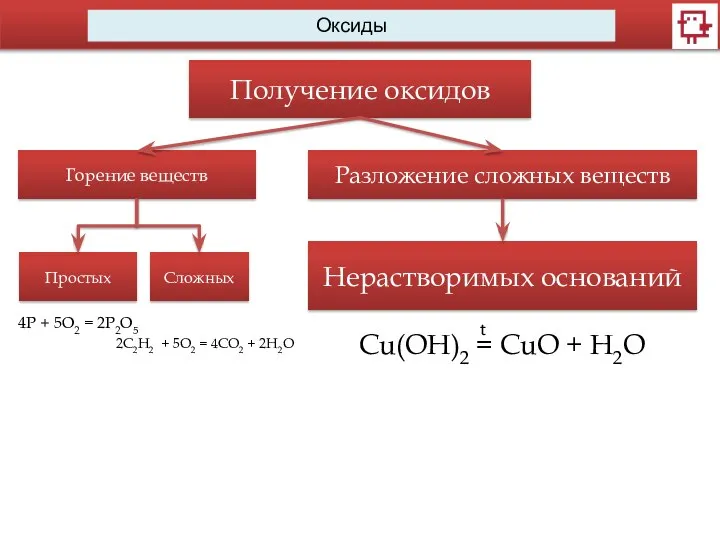
- 12. Оксиды Получение оксидов Горение веществ Простых Сложных 2C2H2 + 5O2 = 4CO2 + 2H2O 4Р +
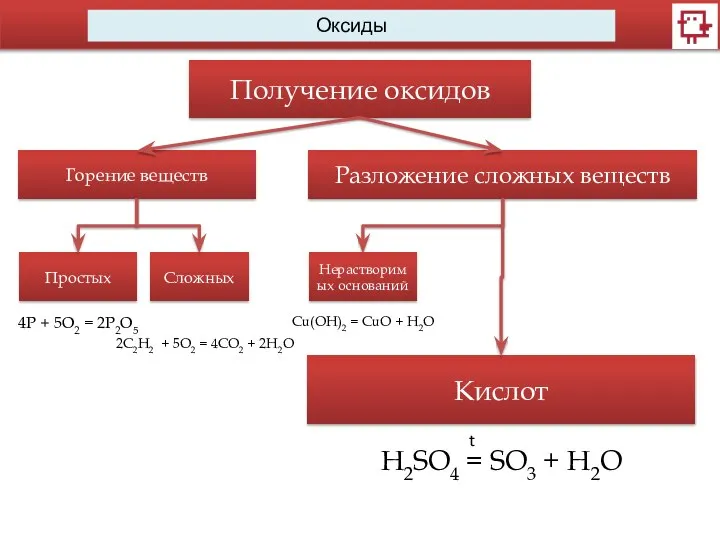
- 13. Оксиды Получение оксидов Горение веществ Простых Сложных 2C2H2 + 5O2 = 4CO2 + 2H2O 4Р +
- 15. Скачать презентацию





 Презентация на тему Классы неорганических веществ
Презентация на тему Классы неорганических веществ  Празеодим
Празеодим СТЕПЕНЬ ОКИСЛЕНИЯ
СТЕПЕНЬ ОКИСЛЕНИЯ Актуальные задачи химии
Актуальные задачи химии Превращение веществ. История химии. Автор: Рассказова Н.Л., учитель химии и биологии МОУ «СОШ №8».
Превращение веществ. История химии. Автор: Рассказова Н.Л., учитель химии и биологии МОУ «СОШ №8». Органическая химия. Теория строения органических веществ
Органическая химия. Теория строения органических веществ Карбоновые кислоты
Карбоновые кислоты Свойства алкенов
Свойства алкенов Химический состав клетки. Неорганические вещества
Химический состав клетки. Неорганические вещества Расчеты по уравнениям химических реакций
Расчеты по уравнениям химических реакций Презентация на тему Вопросы от …
Презентация на тему Вопросы от …  Строение вещества. Виды химической связи
Строение вещества. Виды химической связи Материаловедение. Стали. Свойства сталей. Классификация сталей
Материаловедение. Стали. Свойства сталей. Классификация сталей Научные принципы химического производства
Научные принципы химического производства Классификация органических соединений
Классификация органических соединений Синтетические органические соединения
Синтетические органические соединения Виды твердых тел
Виды твердых тел Химическая связь
Химическая связь Природные источники углеводородов
Природные источники углеводородов Электролитическая диссоциация
Электролитическая диссоциация Основные классы неорганических веществ
Основные классы неорганических веществ Презентация на тему Природные и синтетические красители и ароматизаторы
Презентация на тему Природные и синтетические красители и ароматизаторы  Презентация на тему Аминокислоты и белки: строение и свойства
Презентация на тему Аминокислоты и белки: строение и свойства  Удивительные приборы: Термометр
Удивительные приборы: Термометр Протолитические буферные системы. Буферные системы организма, их взаимодействие
Протолитические буферные системы. Буферные системы организма, их взаимодействие Классификация неорганических веществ
Классификация неорганических веществ Общая характеристика металлов
Общая характеристика металлов Минеральные вещества и здоровье
Минеральные вещества и здоровье