Содержание
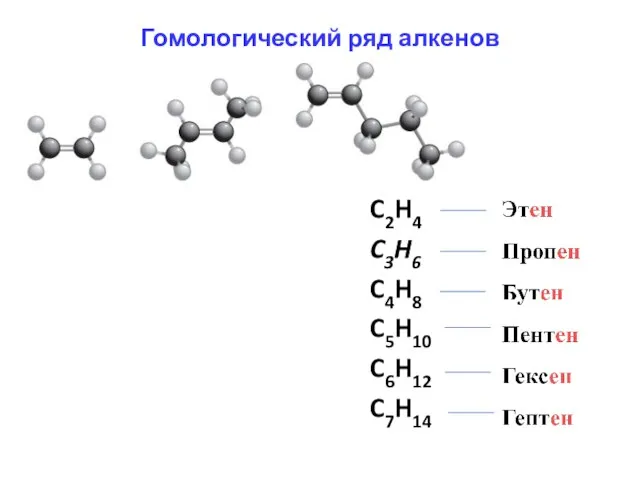
- 2. Гомологический ряд алкенов
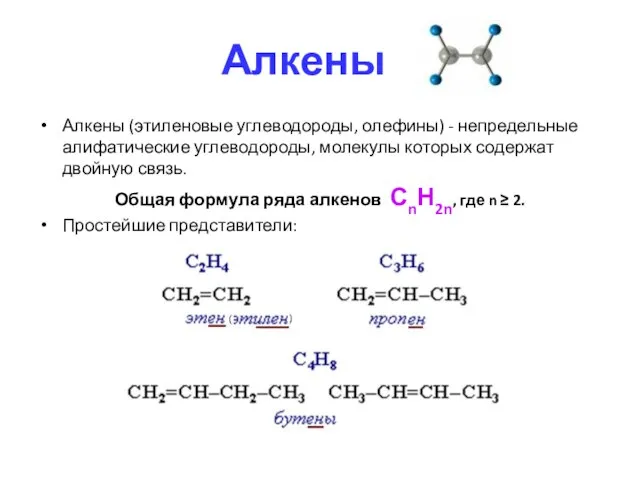
- 3. Алкены Алкены (этиленовые углеводороды, олефины) - непредельные алифатические углеводороды, молекулы которых содержат двойную связь. Общая формула
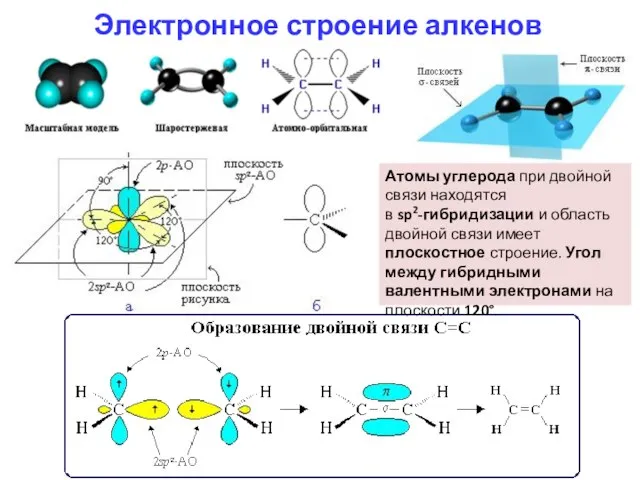
- 4. Электронное строение алкенов Атомы углерода при двойной связи находятся в sp2-гибридизации и область двойной связи имеет
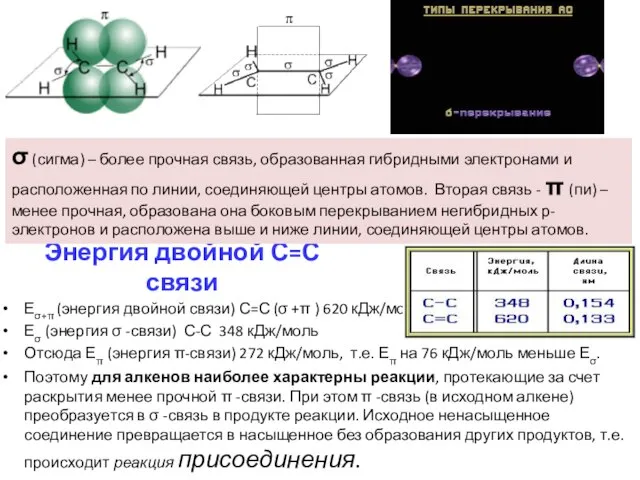
- 5. Энергия двойной С=С связи Еσ+π (энергия двойной связи) С=С (σ +π ) 620 кДж/моль Еσ (энергия
- 6. 1. Что называется длиной связи? (Длина связи – это расстояние между центрами ядер связываемых атомов в
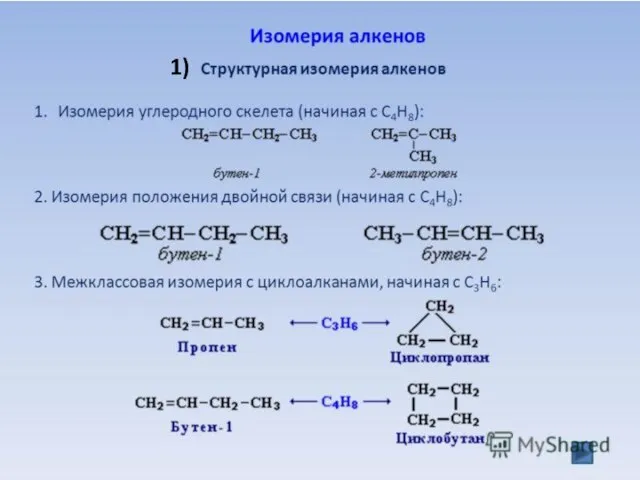
- 7. 1)
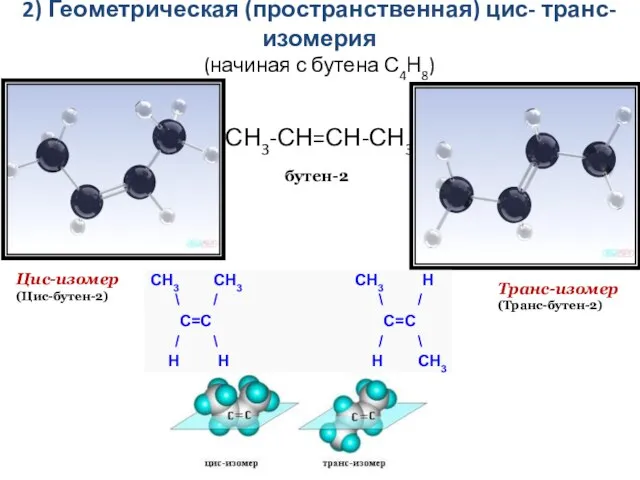
- 8. 2) Геометрическая (пространственная) цис- транс-изомерия (начиная с бутена С4Н8) Транс-изомер (Транс-бутен-2) Цис-изомер (Цис-бутен-2) СН3-СН=СН-СН3 бутен-2
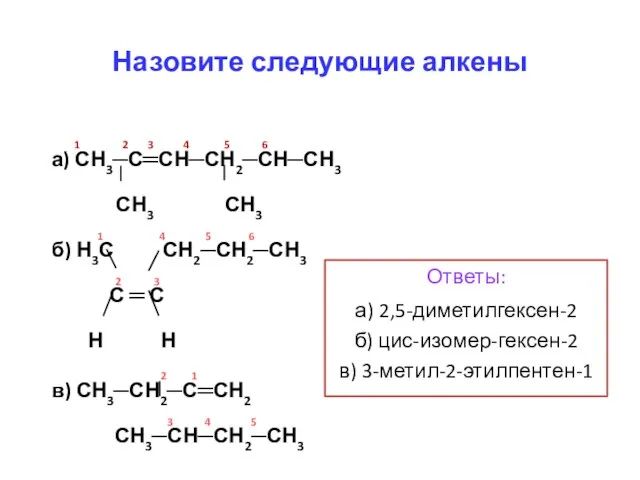
- 9. 1 2 3 4 5 6 а) СН3─С═СН─СН2─СН─СН3 СН3 СН3 1 4 5 6 б) Н3С
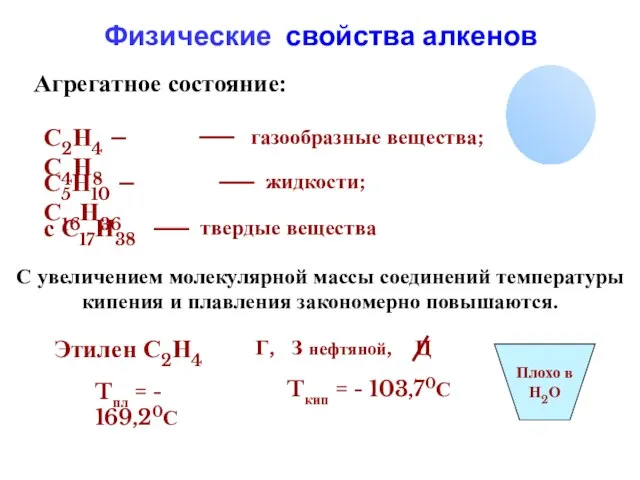
- 10. Агрегатное состояние: С2Н4 – С4Н8 газообразные вещества; С5Н10 – С16Н36 жидкости; с С17Н38 твердые вещества Этилен
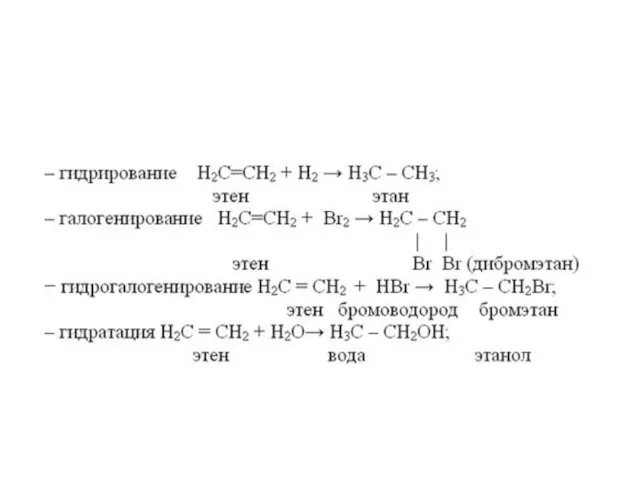
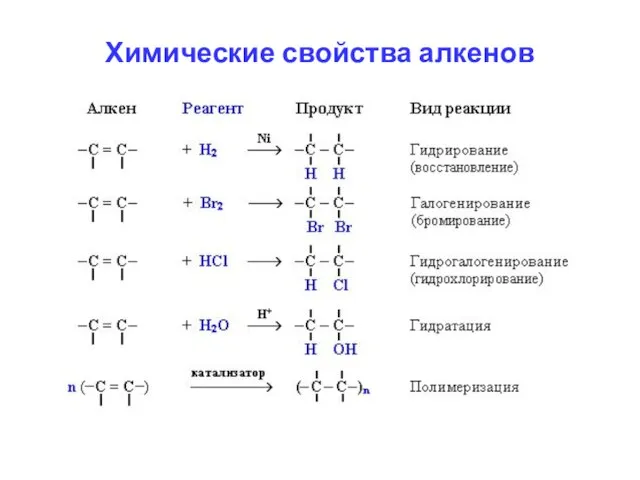
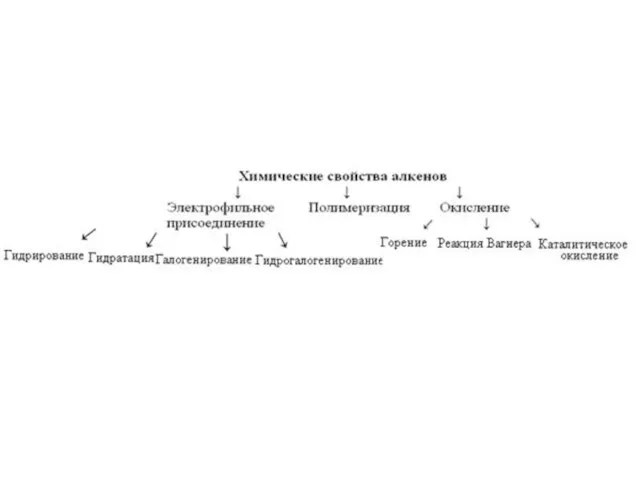
- 11. Химические свойства алкенов Алкены вступают в реакции присоединения: 1) Гидрирование - реакции с водородом 2) Галогенирование
- 13. Химические свойства алкенов
- 14. Реакции присоединения Присоединение водорода: Н2С=СН2 + H2 → Н3С—СН3 Присоединение галогенов: Н2С=СН2 + Cl2 → ClH2C—CH2Cl
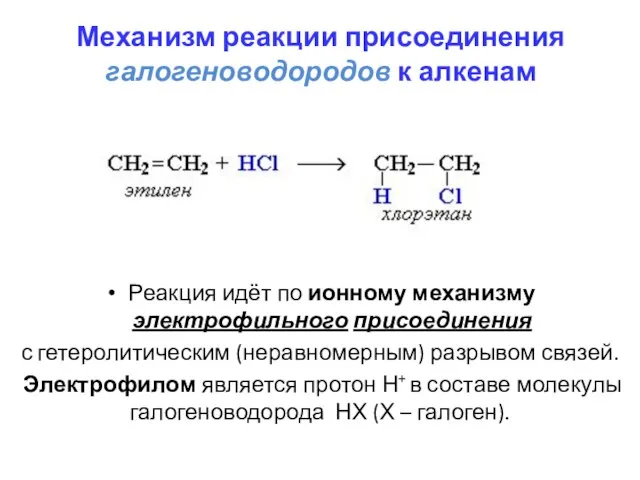
- 15. Механизм реакции присоединения галогеноводородов к алкенам Реакция идёт по ионному механизму электрофильного присоединения с гетеролитическим (неравномерным)
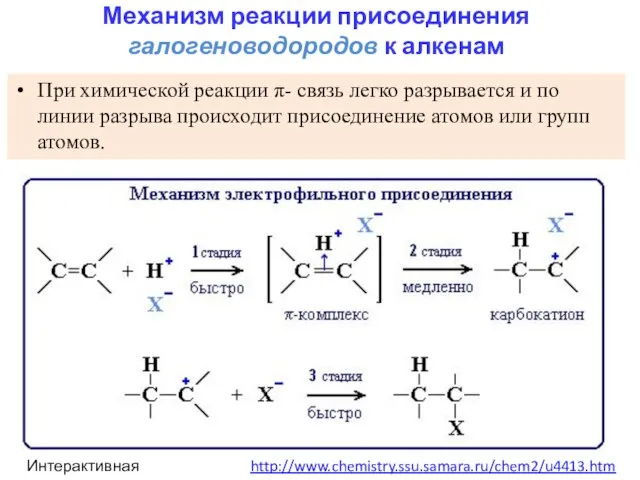
- 16. При химической реакции π- связь легко разрывается и по линии разрыва происходит присоединение атомов или групп
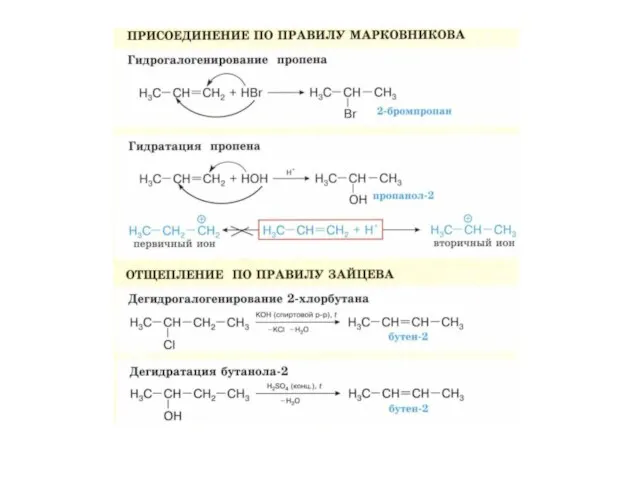
- 17. Правило Марковникова Русский химик-органик. В реакциях присоединения полярных молекул к несимметричным алкенам водород присоединяется к более
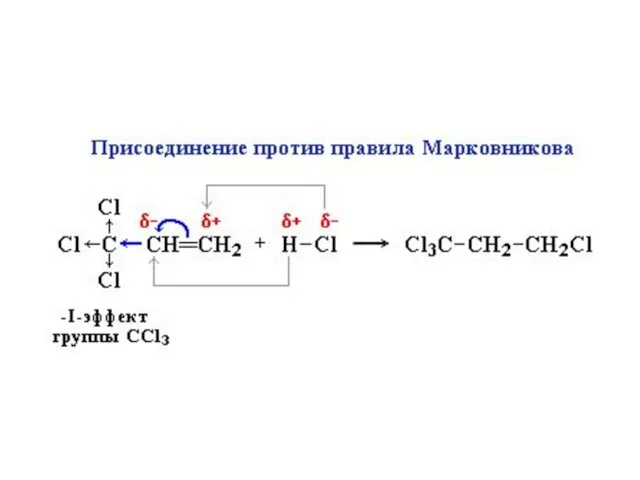
- 19. Важно: Присоединение может происходить против правила Марковникова, если: Исключения!!! если в алкене присутствует электроноакцепторный заместитель, т.е.
- 21. При высоких температурах возможны реакции радикального замещения с галогенами При высоких температурах (более 400 °C) реакции
- 22. 1) Реакции окисления кислородом воздуха 1) Полное окисление (горение): Н2С=СН2 + 3O2 → 2СO2 + 2Н2O
- 23. 2) Окисление алкенов в мягких условиях (без нагревания, нейтральная среда) (Реакция Вагнера Е.Е.) При окислении алкенов
- 24. 3) Окисление алкенов в жёстких условиях (нагревание, кислотная среда) При жестком окислении алкенов кипящим раствором перманганата
- 25. Окисление алкенов в жёстких условиях
- 26. Окисление алкенов в жёстких условиях
- 27. 5C2H4 + 2KMnO4 + 18H2SO4 = 10CO2 + 6K2SO4 + 12MnSO4 +28H2O 1) C2H4 + KMnO4
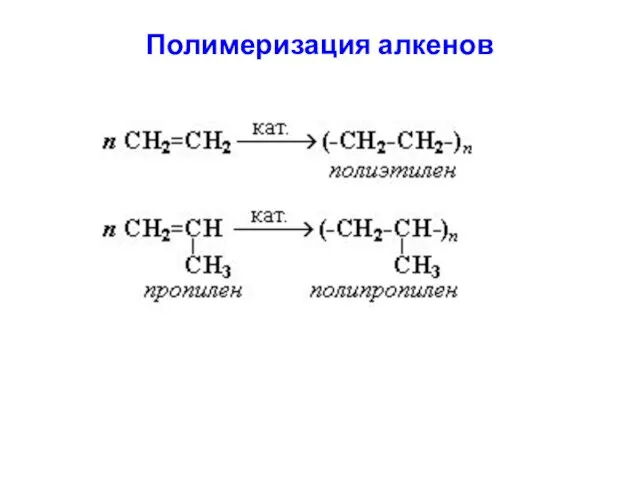
- 28. Где, n – число структурных звеньев в молекуле. Исходное низкомолекулярное вещество, вступающее в реакцию полимеризации, называется
- 29. Полимеризация алкенов
- 31. Выводы: Алкены – непредельные углеводороды, в молекулах которых имеется одна двойная связь. Атомы углерода находятся в
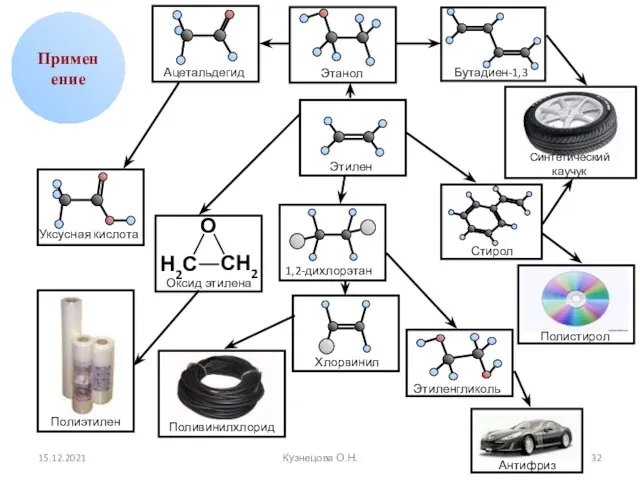
- 32. 15.12.2021 Кузнецова О.Н. Применение
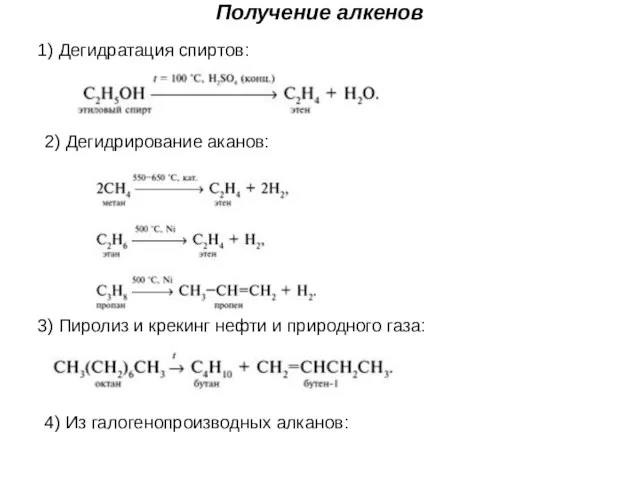
- 33. Получение алкенов 1) Дегидратация спиртов: 2) Дегидрирование аканов: 4) Из галогенопроизводных алканов: 3) Пиролиз и крекинг
- 34. 4) Из галогенопроизводных алканов:
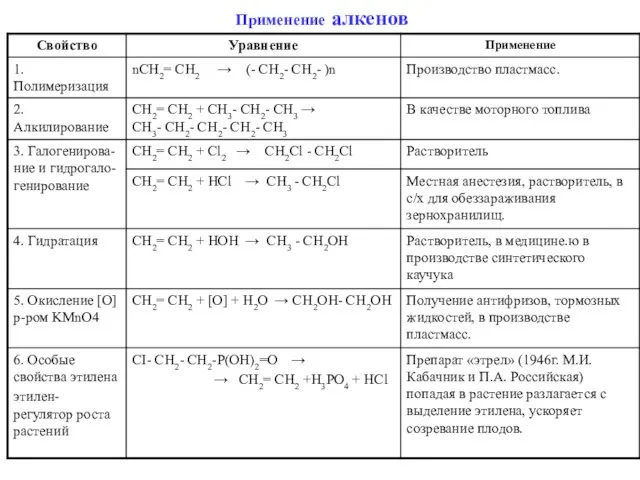
- 35. Применение алкенов
- 36. Способы получения алкенов – крекинг нефтепродуктов (алканов) C8H18 ––> C4H8 + C4H10; (термический крекинг при 400-700
- 37. Тестовое задание № 1: 1. Ациклические углеводороды, в молекулах которых содержится одна двойная связь, называются А)
- 38. Тестовое задание № 2: 1. Реакция присоединения водорода называется А) гидрирование Б) гидрогалогенирование В) гидратация В)
- 39. Тестовое задание № 3: 1. Бутен можно получить крекингом: А) бутана Б) пентана В) гексана Г)
- 40. 4. По ионному механизму протекают реакции, уравнения которых: 1) СН4+О2 —> СO2 + 2H2O 2) СН2=СН2
- 41. Взаимодействие пропена с хлором на свету 1) относится к реакции присоединения 2) протекает по радикальному механизму
- 42. Взаимодействие пропена с хлором на свету 1) относится к реакции присоединения 2) протекает по радикальному механизму
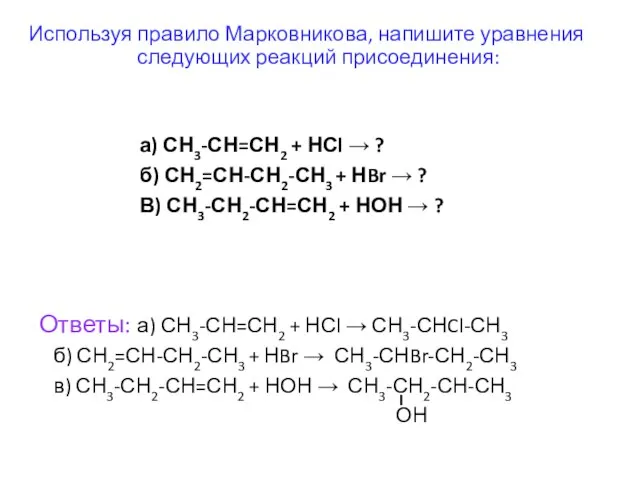
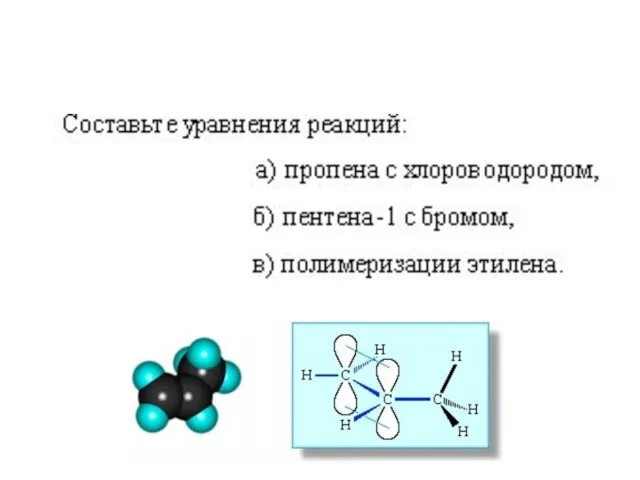
- 43. а) СН3-СН=СН2 + НСl → ? б) СН2=СН-СН2-СН3 + НBr → ? В) СН3-СН2-СН=СН2 + НОН
- 45. Итоговый контроль I. Укажите продукты реакции и тип реакции: 1. СН3 – СН = СН2 +
- 46. Алкены в природе В природе ациклические алкены практически не встречаются. Простейший представитель этого класса органических соединений
- 48. Скачать презентацию
























 Электролиз расплавов и растворов солей
Электролиз расплавов и растворов солей День химии
День химии Строение атомов. Изотопы
Строение атомов. Изотопы Органическая химия
Органическая химия Основные классы неорганических соединений
Основные классы неорганических соединений Реакции ионного обмена
Реакции ионного обмена Строение атома
Строение атома Хімічна промисловість
Хімічна промисловість Сурьма, Sb
Сурьма, Sb Химическая связь. Описание ковалентной химической связи методом молекулярных орбиталей
Химическая связь. Описание ковалентной химической связи методом молекулярных орбиталей Соли азотной кислоты – нитраты. Нитриты, Азотные удобрения
Соли азотной кислоты – нитраты. Нитриты, Азотные удобрения Презентация на тему Техника безопасности на уроках химии
Презентация на тему Техника безопасности на уроках химии  Постулаты Онзагера
Постулаты Онзагера Косметические средства. Виды, состав и влияние на организм
Косметические средства. Виды, состав и влияние на организм 6efbceb9eca3e929
6efbceb9eca3e929 Периодическая система химических элементов Д. И. Менделеева
Периодическая система химических элементов Д. И. Менделеева Презентация на тему Дисахариды
Презентация на тему Дисахариды  Методика изготовления сенсора
Методика изготовления сенсора Водород. Вода
Водород. Вода Массовая доля вещества в смеси. Таблица
Массовая доля вещества в смеси. Таблица Презентация на тему Арены (10 класс)
Презентация на тему Арены (10 класс) 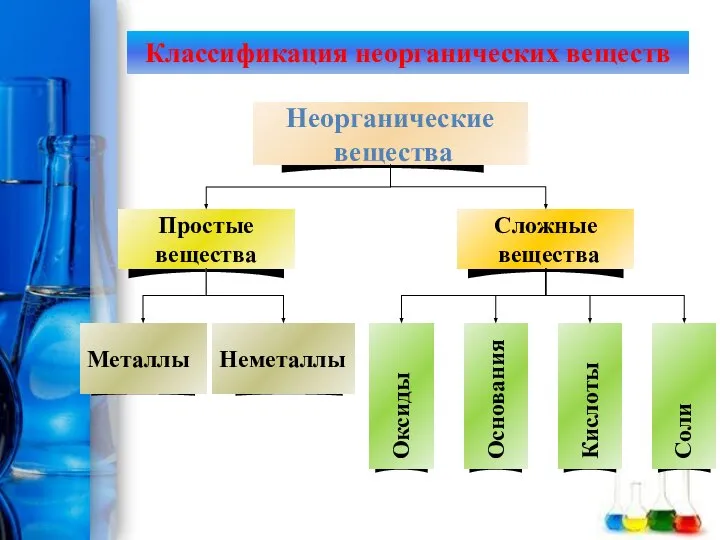 Кислоты
Кислоты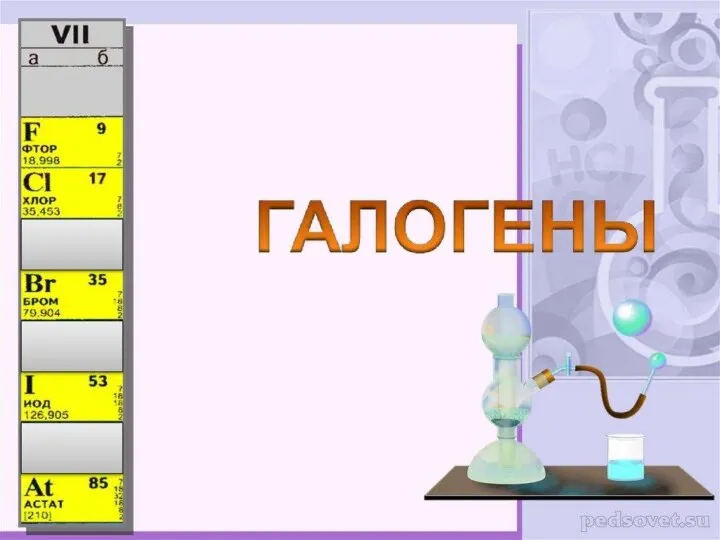 ГАЛОГЕНЫ
ГАЛОГЕНЫ Актуальные задачи химии
Актуальные задачи химии Рівноваги у розчинах електролітів
Рівноваги у розчинах електролітів Составление ионных уравнений
Составление ионных уравнений VVEDENIE_V_OGRANIChESKUYu_KhIMIYu
VVEDENIE_V_OGRANIChESKUYu_KhIMIYu Оксиды неметаллов и металлов. Состав и названия
Оксиды неметаллов и металлов. Состав и названия