Содержание
- 2. “Железо не только основа всего мира, самый главный металл окружающей нас природы, оно основа культуры и
- 3. Химический элемент железо Физические свойства простого вещества Химические свойства простого вещества Распространение в природе Минералы железа
- 4. Химический элемент железо Задание 1: опишите положение железа в периодической системе по плану: а) порядковый номер,
- 5. Проверьте себя: Положение железа в Периодической системе а) Порядковый номер: 26 б) Относительная атомная масса: 56
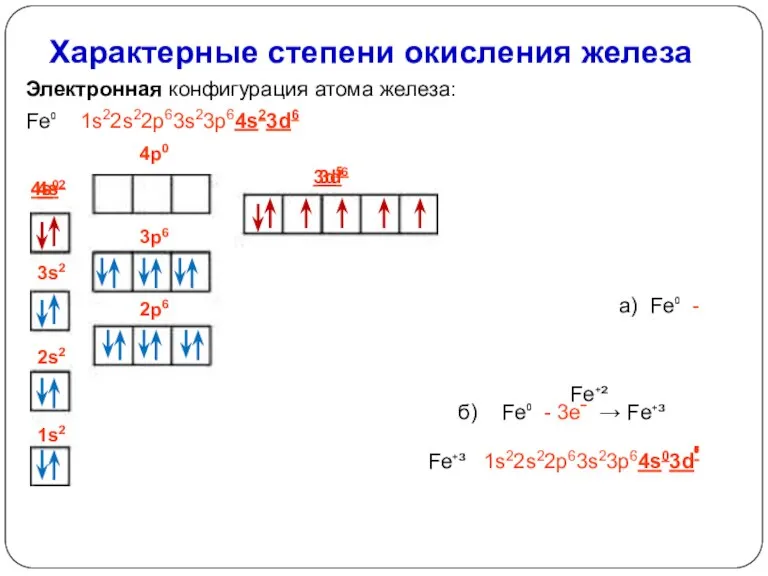
- 6. Характерные степени окисления железа Электронная конфигурация атома железа: Fe⁰ 1s22s22p63s23p64s23d6 а) Fe⁰ - 2eˉ → Fe⁺²
- 7. Физические свойства железа Тугоплавкий металл (tпл=1539оС) серебристо-белого цвета; пластичен, различные примеси повышают его твердость и хрупкость.
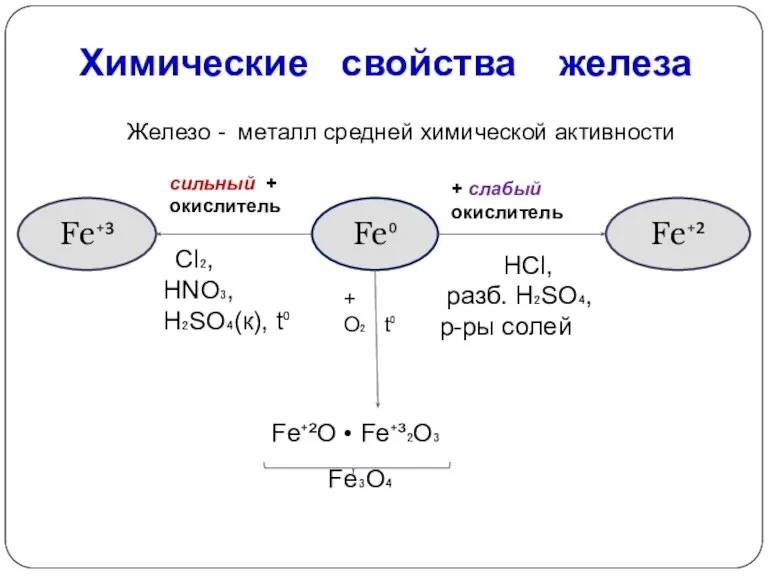
- 8. Химические свойства железа Железо - металл средней химической активности Fe⁰ Fe⁺³ Fe⁺² + слабый окислитель сильный
- 9. 1) Взаимодействие железа с простыми веществами:
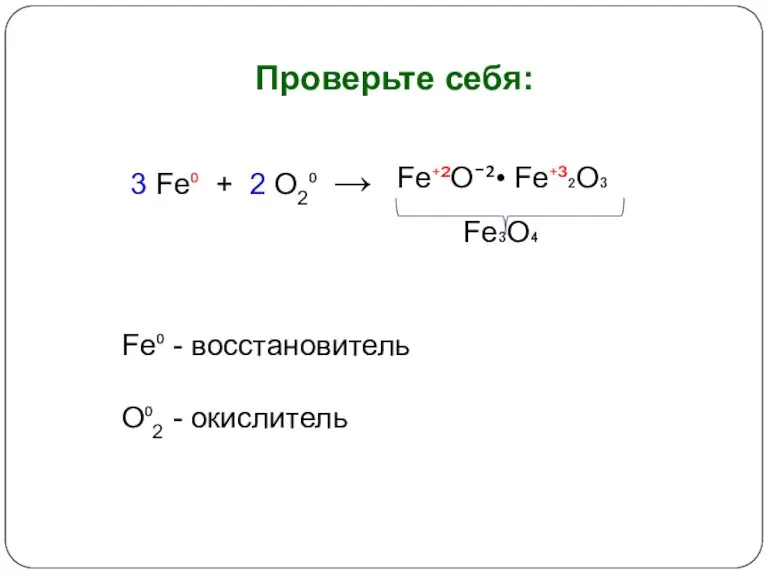
- 10. Проверьте себя: 3 Fe⁰ + 2 O2⁰ → Fe⁺²O¯²• Fe⁺³₂O₃ Fe₃O₄ Fe⁰ - восстановитель O⁰2 -
- 11. Проверьте себя: 2 Fe⁰ + 3 Cl2⁰ → 2 Fe⁺³Cl¯¹3 Fe⁰ - восстановитель Cl2⁰ - окислитель
- 12. 2) Взаимодействие железа со сложными веществами: Fe + H2O → Fe3O4 + H2↑ Задание 4: расставьте
- 13. Проверьте себя: 2) Взаимодействие железа со сложными веществами: 3 Fe⁰ + 4 H⁺¹2O → + 4
- 14. В) взаимодействие железа с кислотами а) Железо растворяется в HCl и разбавленной H₂SO₄ : кислота +
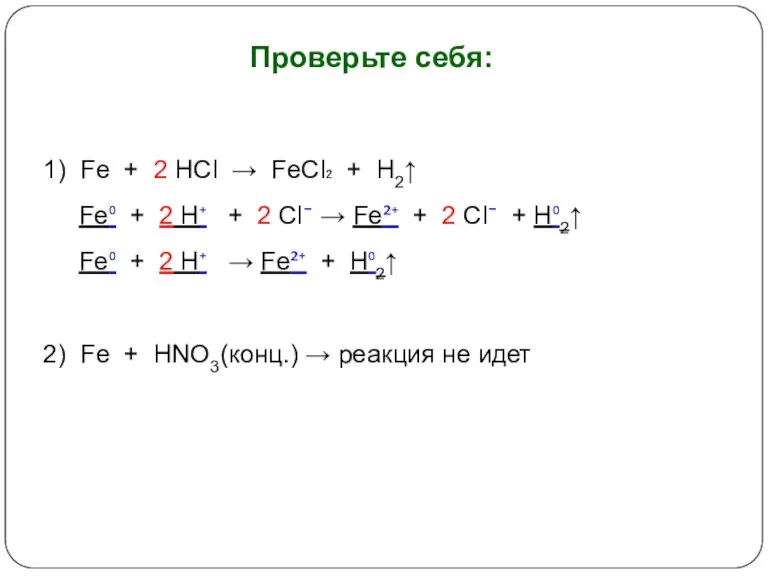
- 15. Проверьте себя: 1) Fe + 2 HCl → FeCl₂ + H2↑ Fe⁰ + 2 H⁺ +
- 16. Задание 6: напишите молекулярные, полные и краткие ионные уравнения возможных реакций а) Fe + CuCl₂ →
- 17. а) Fe + CuCl₂ → FeCl₂ + Cu↓ Fe⁰ + Cu²⁺ + 2 Cl⁻ → Fe²⁺
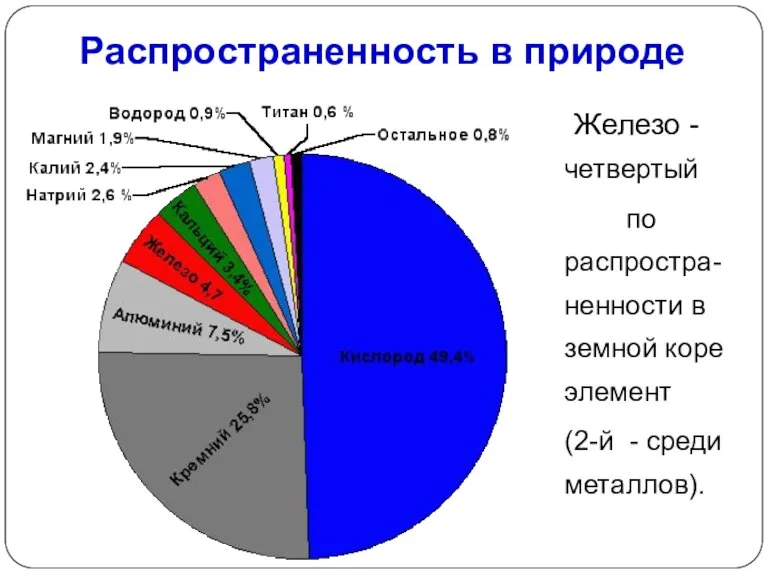
- 18. Распространенность в природе Железо - четвертый по распростра-ненности в земной коре элемент (2-й - среди металлов).
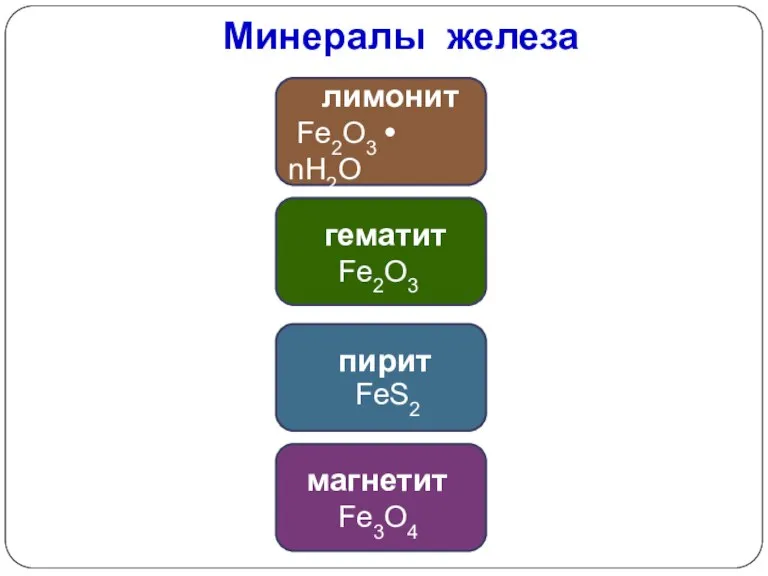
- 19. Минералы железа лимонит Fe2O3 • nH2O гематит Fe2O3 пирит FeS2 магнетит Fe3O4
- 20. Получение железа . 3) При прямом получении железа из руд используют бедные железные руды, шлаки других
- 21. Проверьте себя: 1) 3 Fe2O3 + CO = 2 Fe3O4 + CO2 Fe3O4 + CO =
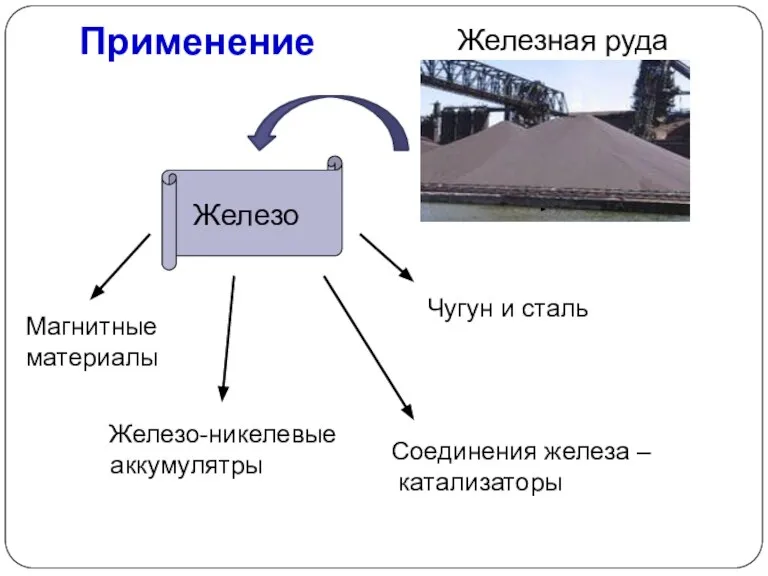
- 22. Применение Железо Чугун и сталь Магнитные материалы Железо-никелевые аккумулятры Железная руда Соединения железа – катализаторы
- 23. Железо - основной конструкционный материал
- 24. Железо как художественный материал В виде чугуна используется для изготовления решеток, подсвечников, монументов, настенных кронштейнов, флюгеров.
- 25. Железо и войны
- 27. Скачать презентацию

















 Химическая география чудес
Химическая география чудес Основы молекулярно-кинетической теории
Основы молекулярно-кинетической теории Коррозия металлов и сплавов
Коррозия металлов и сплавов ИКТ на уроках химии. Часть 1. Теория и практика применения интерактивной доски
ИКТ на уроках химии. Часть 1. Теория и практика применения интерактивной доски Металлы и неметаллы. Знакомство с периодической системой Д. И. Менделеева
Металлы и неметаллы. Знакомство с периодической системой Д. И. Менделеева Ситалл – искусственный поликристаллический материал
Ситалл – искусственный поликристаллический материал Классы неорганических соединений
Классы неорганических соединений Арены. Бензол
Арены. Бензол Алифатические соединения. Тема № 6
Алифатические соединения. Тема № 6 АРЕНЫ
АРЕНЫ Аэрозоли и аэродисперсии
Аэрозоли и аэродисперсии Спирты
Спирты Свойство металлов и сплавов
Свойство металлов и сплавов Кислоты, основания и соли как электролиты
Кислоты, основания и соли как электролиты 5кл 20.10практична робота
5кл 20.10практична робота Криогенный разрыв пласта
Криогенный разрыв пласта Хим_10_30_Производство_аммиака
Хим_10_30_Производство_аммиака Гигиена воздуха
Гигиена воздуха Судың диссоциациясы
Судың диссоциациясы Презентация по Химии "Строении атомов. Химическая связь"
Презентация по Химии "Строении атомов. Химическая связь"  Карбонильные производные (кислоты, альдегиды, кетоны, сложные эфиры)
Карбонильные производные (кислоты, альдегиды, кетоны, сложные эфиры) Азот
Азот Косметические средства и бытовая химия
Косметические средства и бытовая химия Металлы
Металлы Алкадиены. Строение. Изомерия. Свойства
Алкадиены. Строение. Изомерия. Свойства Великие русские химики
Великие русские химики Химическая связь
Химическая связь Химия крови. Состав и функции крови
Химия крови. Состав и функции крови