декларации 1948 г., Хельсинской декларации 1964 г., которая в дальнейшем многократно пересматривалась и дополнялась по результатам различных международных конгрессов врачей. Еще одним определяющим документом стал подготовленный американской Комиссией по защите человеческих субъектов биомедицинских и поведенческих исследований Бельмонтский отчет «Этические принципы и рекомендации по защите человека при проведении исследований» (1979 г.), посвященной использованию людей в научных исследованиях, которая проходила в Центре Бельмонта (Елкридж, Мэриленд, США) в феврале 1976 г.
Юридическая необходимость получения информированного согласия основывается на ряде основополагающих международных документов: Женевской декларации 1948 г., Хельсинской декларации 1964 г., которая в дальнейшем многократно пересматривалась и дополнялась по результатам различных международных конгрессов врачей. Еще одним определяющим документом стал подготовленный американской Комиссией по защите человеческих субъектов биомедицинских и поведенческих исследований Бельмонтский отчет «Этические принципы и рекомендации по защите человека при проведении исследований» (1979 г
Международные документы, регулирующие необходимость получения информированного согласия:
Нюрнбергский кодекс 1947 г.,
Женевская декларация 1948 г.,
Хельсинская декларация 1964.,
Лиссабонская декларация о правах пациента 1981 г., Декларация о политике в области обеспечения прав пациента в Европе 1994 г.,
Конвенция о защите прав человека и достоинства человеческого существа в связи с использованием достижений биологии и медицины 1997 г.,
Конвенция о защите прав и достоинства человека в области биомедицины: конвенция о биомедицине и правах человека 1997 г.,
Европейская хартия прав пациентов 2002 г.,










 Эпилепсия
Эпилепсия Адреногенитальный синдром
Адреногенитальный синдром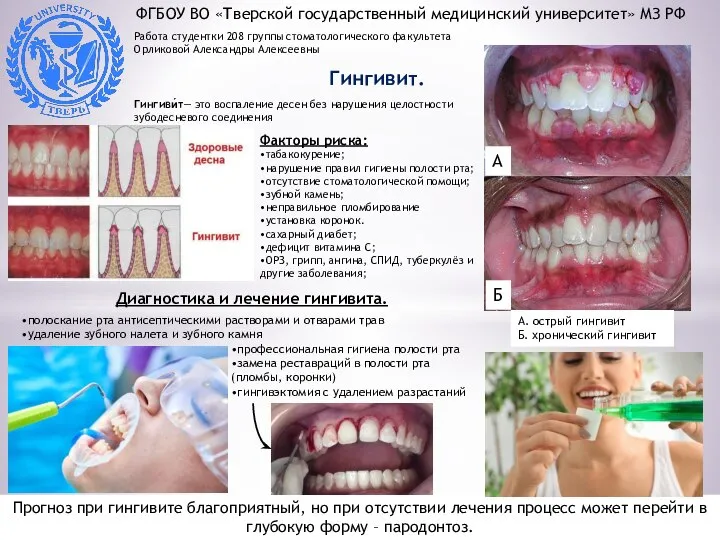 Гингивит. Виды
Гингивит. Виды Обследование стоматологического больного
Обследование стоматологического больного Инфекционные заболевания у детей
Инфекционные заболевания у детей Основы педиатрии
Основы педиатрии Вирус герпеса
Вирус герпеса Условно рассасывающиеся шовные материалы
Условно рассасывающиеся шовные материалы Невралгия тройничного нерва
Невралгия тройничного нерва Аутосомно-доминантное наследование
Аутосомно-доминантное наследование Психология лиц с нарушениями развития эмоционально-волевой сферы
Психология лиц с нарушениями развития эмоционально-волевой сферы Плавание как средство коррекции
Плавание как средство коррекции Презентация по психологии на тему _Психологический профиль онкобольных_
Презентация по психологии на тему _Психологический профиль онкобольных_ История лапароскопии
История лапароскопии Варикозное расширение вен органов малого таза у женщин
Варикозное расширение вен органов малого таза у женщин Аутоаллергические заболевания на примере диффузного гломерулонефрита
Аутоаллергические заболевания на примере диффузного гломерулонефрита Особенности фармакодинамики и фармакокинетики у новорожденных с перинатальной патологией и у преждевременно рожденных детей
Особенности фармакодинамики и фармакокинетики у новорожденных с перинатальной патологией и у преждевременно рожденных детей Здоровое питание школьников
Здоровое питание школьников Хирургическая инфекция
Хирургическая инфекция Автономная нервная система
Автономная нервная система Создание инновационного операционного блока модульного типа в СПб ГБУЗ Клиническая больница Святителя Луки
Создание инновационного операционного блока модульного типа в СПб ГБУЗ Клиническая больница Святителя Луки Лучевая диагностика язвенной болезни желудка, двенадцатиперстной кишки
Лучевая диагностика язвенной болезни желудка, двенадцатиперстной кишки Перенашивание беременности
Перенашивание беременности Медицинская информационная система (МИС) Medwork
Медицинская информационная система (МИС) Medwork ДЦП. Спастическая диплегия
ДЦП. Спастическая диплегия Спинной мозг
Спинной мозг Хронический панкреатит
Хронический панкреатит Cymbeline__SlidesCarnival
Cymbeline__SlidesCarnival