Содержание
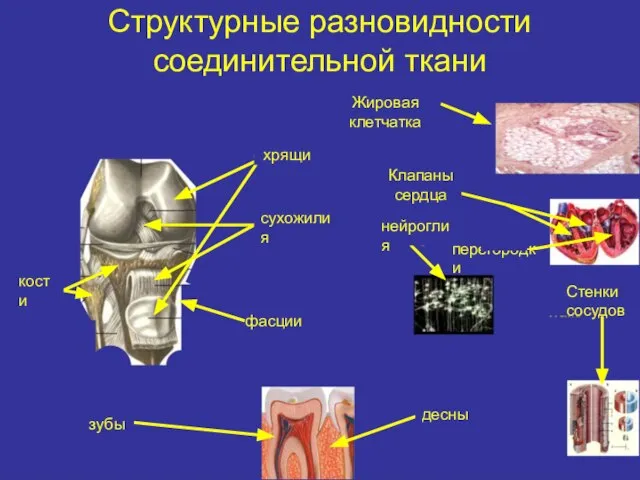
- 2. Структурные разновидности соединительной ткани Жировая клетчатка хрящи Клапаны сердца сухожилия кости фасции нейроглия зубы десны перегородки
- 3. ФУНКЦИИ СОЕДИНИТЕЛЬНОЙ ТКАНИ Структурная Универсальный биологический клей Обеспечение постоянства тканевой проницаемости Обеспечение водно-солевого равновесия Защитная функция
- 5. Значение внеклеточного матрикса Продвижение клеток во время эмбриогенеза, Острые и хронические воспаления, Проблема метастазирования опухолевых клеток,
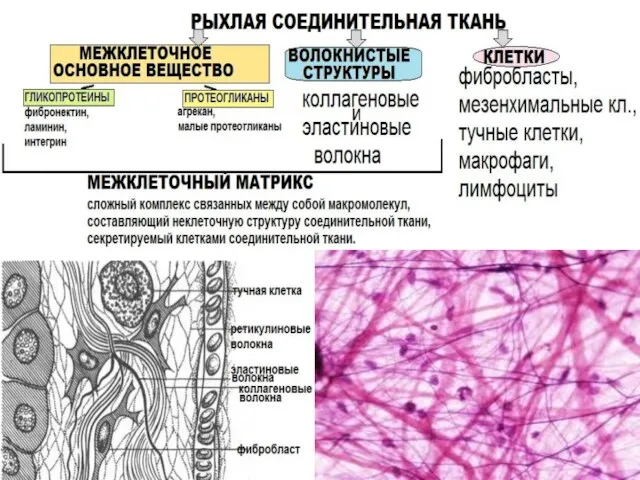
- 6. Основные белки соединительной ткани: -Коллаген, -Эластин, -Гликопротеины, -Протеогликаны.
- 7. Коллаген Самый распространенный белок (25-33% всех белков организма) Входит в состав коллагеновых волокон Самый прочный белок
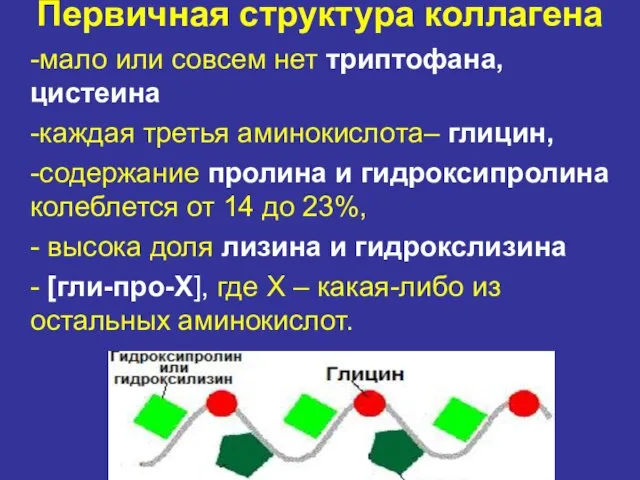
- 8. Первичная структура коллагена -мало или совсем нет триптофана, цистеина -каждая третья аминокислота– глицин, -содержание пролина и
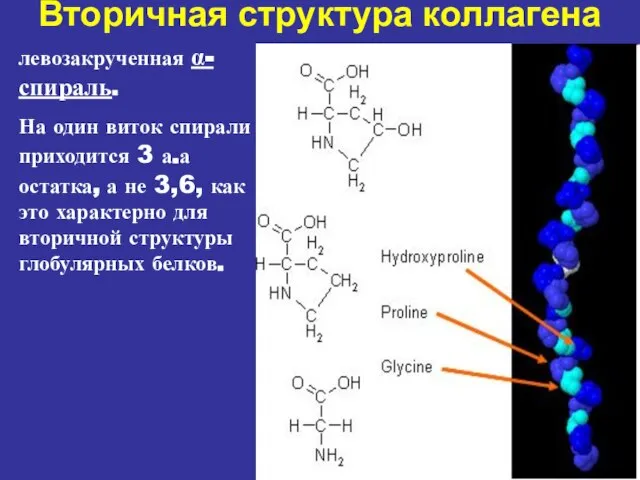
- 9. Вторичная структура коллагена левозакрученная α-спираль. На один виток спирали приходится 3 а.а остатка, а не 3,6,
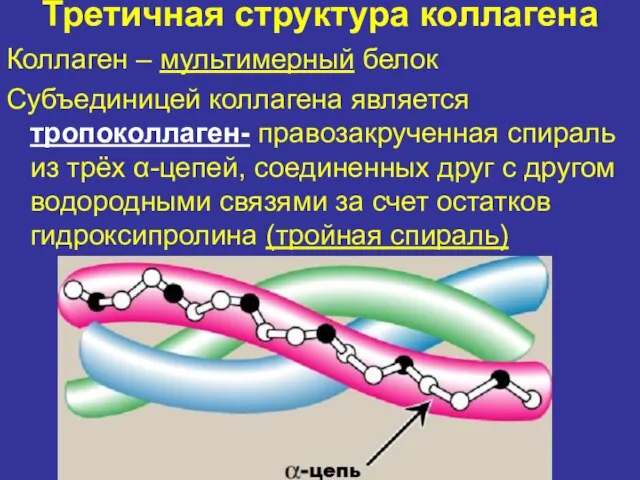
- 10. Третичная структура коллагена Коллаген – мультимерный белок Субъединицей коллагена является тропоколлаген- правозакрученная спираль из трёх α-цепей,
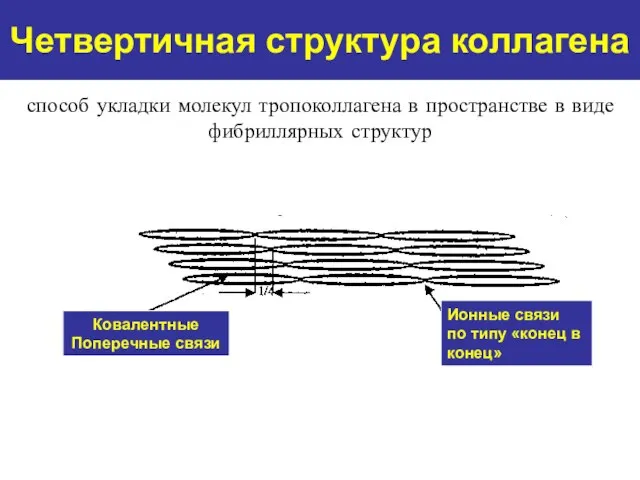
- 11. Четвертичная структура коллагена Ковалентные Поперечные связи Ионные связи по типу «конец в конец» способ укладки молекул
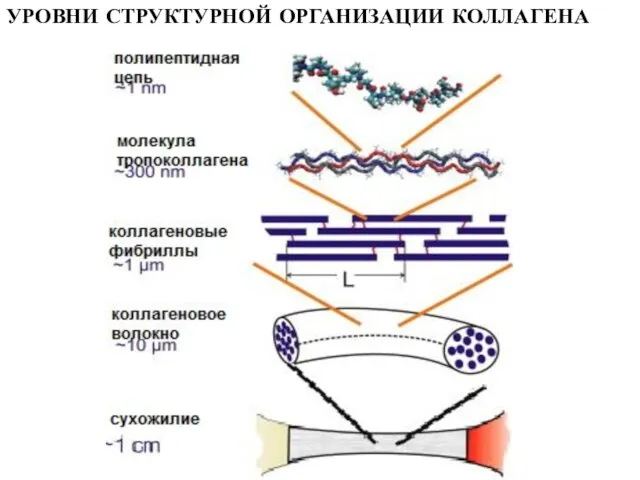
- 12. УРОВНИ СТРУКТУРНОЙ ОРГАНИЗАЦИИ КОЛЛАГЕНА
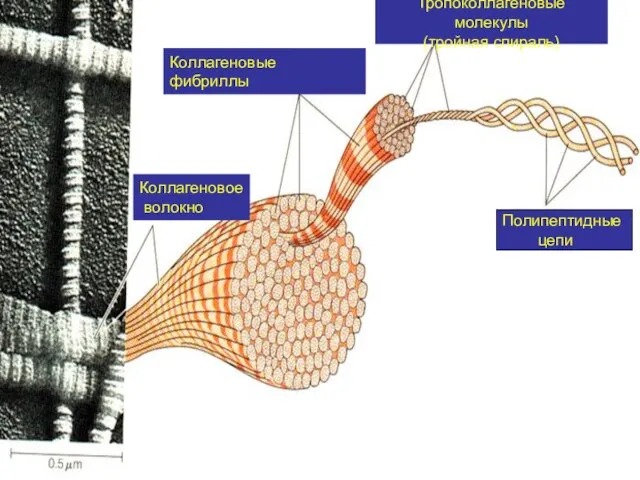
- 13. Полипептидные цепи Тропоколлагеновые молекулы (тройная спираль) Коллагеновые фибриллы Коллагеновое волокно
- 14. Синтез и процессинг коллагена в фибробластах соединительной ткани
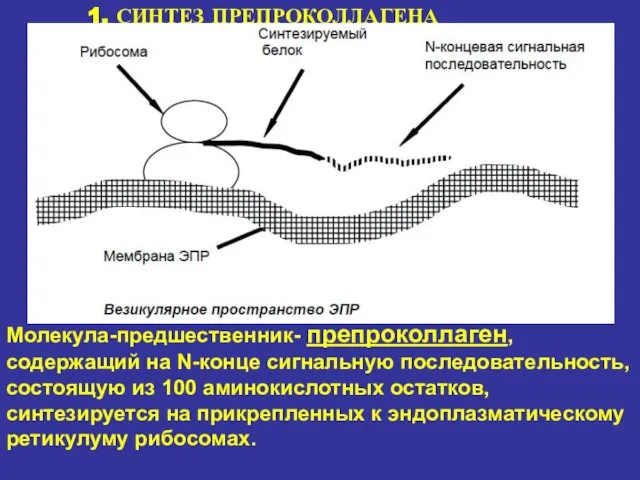
- 15. 1. СИНТЕЗ ПРЕПРОКОЛЛАГЕНА Молекула-предшественник- препроколлаген, содержащий на N-конце сигнальную последовательность, состоящую из 100 аминокислотных остатков, синтезируется
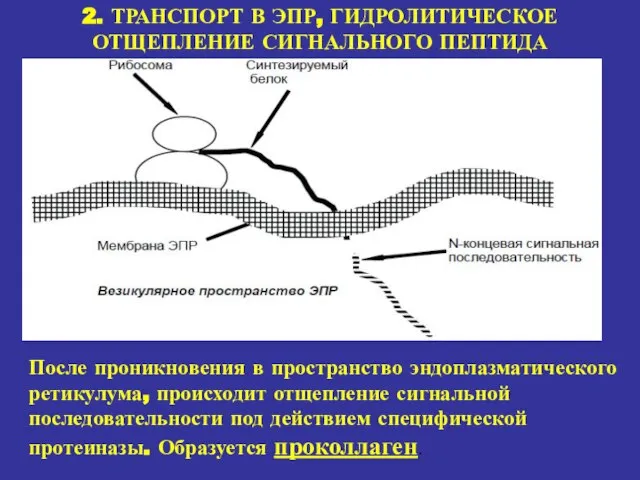
- 16. 2. ТРАНСПОРТ В ЭПР, ГИДРОЛИТИЧЕСКОЕ ОТЩЕПЛЕНИЕ СИГНАЛЬНОГО ПЕПТИДА После проникновения в пространство эндоплазматического ретикулума, происходит отщепление
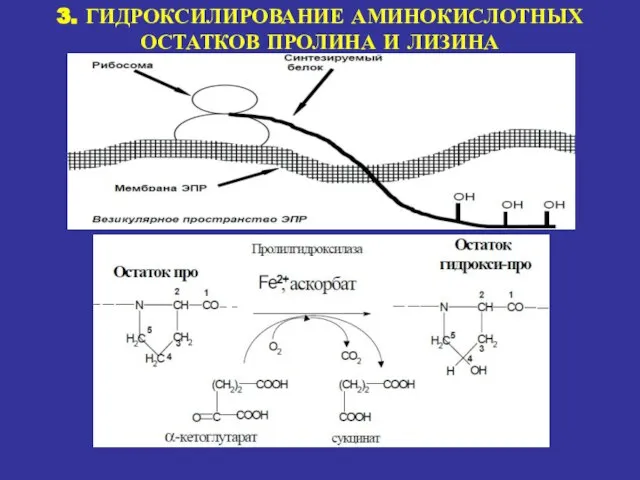
- 17. 3. ГИДРОКСИЛИРОВАНИЕ АМИНОКИСЛОТНЫХ ОСТАТКОВ ПРОЛИНА И ЛИЗИНА
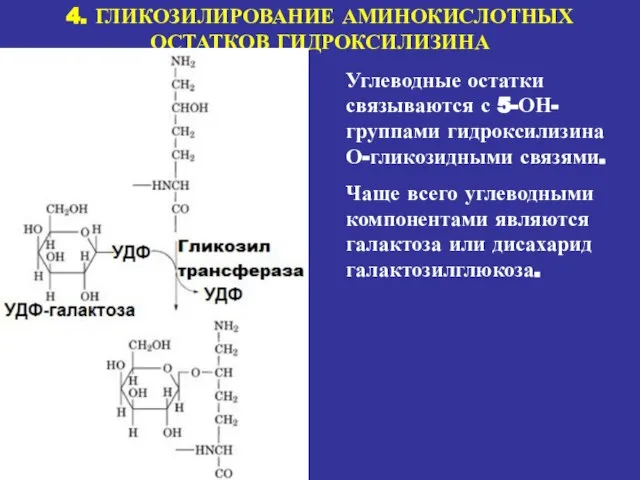
- 18. 4. ГЛИКОЗИЛИРОВАНИЕ АМИНОКИСЛОТНЫХ ОСТАТКОВ ГИДРОКСИЛИЗИНА Углеводные остатки связываются с 5-ОН-группами гидроксилизина О-гликозидными связями. Чаще всего углеводными
- 19. 5. ОБРАЗОВАНИЕ ТРОЙНОЙ СПИРАЛИ ПРОКОЛЛАГЕНА включает несколько процессов: а) Между С-концевыми последовательностями полипептидных цепей формируются межцепочечные
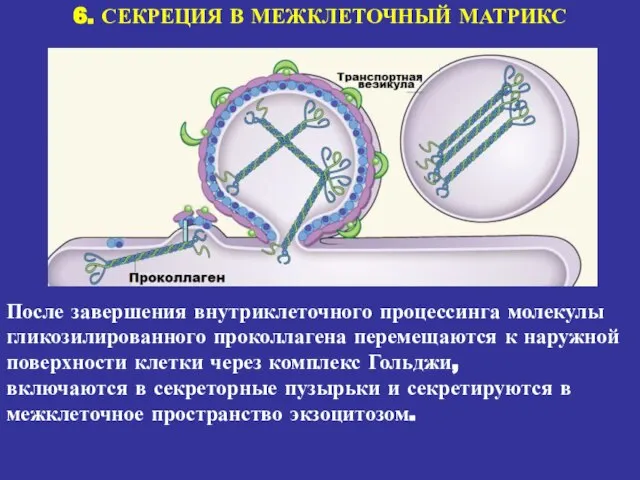
- 20. 6. СЕКРЕЦИЯ В МЕЖКЛЕТОЧНЫЙ МАТРИКС После завершения внутриклеточного процессинга молекулы гликозилированного проколлагена перемещаются к наружной поверхности
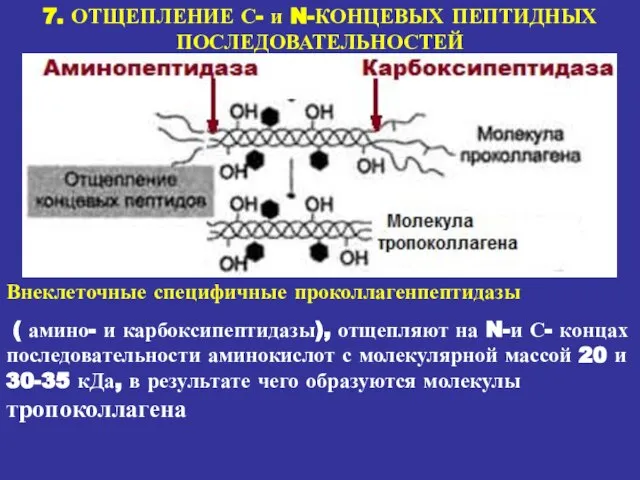
- 21. 7. ОТЩЕПЛЕНИЕ С- и N-КОНЦЕВЫХ ПЕПТИДНЫХ ПОСЛЕДОВАТЕЛЬНОСТЕЙ Внеклеточные специфичные проколлагенпептидазы ( амино- и карбоксипептидазы), отщепляют на
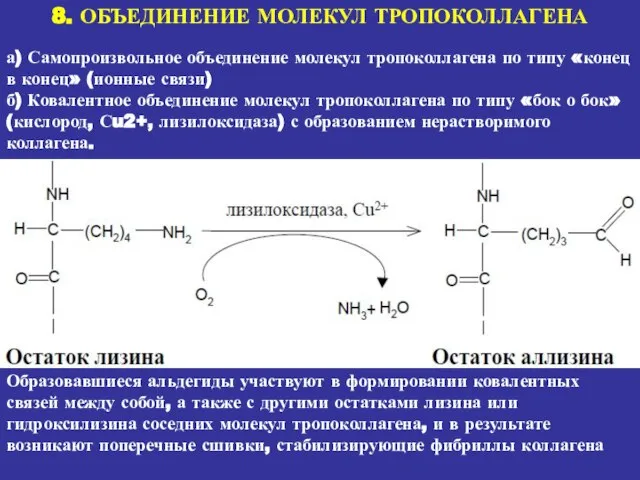
- 22. 8. ОБЪЕДИНЕНИЕ МОЛЕКУЛ ТРОПОКОЛЛАГЕНА а) Самопроизвольное объединение молекул тропоколлагена по типу «конец в конец» (ионные связи)
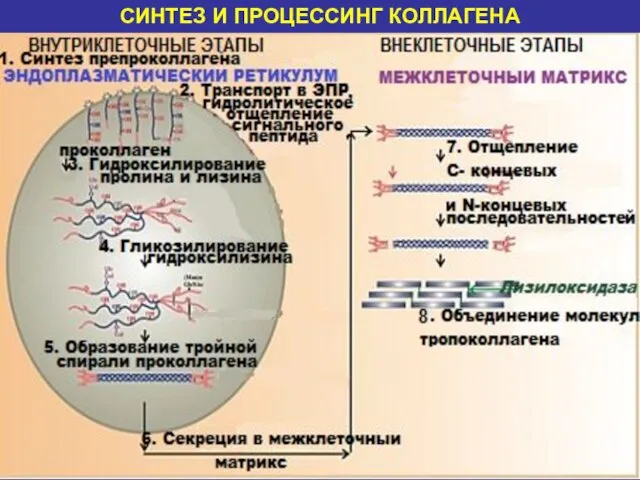
- 23. СИНТЕЗ И ПРОЦЕССИНГ КОЛЛАГЕНА
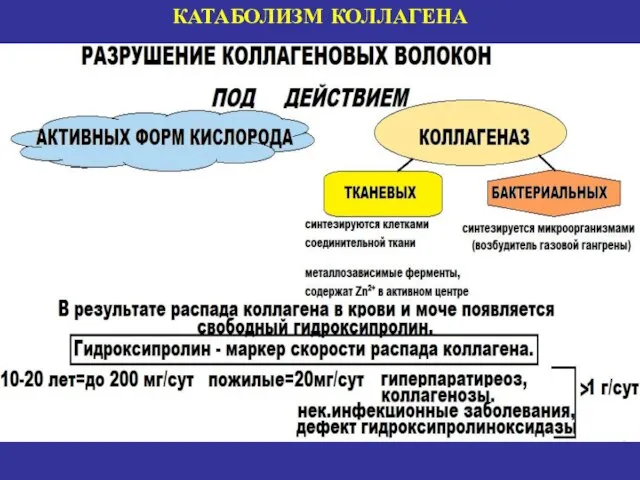
- 24. КАТАБОЛИЗМ КОЛЛАГЕНА
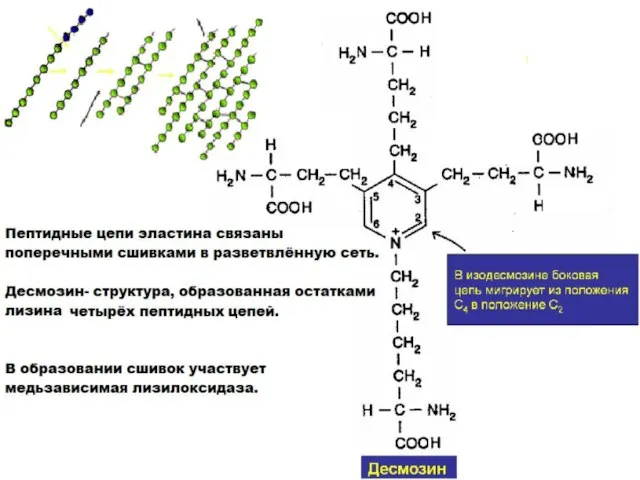
- 26. Эластин- основной белок эластических волокон, которые содержатся в межклеточном веществе кожи, стенок кровеносных сосудов, связок, лёгких,
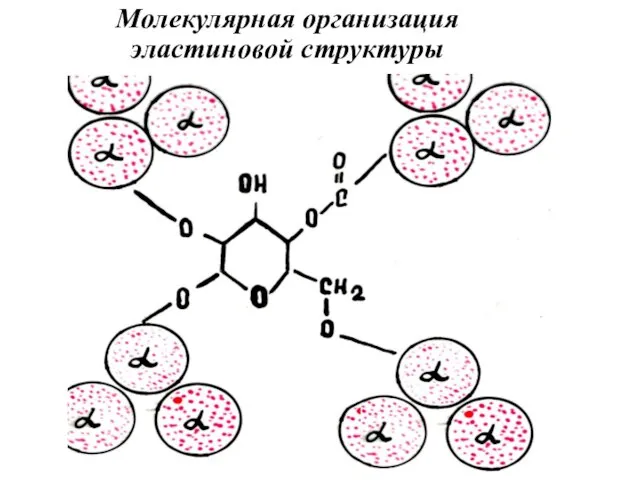
- 28. Молекулярная организация эластиновой структуры
- 29. Различия между коллагеном и эластином
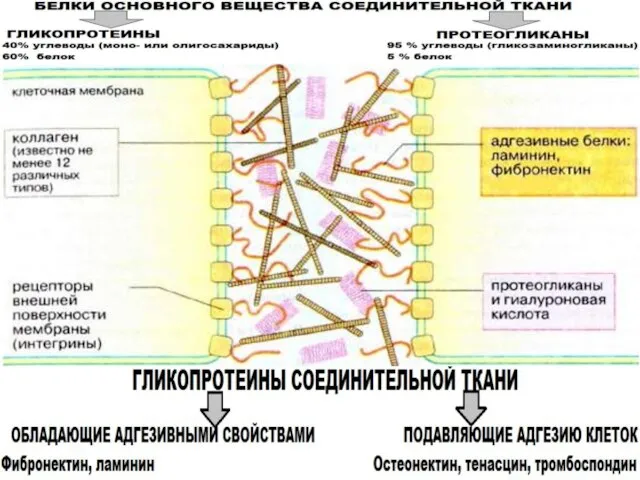
- 31. Основные гликопротеины соединительной ткани
- 32. Протеогликаны
- 33. Структура мономера глюкозамингликанов {гексуроновая кислота (галактоза)-O- Ацетилгексозамин / сульфат}n
- 34. СОСТАВ ГЛЮКОЗАМИНГЛИКАНОВ Название глюкозамин- гликана Дисахаридный мономер
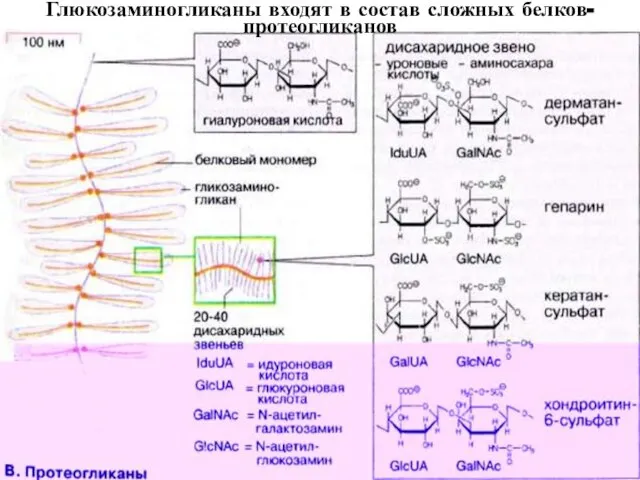
- 35. Глюкозаминогликаны входят в состав сложных белков- протеогликанов
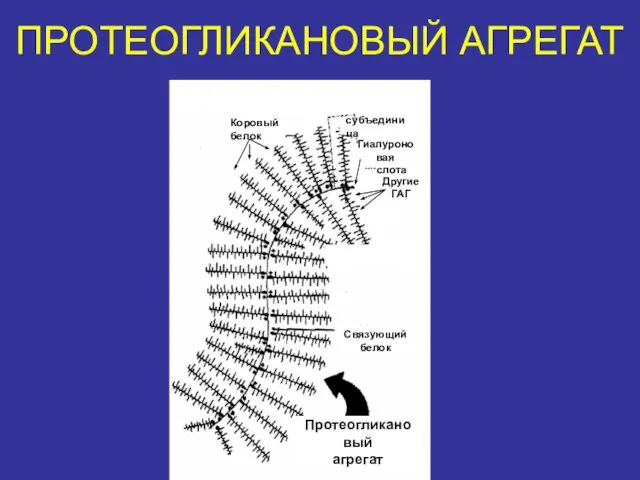
- 36. ПРОТЕОГЛИКАНОВЫЙ АГРЕГАТ Коровый белок субъединица Гиалуроновая кислота Другие ГАГ Связующий белок Протеогликановый агрегат
- 37. Функции протеогликанов Депонирование воды, Депонирование жира (адипоциты) Депонирование осмотически активных ионов (Na+, Cl-), Формирование тургора ткани,
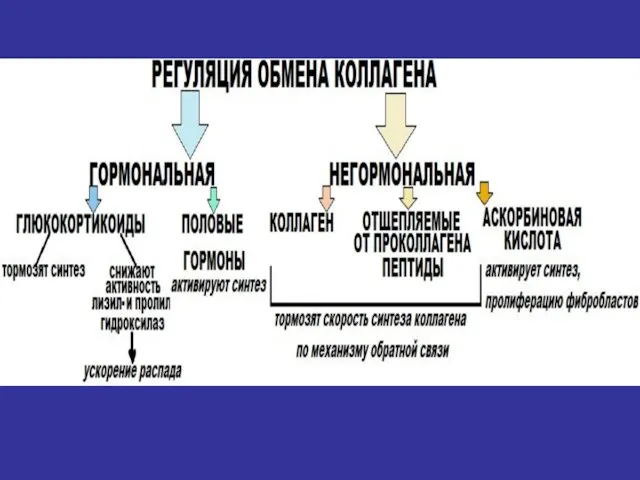
- 38. Особенности метаболизма соединительной ткани 1. Низкая скорость обновления всех молекул (более длительный период полураспада по сравнению
- 39. Особенности метаболизма соединительной ткани Возрастные изменения метаболизма соединительной ткани: -снижение количества ГАГ, -снижение отношения ХС/KС (12.0
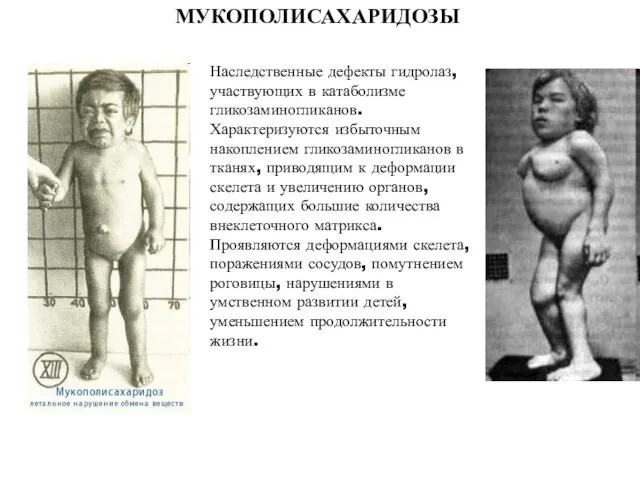
- 40. МУКОПОЛИСАХАРИДОЗЫ Наследственные дефекты гидролаз, участвующих в катаболизме гликозаминогликанов. Характеризуются избыточным накоплением гликозаминогликанов в тканях, приводящим к
- 43. Скачать презентацию















 Диагностика, лечение хронического калькулезного сиалоаденита: клинический случай
Диагностика, лечение хронического калькулезного сиалоаденита: клинический случай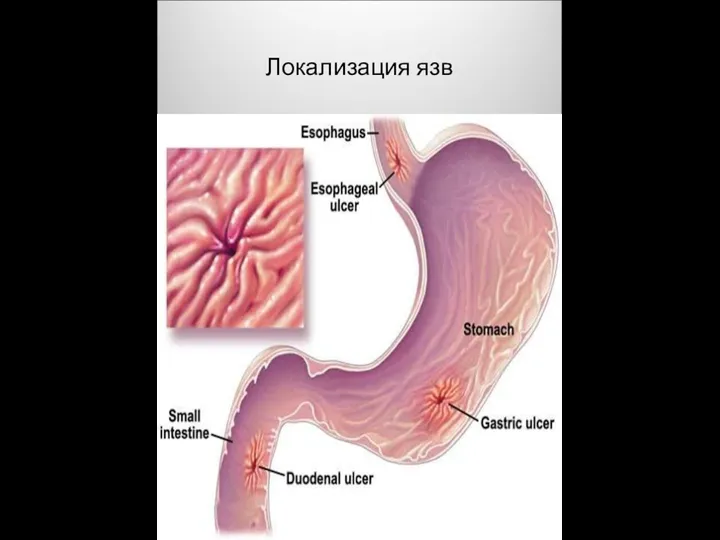 Локализация язв
Локализация язв Визуальная диагностика гигантоклеточной опухоли
Визуальная диагностика гигантоклеточной опухоли Субарахнойдальное кровоизлияние: этиология, клиника, патогенез, диагностика, лечение
Субарахнойдальное кровоизлияние: этиология, клиника, патогенез, диагностика, лечение Показания для перевода в ОРИТ
Показания для перевода в ОРИТ СОСТАВ ГЕЛЯ В 1 Г ГЕЛЯ: ИНСУЛИН ЧЕЛОВЕЧЕСКИЙ 2 МЕ ФОСФАТИДИЛХОЛИН 3 МГ АЛЬФА-ЛИПОЕВАЯ КИСЛОТА 3 МГ ЯНТАРНАЯ КИСЛОТА 2 МГ БЕТА-КАРОТИН 2
СОСТАВ ГЕЛЯ В 1 Г ГЕЛЯ: ИНСУЛИН ЧЕЛОВЕЧЕСКИЙ 2 МЕ ФОСФАТИДИЛХОЛИН 3 МГ АЛЬФА-ЛИПОЕВАЯ КИСЛОТА 3 МГ ЯНТАРНАЯ КИСЛОТА 2 МГ БЕТА-КАРОТИН 2 Дефект нижней челюсти. Состояние после удаления новообразования
Дефект нижней челюсти. Состояние после удаления новообразования Методика физической реабилитации у детей с врожденными аномалиями развития
Методика физической реабилитации у детей с врожденными аномалиями развития Сексуалдық проблемалары бар науқастармен қарым қатынас
Сексуалдық проблемалары бар науқастармен қарым қатынас Ұос жылдарындағы медиктердің атқарған қызметтері
Ұос жылдарындағы медиктердің атқарған қызметтері Нанобиотехнологии: Полимерные мицеллы
Нанобиотехнологии: Полимерные мицеллы Острая сердечная недостаточность (ОСН)
Острая сердечная недостаточность (ОСН) Первая помощь при травмах опорно-двигательного аппарата
Первая помощь при травмах опорно-двигательного аппарата Репаранты
Репаранты Фолиевая кислота
Фолиевая кислота Особенности поддерживающей терапии пациентов с трижды-негативным раком молочной железы на фоне химиотерапии
Особенности поддерживающей терапии пациентов с трижды-негативным раком молочной железы на фоне химиотерапии Ми – жұлын сұйықтығының құрамы мен диагностикалық маңызы
Ми – жұлын сұйықтығының құрамы мен диагностикалық маңызы Дуоденогастральный рефлюкс желчи
Дуоденогастральный рефлюкс желчи Сравнительная оценка показателей биохимического анализа крови и нейротрофического фактора
Сравнительная оценка показателей биохимического анализа крови и нейротрофического фактора Барри Маршал и его открытие
Барри Маршал и его открытие shkola_molodykh_vrachey_prezentatsi_gruppy_zdorovya
shkola_molodykh_vrachey_prezentatsi_gruppy_zdorovya Мошенники и пандемия
Мошенники и пандемия Биологически активные добавки (БАД) к пище Vital Fucoidan
Биологически активные добавки (БАД) к пище Vital Fucoidan Патофизиология сердечной недостаточности
Патофизиология сердечной недостаточности Дипломдық жобаның тақырыбы: Fluke 719 электр калибраторы
Дипломдық жобаның тақырыбы: Fluke 719 электр калибраторы ВМК для детей. Как укрепить иммунитет и улучшить питание тканей глаза?
ВМК для детей. Как укрепить иммунитет и улучшить питание тканей глаза? Страховой полис ДМС. Важные принципы работы ДМС
Страховой полис ДМС. Важные принципы работы ДМС Жедел холангит
Жедел холангит