Содержание
- 2. АКТУАЛИЗАЦИЯ ПРОБЛЕМЫ
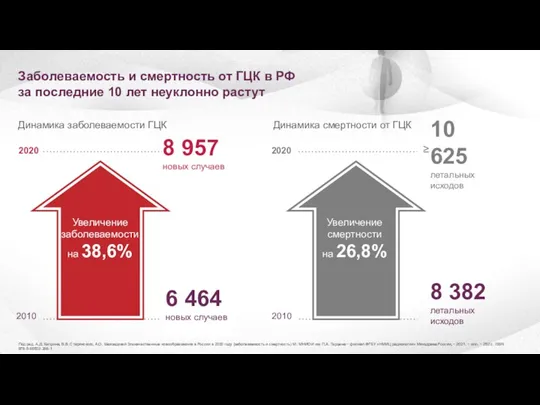
- 3. Под ред. А.Д. Каприна, В.В. Старинского, А.О. Шахзадовой Злокачественные новообразования в России в 2020 году (заболеваемость
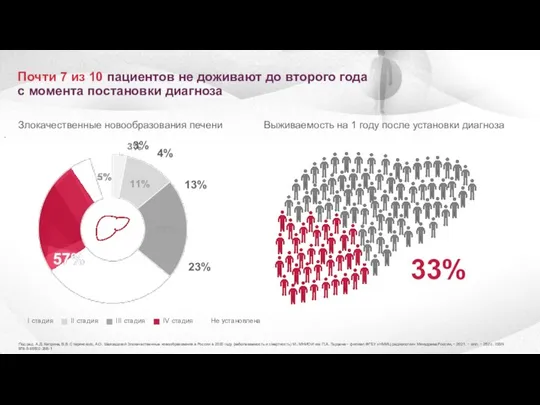
- 4. Почти 7 из 10 пациентов не доживают до второго года с момента постановки диагноза Злокачественные новообразования
- 5. 19%3‡ 11%4‡ 5%6§ 4%5§ Системная лекарственная терапия продемонстрировала ограниченную эффективность в лечении неоперабельной ГЦК в РФ
- 6. На комбинации атезолизумаб + бевацизумаб медиана общей выживаемости впервые превысила 19 месяцев! ГЦК –гепатоцеллюлярная карцинома; ОВ
- 7. Комбинация атезолизумаб+ бевацизумаб в российских клинических рекомендациях https://oncology-association.ru/wp-content/uploads/2022/07/rak-pecheni-gepatoczellyulyarnyj.pdf (дата обращения: 19.07.2022) https://cr.minzdrav.gov.ru/recomend/1_3 (дата обращения: 22.07.2022) Клинические
- 8. Комбинация атезолизумаб+ бевацизумаб в российских клинических рекомендациях 1. Бредер В. В., Балахнин П. В., Виршке Э.
- 9. Комбинация атезолизумаб+ бевацизумаб в международных клинических рекомендациях AASLD, American Association for the Study of Liver Diseases;
- 10. ПРИЧИНЫ ДОСТИЖЕНИЯ УСПЕХА НОВОЙ КОМБИНАЦИИ В ЛЕЧЕНИИ НЕОПЕРАБЕЛЬНОЙ ГЦК
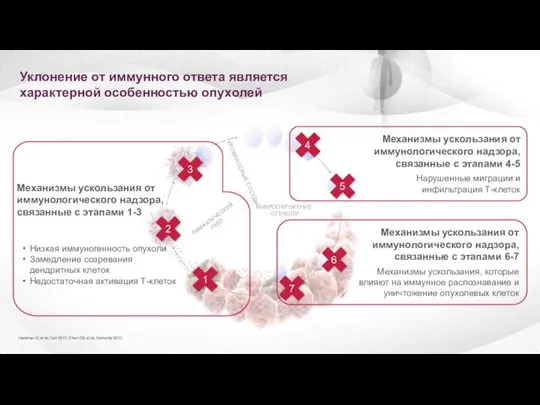
- 11. Уклонение от иммунного ответа является характерной особенностью опухолей Механизмы ускользания от иммунологического надзора, связанные с этапами
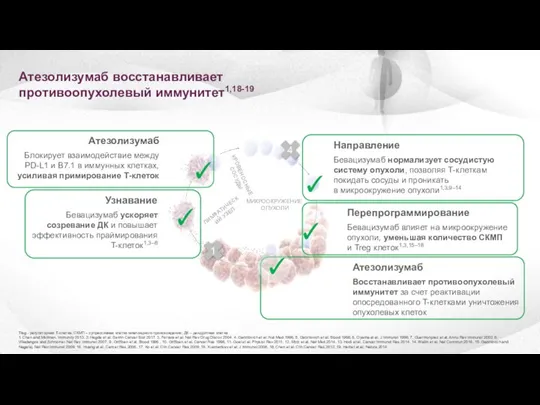
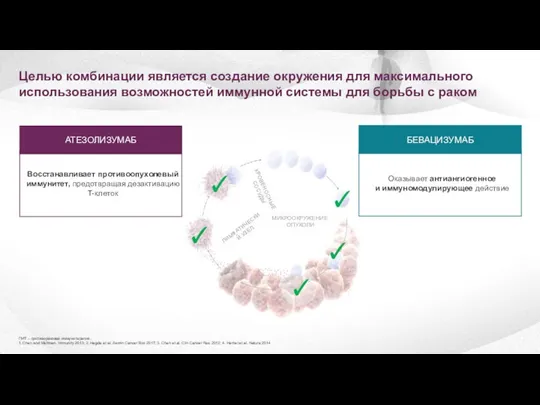
- 12. Атезолизумаб восстанавливает противоопухолевый иммунитет1,18-19 Treg - регуляторная Т-клетка; СКМП – супрессивная клетка миелоидного происхождения; ДК –
- 13. Целью комбинации является создание окружения для максимального использования возможностей иммунной системы для борьбы с раком ПИТ
- 14. РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ III ФАЗЫ IMbrave 150 Атезолизумаб и бевацизумаб в лечении неоперабельной гепатоцеллюлярной карциномы
- 15. IMbrave 150: дизайн исследования Комбинированные первичные конечные точки ОВ ВБП по оценке IRF согласно RECIST 1.1
- 16. В исследование был включен: 501 пациент из 111 центров в 17 странах мира IMbrave 150: характеристики
- 17. IMbrave 150: характеристики пациентов, включенных в исследование (2 из 2) а К остальным странам мира относятся
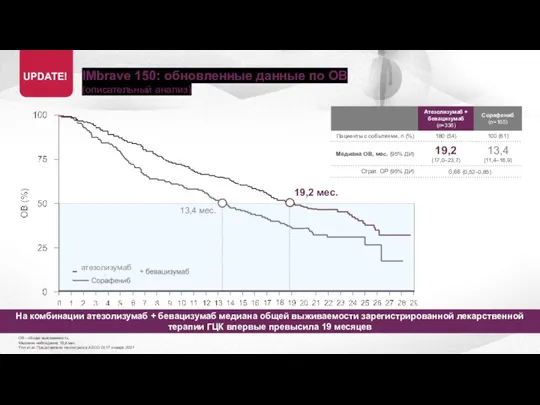
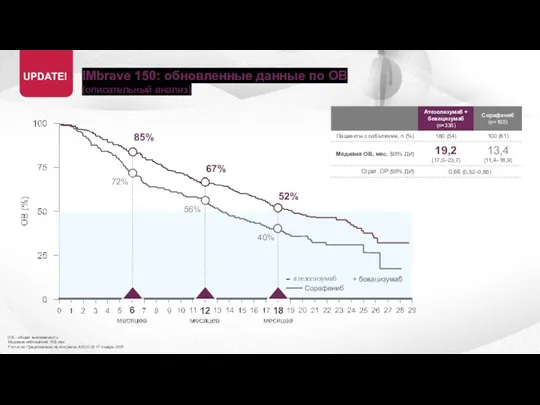
- 18. IMbrave 150: обновленные данные по ОВ (описательный анализ) ОВ – общая выживаемость Медиана наблюдения 15,6 мес
- 19. IMbrave 150: обновленные данные по ОВ (описательный анализ) ОВ – общая выживаемость Медиана наблюдения 15,6 мес
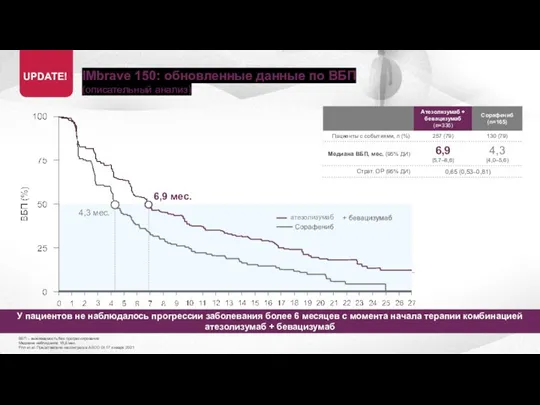
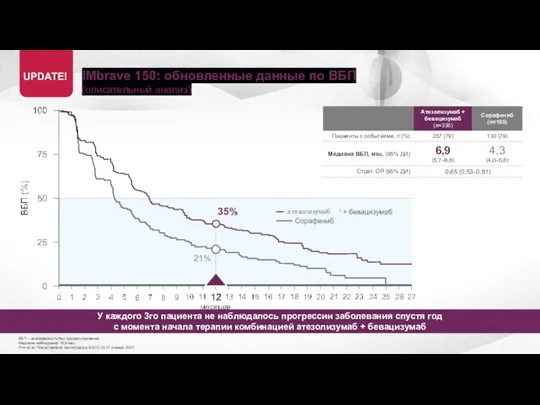
- 20. IMbrave 150: обновленные данные по ВБП (описательный анализ) ВБП – выживаемость без прогрессирования Медиана наблюдения 15,6
- 21. IMbrave 150: обновленные данные по ВБП (описательный анализ) ВБП – выживаемость без прогрессирования Медиана наблюдения 15,6
- 22. IMbrave 150: анализ ОВ в подгруппах (популяция ITT, 1 из 3) В пользу комбинации атезолизумаб +
- 23. IMbrave 150: анализ ОВ в подгруппах (популяция ITT, 2 из 3) В пользу комбинации атезолизумаб +
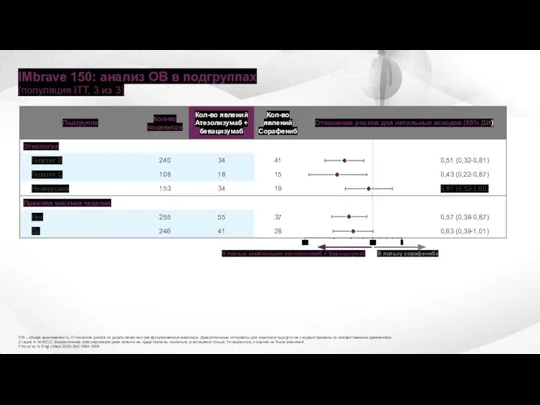
- 24. IMbrave 150: анализ ОВ в подгруппах (популяция ITT, 3 из 3) В пользу комбинации атезолизумаб +
- 25. IMbrave 150: анализ ВБП в подгруппах (популяция ITT, 1 из 3) В пользу комбинации атезолизумаб +
- 26. IMbrave 150: анализ ВБП в подгруппах (популяция ITT, 2 из 3) В пользу комбинации атезолизумаб +
- 27. IMbrave 150: анализ ВБП в подгруппах (популяция ITT, 3 из 3) В пользу комбинации атезолизумаб +
- 28. IMbrave 150: обновленные данные по частоте и длительности ответа UPDATE! a В анализ ЧОО были включены
- 29. Другая точка зрения: согласно критериям mRECIST для ГЦК ответы оцениваются по-другому - измеряются только жизнеспособные опухоли
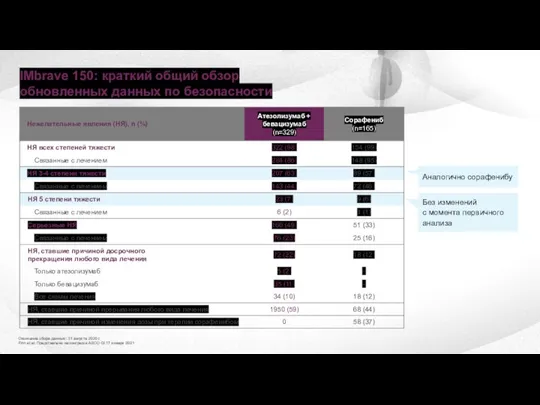
- 30. IMbrave 150: краткий общий обзор обновленных данных по безопасности Окончание сбора данных:: 31 августа 2020 г.
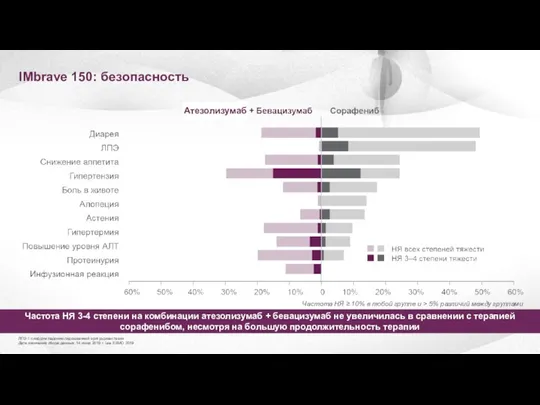
- 31. IMbrave 150: безопасность ЛПЭ = синдром ладонно-подошвенной эритродизестезии Дата окончания сбора данных: 14 июня 2019 г.
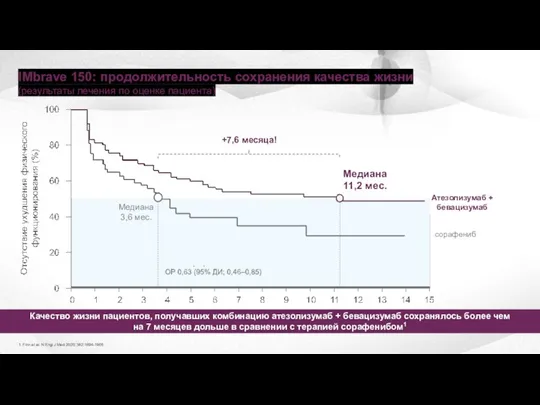
- 32. IMbrave 150: продолжительность сохранения качества жизни (результаты лечения по оценке пациента) 1. Finn et al. N
- 33. Комбинация атезолизумаб + бевацизумаб это первая линия лекарственной терапии неоперабельной ГЦК На комбинации атезолизумаб + бевацизумаб
- 34. Несмотря на более длительную терапию комбинацией атезолизумаб + бевацизумаб (7 месяцев на комбинации против 3 месяцев
- 36. Скачать презентацию



















 Проблемы выхаживания глубоко недоношенных детей на этапе реанимации
Проблемы выхаживания глубоко недоношенных детей на этапе реанимации Отчет 1 участка ЖК №2 с января по март 2017г
Отчет 1 участка ЖК №2 с января по март 2017г Федеральный фонд обязательного медицинского страхования
Федеральный фонд обязательного медицинского страхования Методика обучения ориентировке в пространстве детей с нарушением зрения
Методика обучения ориентировке в пространстве детей с нарушением зрения Эндодонтиялық ем жүргізу кезінде қолданылатын коффердам
Эндодонтиялық ем жүргізу кезінде қолданылатын коффердам Medical Quest. История одного дежурства
Medical Quest. История одного дежурства Основы ветеринарии
Основы ветеринарии Хирургические инструменты. Шовный материал. Лекция 2
Хирургические инструменты. Шовный материал. Лекция 2 Иммунитет. Общая характеристика иммунной системы организма. Виды и механизмы иммунитета. Фагоцитоз
Иммунитет. Общая характеристика иммунной системы организма. Виды и механизмы иммунитета. Фагоцитоз Комплексные решения для компенсации диабета. Medtronic
Комплексные решения для компенсации диабета. Medtronic Пищеварительная система. Проблемы, связанные с органами желудочно-кишечного тракта
Пищеварительная система. Проблемы, связанные с органами желудочно-кишечного тракта Первая медицинская помощь при термальных, химических ожогах
Первая медицинская помощь при термальных, химических ожогах Флегмоны и абсцессы челюстно-лицевой области
Флегмоны и абсцессы челюстно-лицевой области ЗОЖ (Здоровый образ жизни)
ЗОЖ (Здоровый образ жизни) Основы инфектологии
Основы инфектологии Епідемічне вірусне захворювання краснуха
Епідемічне вірусне захворювання краснуха Тактика хирурга при заболеваниях щитовидной железы
Тактика хирурга при заболеваниях щитовидной железы Возможности применения эфирного масла чабреца в лечении как перспективного противомикозного средства
Возможности применения эфирного масла чабреца в лечении как перспективного противомикозного средства Заманауи инсулиндік терапия
Заманауи инсулиндік терапия Патология дыхательной системы. Очаговая пневмония
Патология дыхательной системы. Очаговая пневмония КДС сұрақ-жауап
КДС сұрақ-жауап Минем яраткан хонэрем
Минем яраткан хонэрем Диабет bitch 21 века
Диабет bitch 21 века Формирование таза и факторы вызывающие его деформацию
Формирование таза и факторы вызывающие его деформацию Женское бесплодие
Женское бесплодие Активный аппарат движения. Мышца как орган
Активный аппарат движения. Мышца как орган Группа крови
Группа крови kopia
kopia