Содержание
- 2. Реорганизация генома при малигнизации клеток. Малигнизации клеток связана с реорганизацией генома, которая нередко выражается структурными или
- 3. История изучения клеточного генома при различных неоплазиях 1890 Hansemann -Первые систематические исследования реорганизации клеточных структур при
- 4. История изучения клеточного генома при различных неоплазиях HeLa — линия «бессмертных» клеток, используемая во множестве научных
- 5. Хромосомные перестройки причина возникновения рака 1970-С введением в цитогенетическую практику новых методов обработки хромосом и окрашивания
- 6. Хромосомные перестройки причина возникновения рака Инактивация генов-супрессоров опухолевого роста может быть следствием делеции хромосомного района или
- 7. Хромосомные перестройки причина возникновения рака Таким образом, хромосомная перестройка приводит к изменению регуляции онкогена, выражающемуся в
- 8. Вклад цитогенетических исследований в диагностику онкологических заболеваний. Практическое значение цитогенетической диагностики во многом зависит от существования
- 9. выявление клональности цитогенетическими методами Диагностика гипопластической острой миелоидной лейкемии при возможной апластической анемии. Дифференцирование миелоидного диспластического
- 10. Хромосомные аномалии, как указание на происхождение неоплазий. Цитогенетический анализ может представить информацию о моменте, когда произошла
- 11. Значение цитогенетических данных для выбора варианта терапии. Обнаружение кариотипических аномалий в случаях миелодисплазивного синдрома, ранее имеющего
- 13. Скачать презентацию
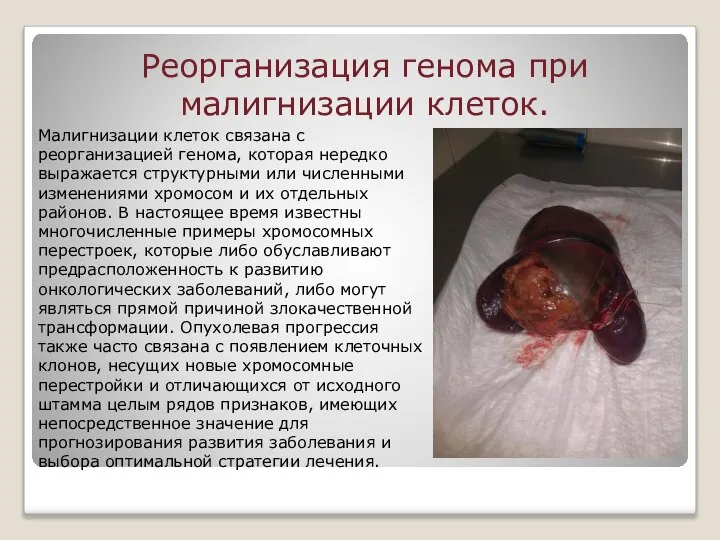
Слайд 2Реорганизация генома при малигнизации клеток.
Малигнизации клеток связана с реорганизацией генома, которая нередко
Реорганизация генома при малигнизации клеток.
Малигнизации клеток связана с реорганизацией генома, которая нередко
Слайд 3История изучения
клеточного генома при различных неоплазиях
1890 Hansemann -Первые систематические исследования реорганизации
История изучения
клеточного генома при различных неоплазиях
1890 Hansemann -Первые систематические исследования реорганизации

Boveri 1914-выдвинул предположение о приобретении опухолевыми клетками наследуемых изменений в виде нарушения геномного баланса.
1930 году Винге-Были выявлены некоторые закономерности появления и дальнейшей эволюции клеток с измененным кариотипом, а развитие постулата, сформулированного в 1930, привело к описанию поведения популяций опухолевых клеток в терминах генетической изменчивости и отбора.
1950-х годах изучение злокачественных асцитов, как спонтанно возникших, так и экспериментально индуцированных, показало, что для малигнизированных клеток характерны численные и структурные хромосомные аномалии.
Nowell and Hungerford 1960-Обнаружение филадельфийской хромосомы (Ph), как типичной хромосомной аномалии при хронической миелоидной лейкемии.
Caspersson et al., 1970-Новые методы цитологического анализа хромосом, открыли возможности идентификации не только индивидуальных хромосом человека, но их отдельных районов.
Mitelman et al., 1997-К июлю 1996 года были опубликованы результаты анализа 26523 неоплазий, несущих различные хромосомные аномалии. Результаты этих исследований были суммированы в 5-ом издании Каталога хромосомных аберраций при онкологических заболеваниях.
Слайд 4История изучения
клеточного генома при различных неоплазиях
HeLa — линия «бессмертных» клеток, используемая во множестве научных исследований
История изучения
клеточного генома при различных неоплазиях
HeLa — линия «бессмертных» клеток, используемая во множестве научных исследований

Линия была получена 8 февраля 1951 года из раковой опухоли шейки матки пациентки по имени Henrietta Lacks, умершей от этого заболевания 4 октября того же года. Клетки из опухолевого образования Генриетты были изъяты без её ведома и согласия исследователем Джорджом Гейем, который обнаружил, что в них можно поддерживать жизнь. Ему удалось выделить одну конкретную клетку, умножить её и начать клеточную линию. Гей назвал их клетками HeLa, по начальным буквам имени Генриетты Лакс. Это первые человеческие клетки, выращенные в лаборатории, которые были «бессмертными» — они не погибали после нескольких делений и могли быть использованы во многих экспериментах.
Хромосомы клеток HeLa имеют не укорачивающиеся теломеры.
Слайд 5Хромосомные перестройки причина возникновения рака
1970-С введением в цитогенетическую практику новых методов обработки
Хромосомные перестройки причина возникновения рака
1970-С введением в цитогенетическую практику новых методов обработки

Rabbitts 1994, Heim and Mitelman 1995 -в 80-е годы были получены результаты молекулярно-биологических исследований, которые расширили представления о механизмах неопластических процессов. Значительное число точек разрывов-воссоединений хромосом было охарактеризовано на молекулярном уровне. В результате было выделено два класса генов, которые часто оказывались локализованными в районах близких к местам хромосомных перестроек : “доминантные” онкогены и “рецессивные” гены-супрессоры опухолевого роста.
Klein 1989- Первым описанным случаем активации онкогена в результате хромосомной перестройки оказался перенос онкогена MYC в район транскрипционно активных иммуноглобулиновых генов. Следствием такого переноса является развитие лимфомы Беркитта .
Слайд 6Хромосомные перестройки причина возникновения рака
Инактивация генов-супрессоров опухолевого роста может быть следствием делеции
Хромосомные перестройки причина возникновения рака
Инактивация генов-супрессоров опухолевого роста может быть следствием делеции

Слайд 7Хромосомные перестройки причина возникновения рака
Таким образом, хромосомная перестройка приводит к изменению регуляции
Хромосомные перестройки причина возникновения рака
Таким образом, хромосомная перестройка приводит к изменению регуляции

А инактивация генов-супрессоров опухолевого роста может быть следствием делеции хромосомного района или потери всей хромосомы. Потеря районов, содержащих гены супрессоры опухолевого роста, была убедительно продемонстрирована совместными цитогенетическими и молекулярно-биологическими исследованиями. Предполагается, что такой механизм имеет место при возникновении значительного числа различных Карцином.
При проведении достаточного объема исследований было показано присутствие типичных хромосомных перестроек для большого числа неоплазий человека. В это же время стала очевидной клиническая значимость данных хромосомного анализа при постановке окончательного диагноза, выбора стратегии лечения и контроля эффективности проводимой терапии.
В качестве примера рассмотрим подробнее, какая информация, имеющая практическое значение для диагностики и лечения гемопоэтических неоплазий, может быть получена в результате цитогенетических исследований.
Слайд 8Вклад цитогенетических исследований в диагностику онкологических заболеваний.
Практическое значение цитогенетической диагностики во многом
Вклад цитогенетических исследований в диагностику онкологических заболеваний.
Практическое значение цитогенетической диагностики во многом

Слайд 9выявление клональности цитогенетическими методами
Диагностика гипопластической острой миелоидной лейкемии при возможной апластической анемии.
Дифференцирование
выявление клональности цитогенетическими методами
Диагностика гипопластической острой миелоидной лейкемии при возможной апластической анемии.
Дифференцирование

Дифференцирование гиперэозинофильного синдрома, обусловленного миелоидной неоплазией и реактивной эозинофилии.
Подтверждение диагноза полицитемии rubra vera.
Подтверждение анализа хронической гранулоцитной лейкемии на ранних стадиях.
Подтверждение диагноза лимфомы в случаях ангиоиммунобластных лимфоаденопатия-подобных лимфом.
Отличие лимфом, особенно иммунобластных лимфом, от неконтролируемой пролиферации, обусловленной инфекцией EBV иммунодефицитных пациентов.
Подтверждение диагноза гранулоцитной лейкемии, особенно в случаях без перестройки tcr генов.
Слайд 10Хромосомные аномалии, как указание на происхождение неоплазий.
Цитогенетический анализ может представить информацию о
Хромосомные аномалии, как указание на происхождение неоплазий.
Цитогенетический анализ может представить информацию о

Определение хромосомных перестроек в ряде случаев позволяет высказывать предположения о механизме клеточной трансформации. Транслокации хромосом могут приводить к созданию гибридных генов или переносить онкогены в районы, находящиеся под влиянием промоторов и энхансеров других генов, а делеции хромосомных районов могут вести к потере генов-супрессоров опухолевого роста. В связи с этим, анализ генного состава районов, утерянных или прилежащих к точкам разрывов, может оказаться информативным не только для определения механизма клеточной информации, но и для поиска молекулярных зондов, которые бы позволили проводить диагностику не на метафазных хромосомах, а непосредственно на интерфазных ядрах. Такая диагностика имеет большое значение для оценки стадии заболевания и эффективности проводимой терапии.
Слайд 11Значение цитогенетических данных для выбора варианта терапии.
Обнаружение кариотипических аномалий в случаях миелодисплазивного
Значение цитогенетических данных для выбора варианта терапии.
Обнаружение кариотипических аномалий в случаях миелодисплазивного

 Көңілді жұмбақ
Көңілді жұмбақ Выбор за вами
Выбор за вами Реабилитация детей с ДЦП
Реабилитация детей с ДЦП Как можно заразиться ВИЧ-инфекцией?
Как можно заразиться ВИЧ-инфекцией? Общая характеристика интеллектуальных расстройств
Общая характеристика интеллектуальных расстройств Drebrin controls scar formation and astrocyte reactivity upon traumatic brain injury by regulating membrane trafficking
Drebrin controls scar formation and astrocyte reactivity upon traumatic brain injury by regulating membrane trafficking Живокость. Фармакогностические исследования
Живокость. Фармакогностические исследования Уход и наблюдение за детьми с заболеваниями ОМС
Уход и наблюдение за детьми с заболеваниями ОМС Нестероидные противовоспалительные средства (НПВС) для наружного применения
Нестероидные противовоспалительные средства (НПВС) для наружного применения Аортальный стеноз
Аортальный стеноз Витамин С
Витамин С Практикум по ЭКГ
Практикум по ЭКГ Дивертикулы пищевода
Дивертикулы пищевода Проблема сохранения здоровья человека
Проблема сохранения здоровья человека Хирургическое лечение местно-распространенных форм рака гортани и шейного отдела пищевода
Хирургическое лечение местно-распространенных форм рака гортани и шейного отдела пищевода Вспомогательная репродукция при СПКЯ
Вспомогательная репродукция при СПКЯ Атеросклероз сосудов нижних конечностей
Атеросклероз сосудов нижних конечностей ГБУ Жилищник района Южное Бутово COVID-19
ГБУ Жилищник района Южное Бутово COVID-19 Рекомендации ESC/ESH по лечению артериальной гипертензии
Рекомендации ESC/ESH по лечению артериальной гипертензии Доврачебная медицинская помощь и особенности проведения реанимационных мероприятий
Доврачебная медицинская помощь и особенности проведения реанимационных мероприятий Школа здоровья для людей с поллинозом
Школа здоровья для людей с поллинозом Оказание первой помощи при ожогах
Оказание первой помощи при ожогах Бешенство у человека и вакцины во Франции и в Европе
Бешенство у человека и вакцины во Франции и в Европе Оториноларингологияда қарқынды ем қолдану. Мұрын ауруларын емдеу
Оториноларингологияда қарқынды ем қолдану. Мұрын ауруларын емдеу Особенности энергетического обмена у детей
Особенности энергетического обмена у детей Менінгококова інфекція у дітей (1)
Менінгококова інфекція у дітей (1) Изготовление проволочных кламмеров
Изготовление проволочных кламмеров SOPH-синдром: Синдром низкорослости с атрофией зрительных нервов, пельгеровской аномалией лейкоцитов
SOPH-синдром: Синдром низкорослости с атрофией зрительных нервов, пельгеровской аномалией лейкоцитов