Содержание
- 2. Классификация опухолей ЦНС ВОЗ 2007г. Морфологические классы (группы) опухолей. Опухоли нейроэпителиальной ткани (глиомы) Опухоли черепных и
- 3. Классификация опухолей ЦНС ВОЗ 2007г. Группа нейроэпителиальных опухолей. 1.Опухоли нейроэпителиальной ткани. 1.1.Астроцитарные опухоли. 1.2.Олигодендроглиальные опухоли. 1.3.Олигоастроцитарные
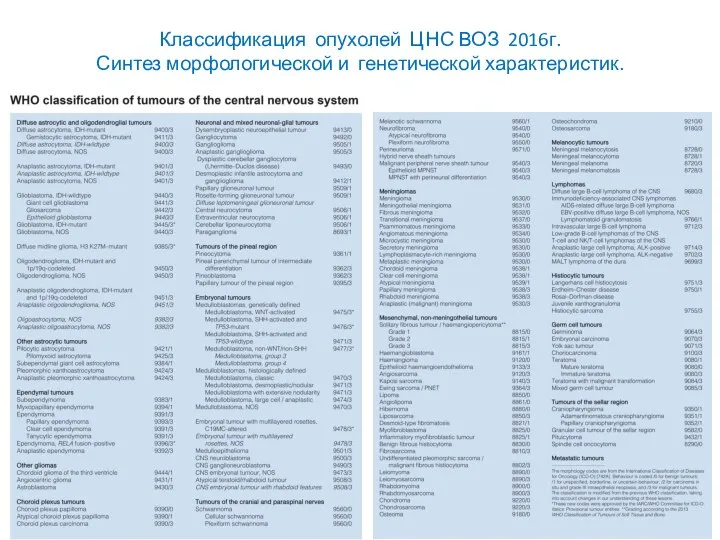
- 4. Классификация опухолей ЦНС ВОЗ 2016г. Синтез морфологической и генетической характеристик.
- 5. Сравнение классификаций 2007 и 2016г. 2007г. 1.Опухоли нейроэпителиальной ткани. 1.1.Астроцитарные опухоли. 1.2.Олигодендроглиальные опухоли. 1.3.Олигоастроцитарные (смешанные) опухоли.
- 6. Сравнение классификаций 2007 и 2016г. 2007г. 1.Опухоли нейроэпителиальной ткани. 1.1.Астроцитарные опухоли. 1.2.Олигодендроглиальные опухоли. 1.3.Олигоастроцитарные (смешанные) опухоли.
- 7. Сравнение классификаций 2007 и 2016г. 2007г. 1.Опухоли нейроэпителиальной ткани. 1.1.Астроцитарные опухоли. 1.2.Олигодендроглиальные опухоли. 1.3.Олигоастроцитарные (смешанные) опухоли.
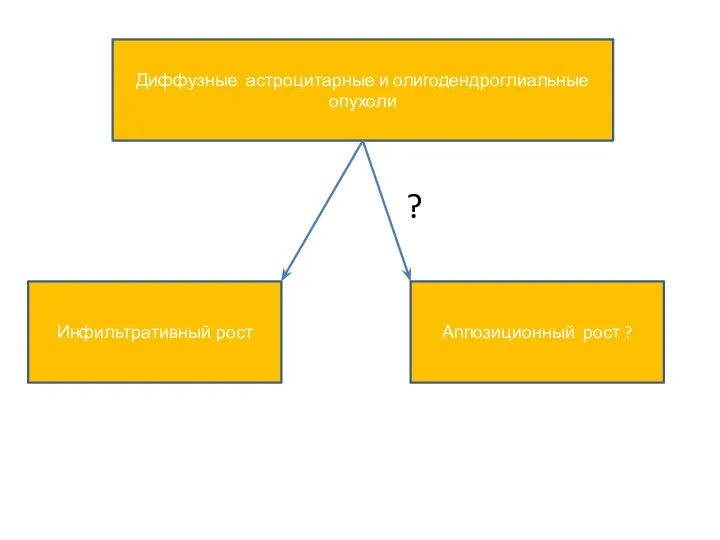
- 8. Современное клиническое понятие «глиома» применительно к классификации 2016г. – диффузные астроцитарные и олигодендроглиальные опухоли. Глиомы Морфологами
- 9. Виды роста опухоли. Различают три вида роста опухоли: Экспансивный; Инфильтративный; Аппозиционный.
- 10. Диффузные астроцитарные и олигодендроглиальные опухоли Аппозиционный рост ? Инфильтративный рост ?
- 11. Структура формирования названия и обозначения опухоли в классификации 2016г. Морфологическое название
- 12. Структура формирования названия и обозначения опухоли в классификации 2016г. Генетическая характеристика
- 13. Структура формирования названия и обозначения опухоли в классификации 2016г. ?
- 14. Структура формирования названия и обозначения опухоли в классификации 2016г. цифровой код, согласно Международной классификации болезней по
- 15. Структура формирования названия и обозначения опухоли в классификации 2016г. цифровой код, согласно Международной классификации болезней по
- 16. Морфологическими признаками доброкачественности опухоли являются: В группе диффузных астроцитарных и олигодендроглиальных опухолей эти признаки не встречаются
- 17. Клинические рекомендации 1.6 Стадирование . Для первичных опухолей ЦНС одним из наиболее важных классификационных признаков является
- 18. Степень злокачественности применительно к классификации 2016г. в группе диффузных астроцитарных опухолей. Grade II Grade III Grade
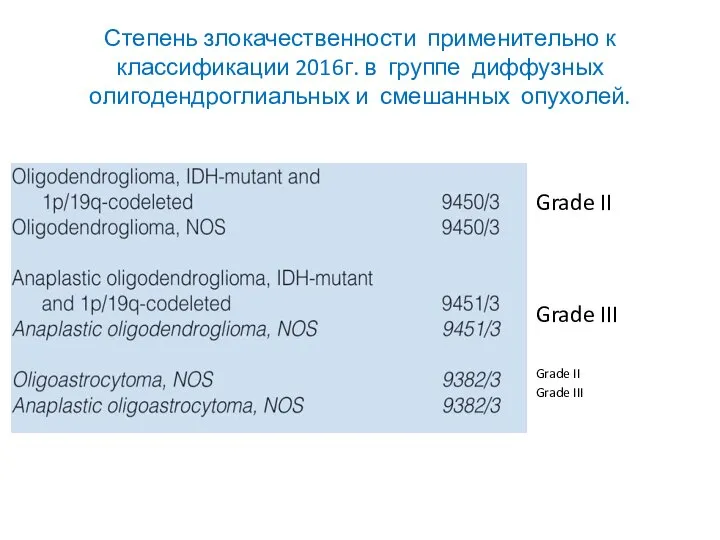
- 19. Степень злокачественности применительно к классификации 2016г. в группе диффузных олигодендроглиальных и смешанных опухолей. Grade II Grade
- 20. Определение степени злокачественности диффузных астроцитарных глиом. Степень злокачественности диффузных астроцитарных глиом определяется по классификациии Мэйо, основанной
- 21. Определение степени злокачественности диффузных астроцитарных глиом. Первый признак - ядерный атипизм. Nuclear atypia: Nuclear atypia was
- 22. Определение степени злокачественности диффузных астроцитарных глиом Ядро опухолевой клетки имеет больший размер по сравнению с ядром
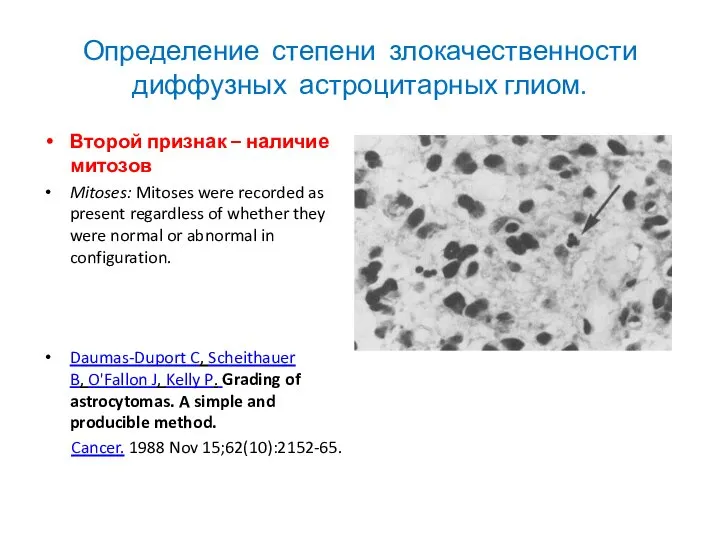
- 23. Определение степени злокачественности диффузных астроцитарных глиом. Второй признак – наличие митозов Mitoses: Mitoses were recorded as
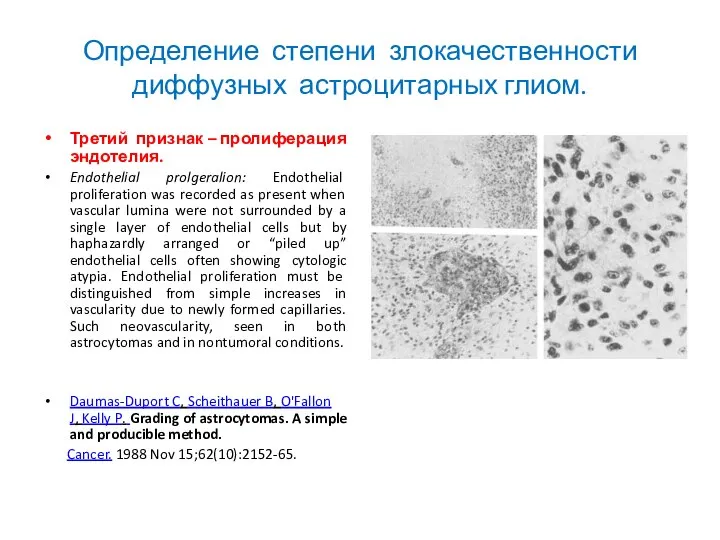
- 24. Определение степени злокачественности диффузных астроцитарных глиом. Третий признак – пролиферация эндотелия. Endothelial prolgeralion: Endothelial proliferation was
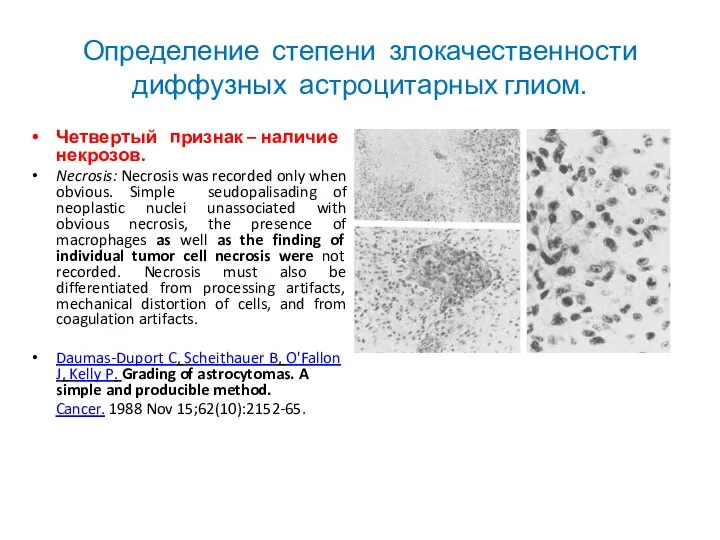
- 25. Определение степени злокачественности диффузных астроцитарных глиом. Четвертый признак – наличие некрозов. Necrosis: Necrosis was recorded only
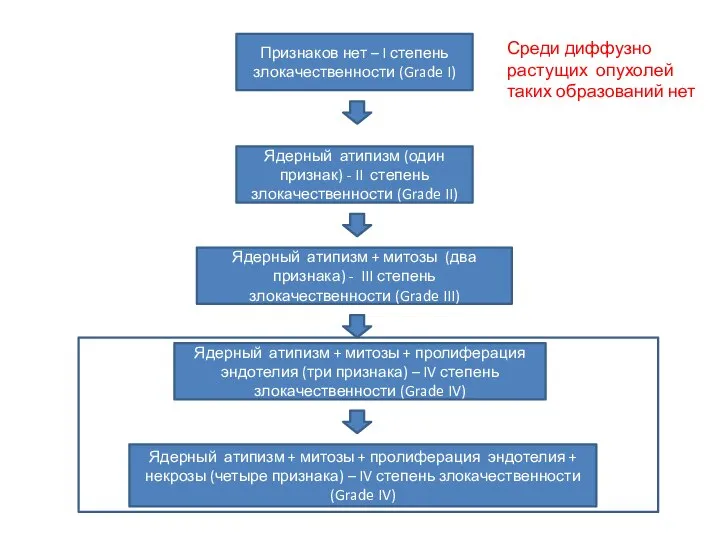
- 26. Критерии для определение степени злокачественности диффузных астроцитарных глиом (Критерии Daumas-Duport ) 1. Ядерный атипизм (отчетливые изменения
- 27. Ядерный атипизм (один признак) - II степень злокачественности (Grade II) Ядерный атипизм + митозы (два признака)
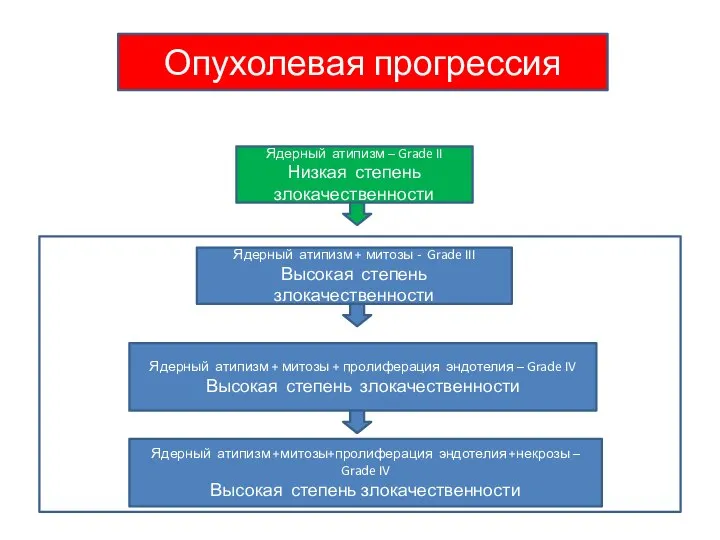
- 28. Учение об опухолевой прогрессии разработано Фулдсом (L.Foulds) в шестидесятые годы XX века. Основное положение сформулировано следующим
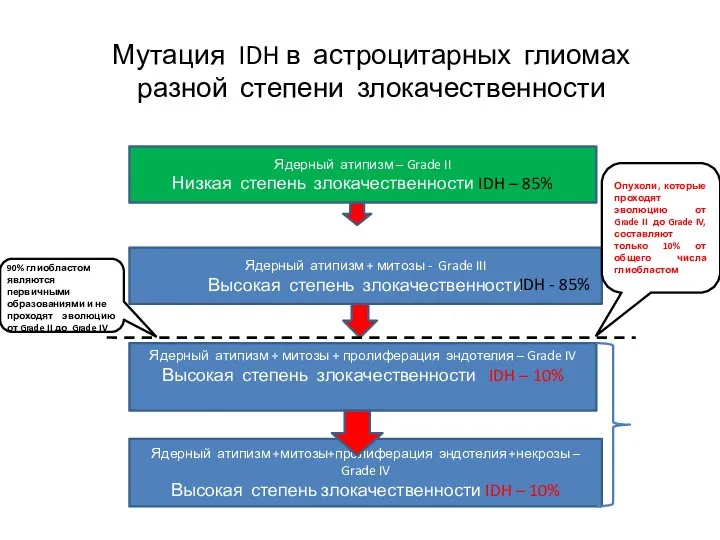
- 29. Ядерный атипизм – Grade II Низкая степень злокачественности Ядерный атипизм + митозы - Grade III Высокая
- 30. Степень злокачественности применительно к классификации 2016г. в группе диффузных астроцитарных опухолей. Опухоли низкой степени злокачественности Опухоли
- 31. Степень злокачественности применительно к классификации 2016г. в группе диффузных олигодендроглиальных опухолей. Опухоли низкой степени злокачественности Опухоли
- 32. Определение митотической активности - Ki-67/MIB-1 Ki-67 is an IgG1 class monoclonal antibody that was discovered by
- 33. Определение митотической активности - Ki-67/MIB-1 в глиомах разной степени злокачественности. Grade II – 3,0 (+/- 2,1)
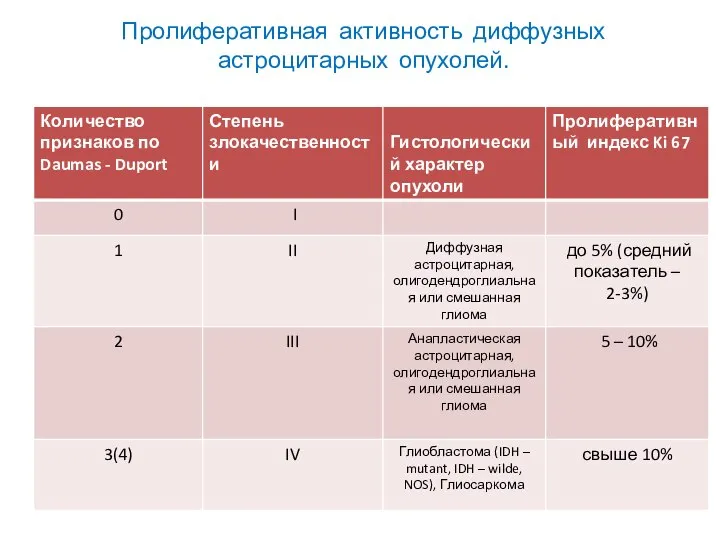
- 34. Пролиферативная активность диффузных астроцитарных опухолей.
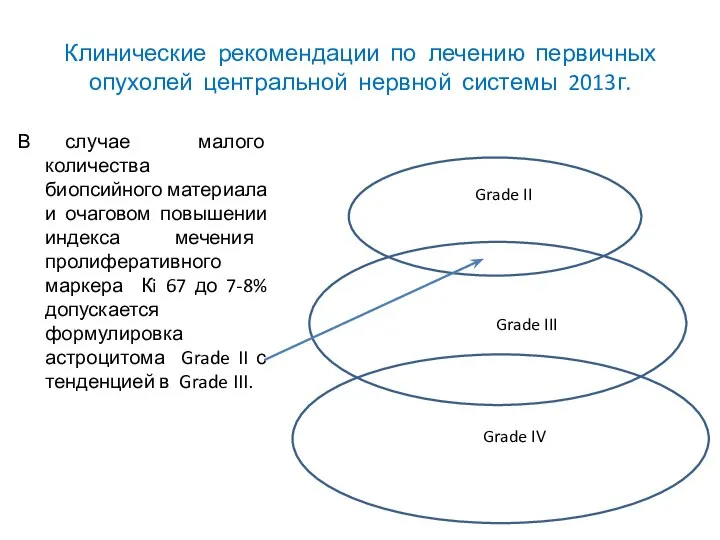
- 35. Клинические рекомендации по лечению первичных опухолей центральной нервной системы 2013г. В случае малого количества биопсийного материала
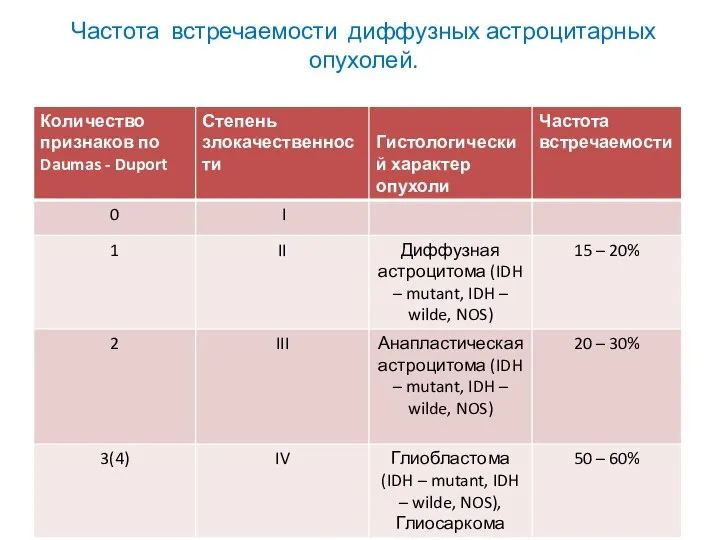
- 36. Частота встречаемости диффузных астроцитарных опухолей.
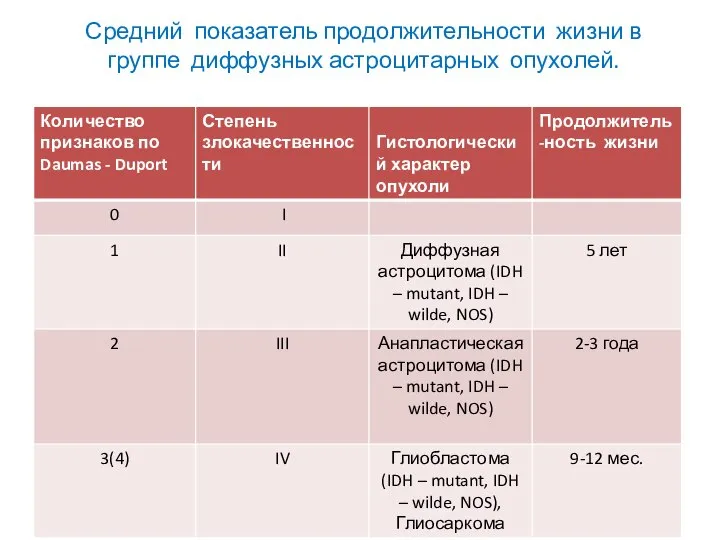
- 37. Средний показатель продолжительности жизни в группе диффузных астроцитарных опухолей.
- 38. Мутации в группе диффузных астроцитарных и олигодендроглиальных опухолей, использованные для классификации 2016г. IDH (isocitrate dehydrogenase) мутация
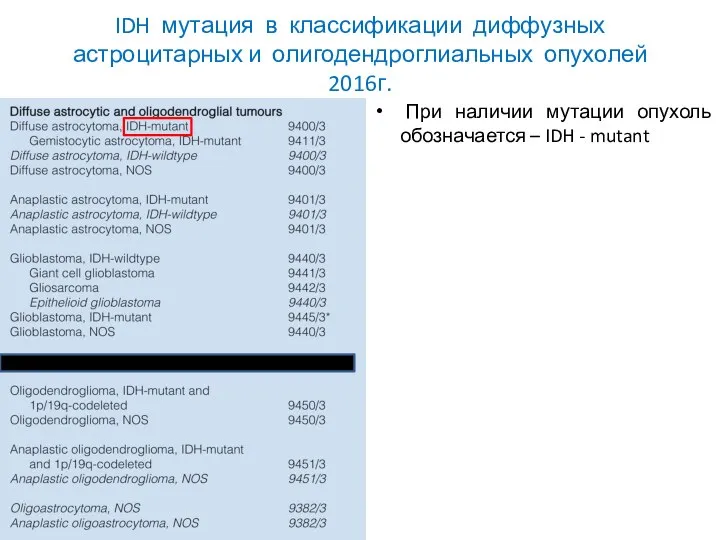
- 39. IDH мутация в классификации диффузных астроцитарных и олигодендроглиальных опухолей 2016г. При наличии мутации опухоль обозначается –
- 40. IDH мутация в классификации диффузных астроцитарных опухолей 2016г. При отсутствии мутации опухоль обозначается – IDH –
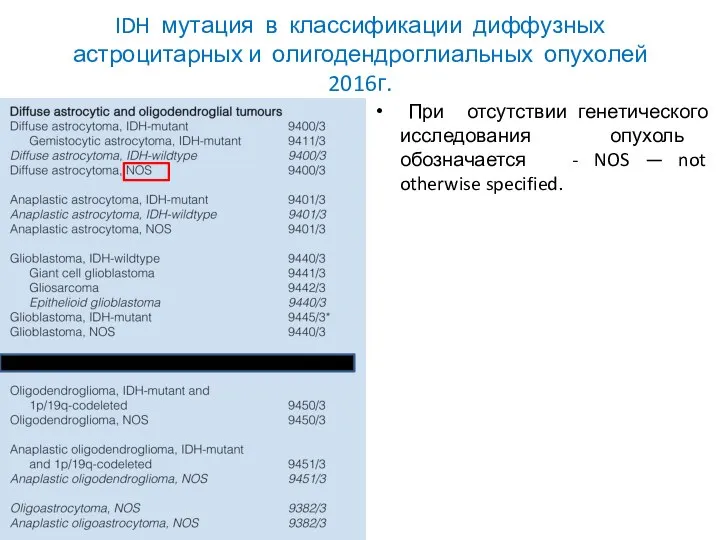
- 41. IDH мутация в классификации диффузных астроцитарных и олигодендроглиальных опухолей 2016г. При отсутствии генетического исследования опухоль обозначается
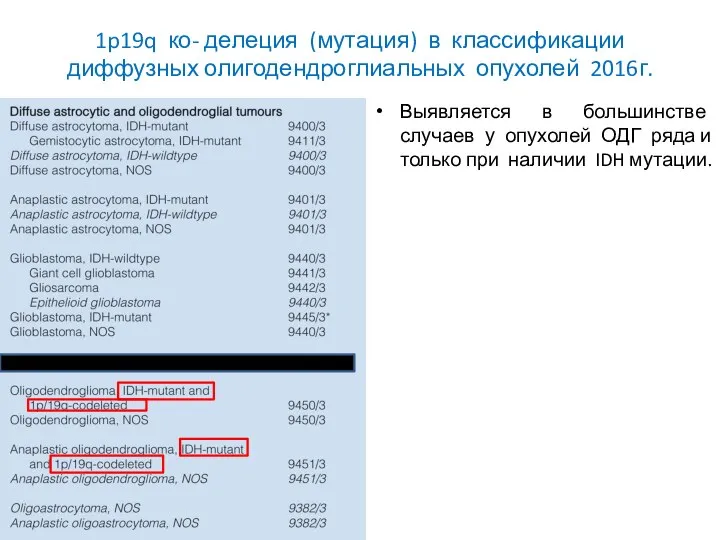
- 42. 1p19q ко- делеция (мутация) в классификации диффузных олигодендроглиальных опухолей 2016г. Выявляется в большинстве случаев у опухолей
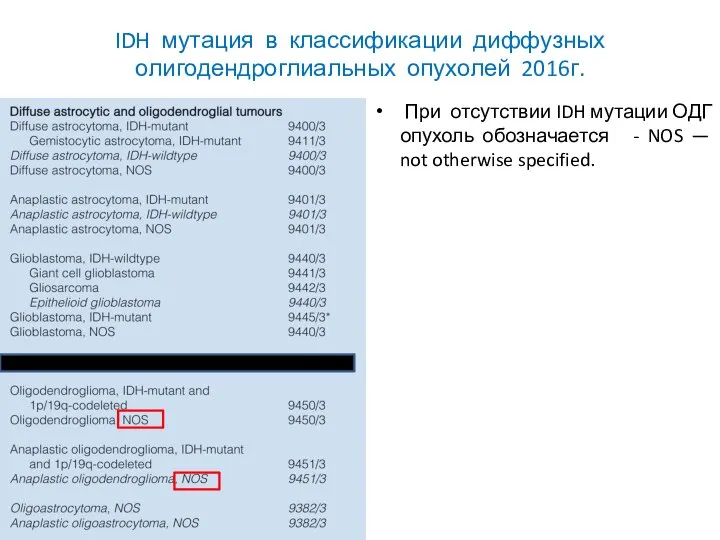
- 43. IDH мутация в классификации диффузных олигодендроглиальных опухолей 2016г. При отсутствии IDH мутации ОДГ опухоль обозначается -
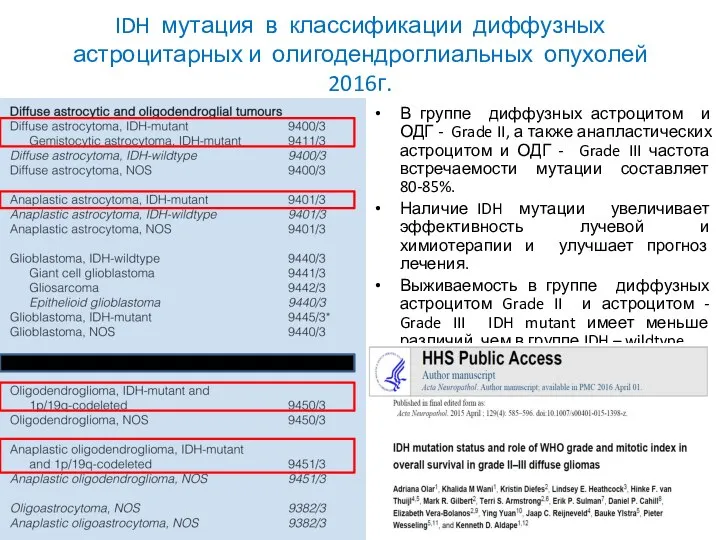
- 44. IDH мутация в классификации диффузных астроцитарных и олигодендроглиальных опухолей 2016г. В группе диффузных астроцитом и ОДГ
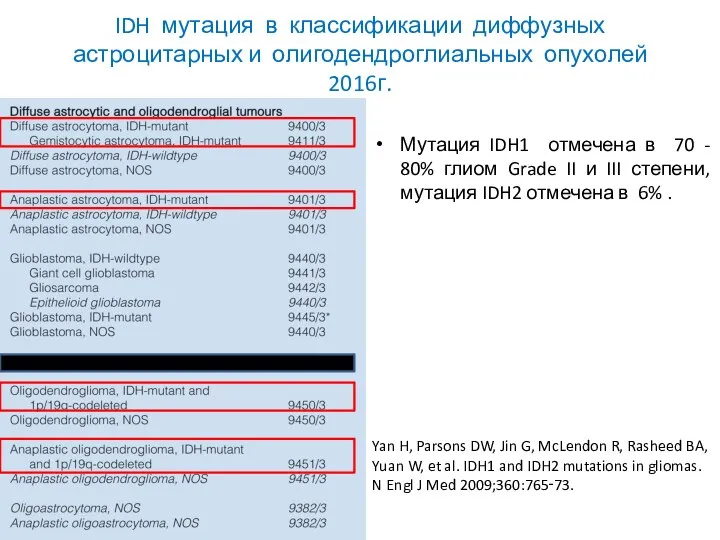
- 45. IDH мутация в классификации диффузных астроцитарных и олигодендроглиальных опухолей 2016г. Мутация IDH1 отмечена в 70 -
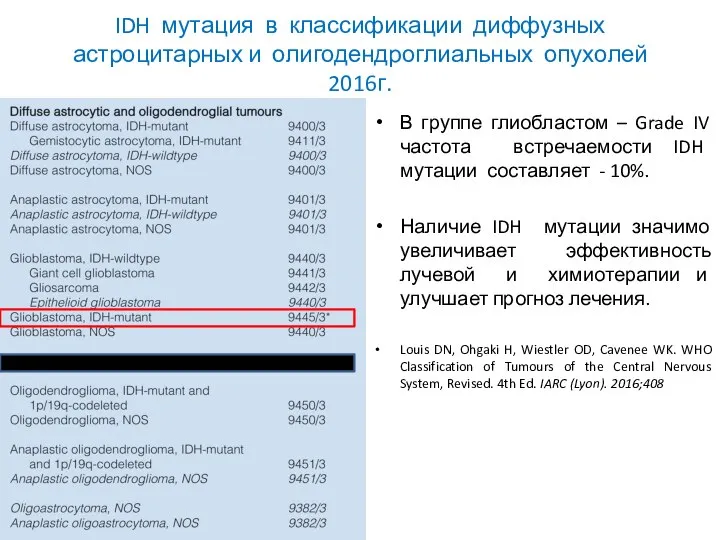
- 46. IDH мутация в классификации диффузных астроцитарных и олигодендроглиальных опухолей 2016г. В группе глиобластом – Grade IV
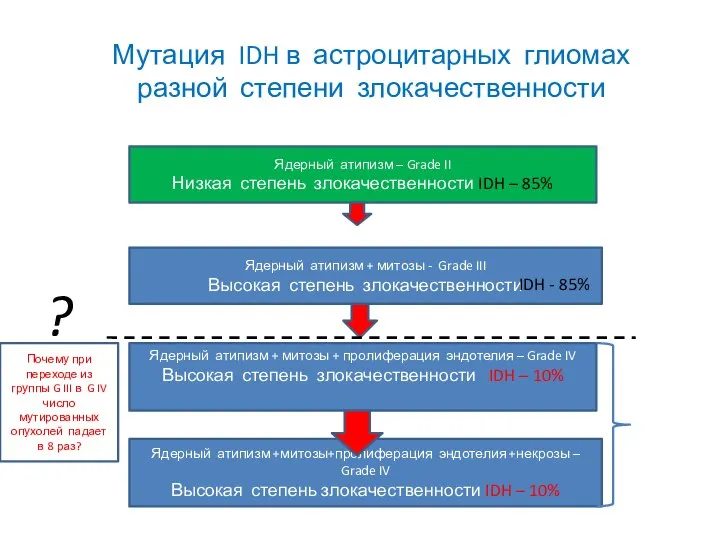
- 47. Ядерный атипизм – Grade II Низкая степень злокачественности IDH – 85% Ядерный атипизм + митозы -
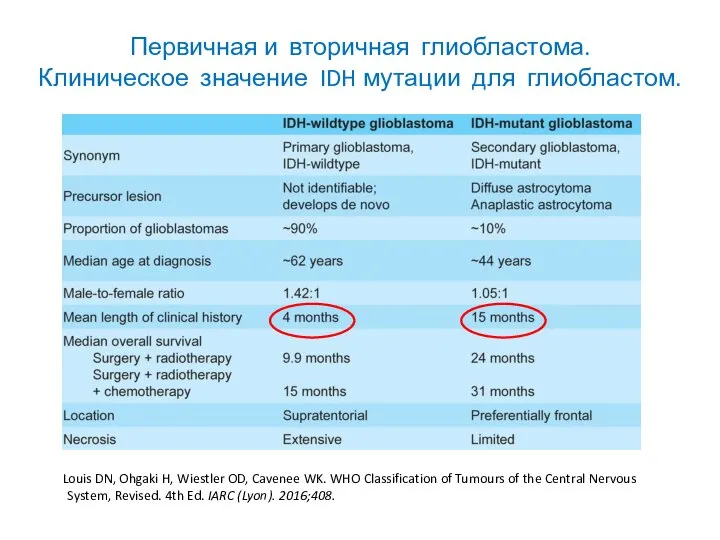
- 48. Первичная и вторичная глиобластома. Клиническое значение IDH мутации для глиобластом. Louis DN, Ohgaki H, Wiestler OD,
- 49. Ядерный атипизм – Grade II Низкая степень злокачественности IDH – 85% Ядерный атипизм + митозы -
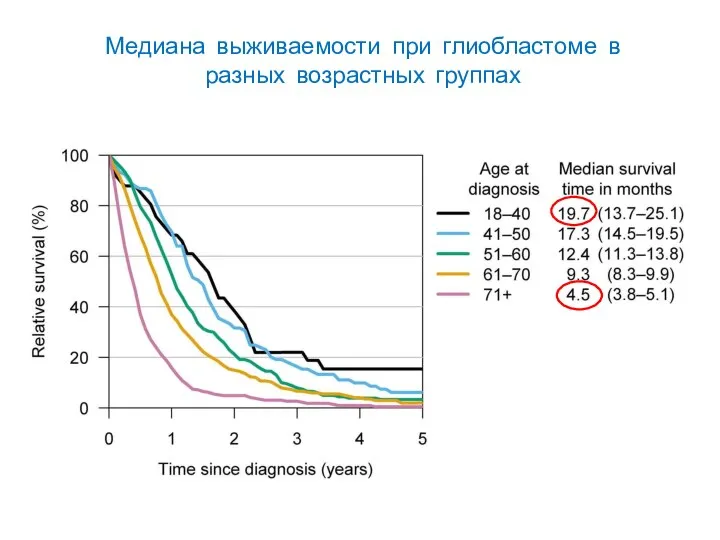
- 50. Медиана выживаемости при глиобластоме в разных возрастных группах
- 51. cIMPACT – NOW - Консорциум по практическому внедрению и совершенствованию классификации 2016г. Consortium to Inform Molecular
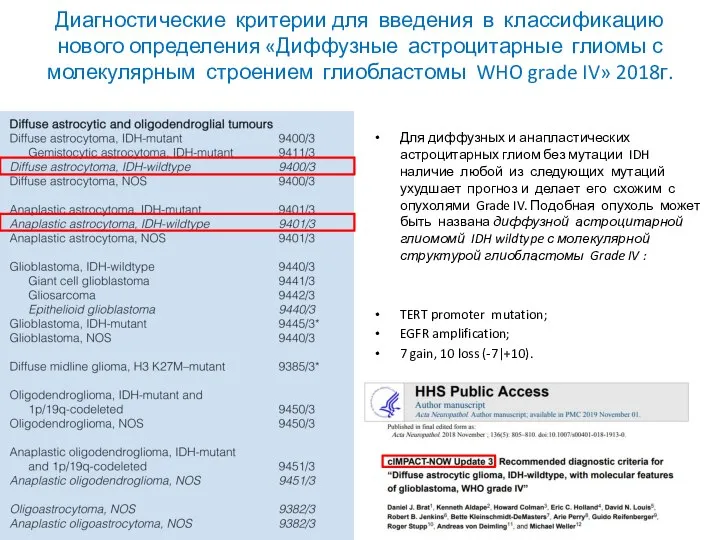
- 52. Диагностические критерии для введения в классификацию нового определения «Диффузные астроцитарные глиомы с молекулярным строением глиобластомы WHO
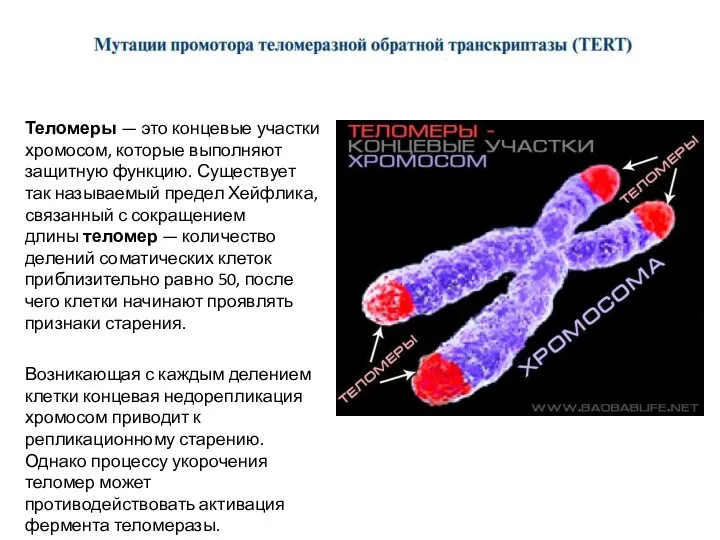
- 53. Теломеры — это концевые участки хромосом, которые выполняют защитную функцию. Существует так называемый предел Хейфлика, связанный
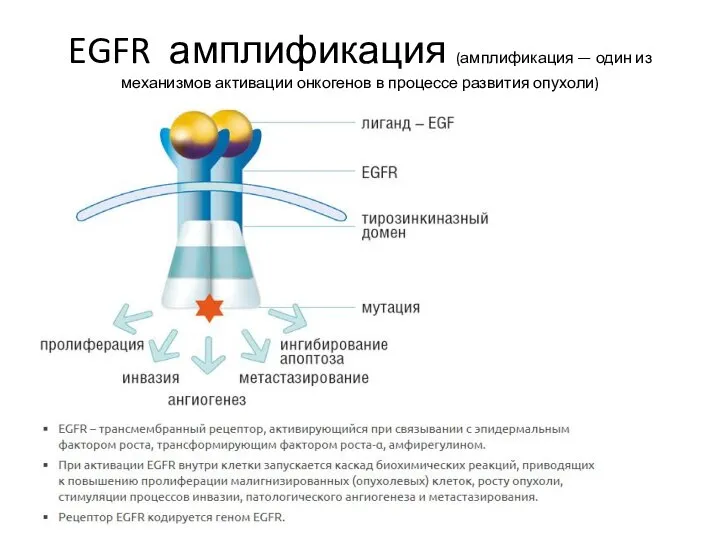
- 54. EGFR амплификация (амплификация — один из механизмов активации онкогенов в процессе развития опухоли)
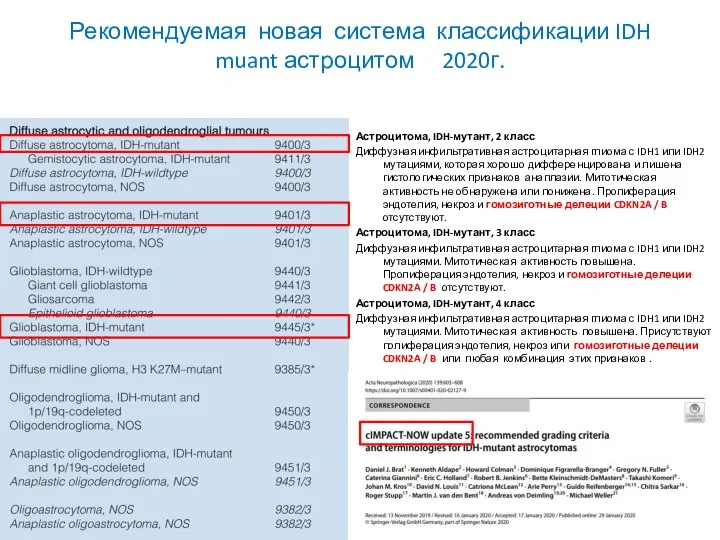
- 55. Рекомендуемая новая система классификации IDH muant астроцитом 2020г. Астроцитома, IDH-мутант, 2 класс Диффузная инфильтративная астроцитарная глиома
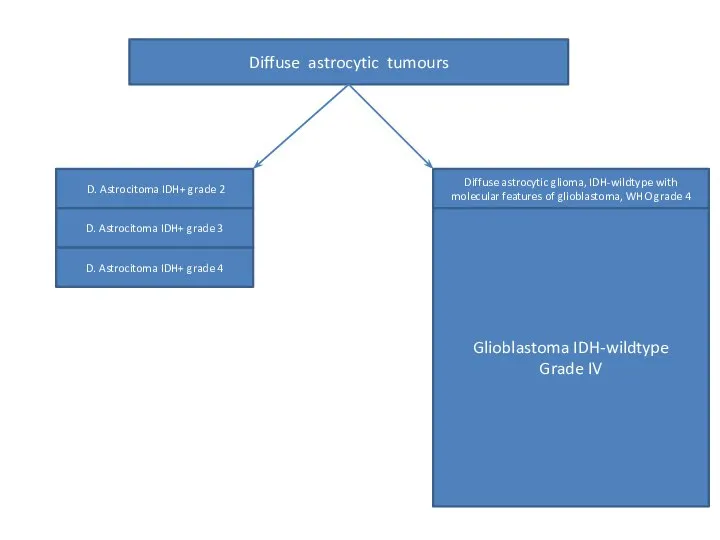
- 56. Diffuse astrocytic tumours D. Astrocitoma IDH+ grade 2 D. Astrocitoma IDH+ grade 3 Diffuse astrocytic glioma,
- 57. Мутации в классификации диффузных олигодендроглиальных опухолей 2016г. Наличие ко-делеции 1p 19q увеличивает эффективность лучевой и химиотерапии
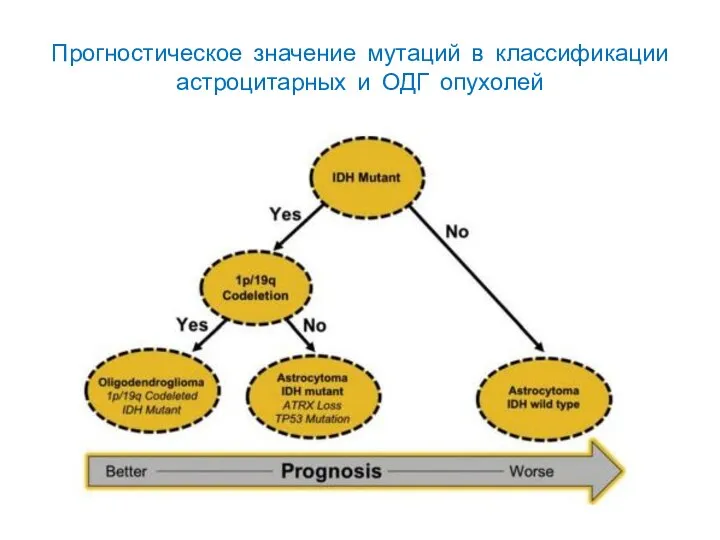
- 58. Прогностическое значение мутаций в классификации астроцитарных и ОДГ опухолей
- 59. Перспективы развития классификации диффузных астроцитарных и олигодендроглиальных опухолей 2016г. диффузные глиомы (астроцитарные и олигодендроглиальные разной степени
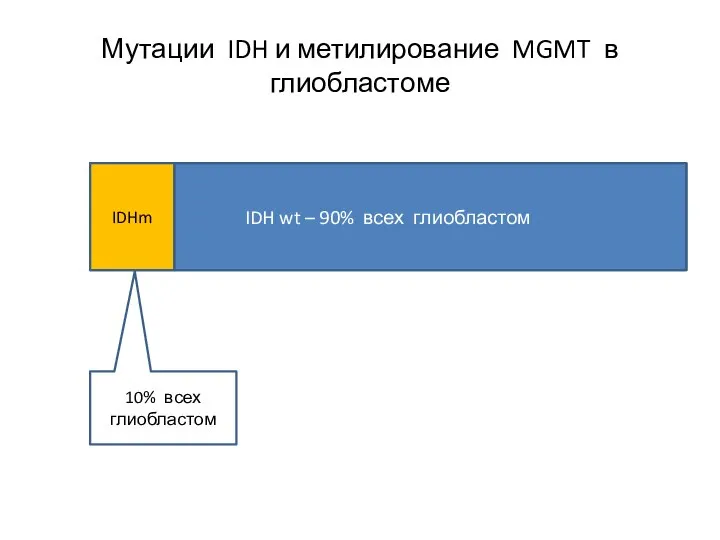
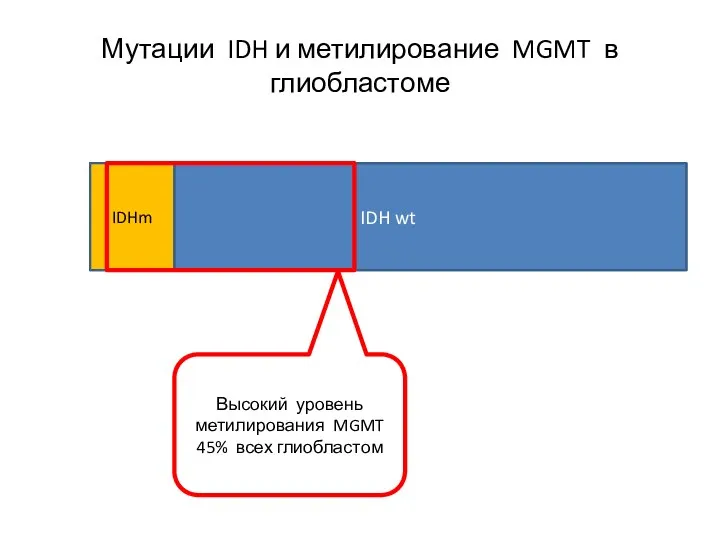
- 60. Прогностическое значение метилирования гена МGMT в лечении глиобластомы. Метилирование гена MGMT выявляется у 45% больных с
- 61. IDH wt – 90% всех глиобластом IDHm Мутации IDH и метилирование MGMT в глиобластоме 10% всех
- 62. IDH wt IDHm Мутации IDH и метилирование MGMT в глиобластоме Высокий уровень метилирования MGMT 45% всех
- 64. Скачать презентацию






























 Безопасность сестринской деятелньности
Безопасность сестринской деятелньности Первая медицинская помощь при закрытых травмах
Первая медицинская помощь при закрытых травмах Влияние психотропных средств на кроветворение
Влияние психотропных средств на кроветворение Гепатит А и С
Гепатит А и С Синдром Геерфордта
Синдром Геерфордта International Medical Corps
International Medical Corps Тяжелый Алкогольный Абстинентный Синдром
Тяжелый Алкогольный Абстинентный Синдром Кисты и опухоли слюнных желез
Кисты и опухоли слюнных желез Современные технологии в косметологии. Редермализация
Современные технологии в косметологии. Редермализация Pros and cons of vaccination
Pros and cons of vaccination Первая помощь
Первая помощь Особенности развития и течения паховых и бедренных грыж у мужчин и женщин
Особенности развития и течения паховых и бедренных грыж у мужчин и женщин Лихорадка неясного генеза
Лихорадка неясного генеза Жасуша патофизиологиясы
Жасуша патофизиологиясы Берегите ваши уши !
Берегите ваши уши ! Рак шейки матки. Лекция 20
Рак шейки матки. Лекция 20 Оказание первой помощи при термических ожогах, перегревах, электрическом поражении
Оказание первой помощи при термических ожогах, перегревах, электрическом поражении Квалификационные характеристики профессий системы здравоохранения
Квалификационные характеристики профессий системы здравоохранения Какая боль, какая боль… Пьер Огюст Ренуар
Какая боль, какая боль… Пьер Огюст Ренуар Помощь медицинскому персоналу в больницах. Памятка волонтеру
Помощь медицинскому персоналу в больницах. Памятка волонтеру Неврит зрительного нерва
Неврит зрительного нерва Введение в медицинскую генетику. Семиотика наследственной патологии
Введение в медицинскую генетику. Семиотика наследственной патологии Кариес. Кариесогенные факторы в полости рта. Способы их выявления и устранения. Зубные отложения и методы их выявления
Кариес. Кариесогенные факторы в полости рта. Способы их выявления и устранения. Зубные отложения и методы их выявления Лечение и профилактика бактериальных поражений печени у ВИЧ инфицированных больных
Лечение и профилактика бактериальных поражений печени у ВИЧ инфицированных больных Регуляция осмотического давления
Регуляция осмотического давления Грипп
Грипп Воспалительные заболевания лица и полости рта, травмы шеи
Воспалительные заболевания лица и полости рта, травмы шеи Муковисцидозы
Муковисцидозы