Содержание
- 2. Тезисы Больше данных за то, что повышение уровня прогестерона в позднюю фолликулярную фазу (ПФФ) не влияет
- 3. Преждевременное повышение прогестерона в фолликулярную фазу (ФФ) Повышенный прогестерон регистрируется в 5-38% циклов КОС Историческая эволюция
- 4. Преждевременное повышение прогестерона в ФФ и качество эмбрионов. Область для дискуссий? Обнаружена разница между качеством эмбрионов
- 5. Преждевременная лютеинизация или повышенный уровень прогестерона – где эта грань? Частота (%) имплантации по оси У
- 6. Длина фолликулярной фазы ассоциировано с частотой клинической беременности При непрерывном анализе длины фолликулярной фазы частота клинической
- 7. Dual Stim - большее количество яйцеклеток и эуплоидных эмбрионов с участием стимуляции в лютеиновую фазу (LPS)
- 8. Преждевременное повышение прогестерона в ФФ и частота клинической беременности Авторами обзора Kalakota et al. проанализировано влияние
- 9. Мониторинг прогестерона на момент эмбриотрансфера ВОПРОC ИССЛЕДОВАНИЯ Существует ли порог сывороточного прогестерона (P) в день переноса
- 10. Криоэмбриотрансфер в естественном vs ЗГТ цикле Было включено 18 РКИ*, в которых сравнивали различные циклы КриоЭТ
- 11. Криоэмбриотрансфер в естественном vs ЗГТ цикле 2017 – Ретроспективное когортное исследование (65 ЕЦ и 48 ЗГТ
- 12. ДИЗАЙН ИССЛЕДОВАНИЯ, РАЗМЕР, ПРОДОЛЖИТЕЛЬНОСТЬ Это проспективное когортное исследование было проведено в период с сентября 2017 года
- 13. Группы исследований
- 14. Протокол лечения УЗИ Контроль E2 + Pg УЗИ Контроль E2 + Pg за 1-2 часа до
- 15. Исходы Возраст 39,6 +/- 4,6 лет М-ЭХО 8.8 +/- 1,5 мм 88% - перенос одной бластоцисты
- 16. Индивидуализированная поддержка прогестероном на момент эмбриотрансфера – Alvarez et al. Вопрос исследования: Улучшает ли индивидуальная поддержка
- 17. Индивидуализированная поддержка прогестероном на момент эмбриотрансфера – Alvarez et al. Дизайн, размер, продолжительность исследования: Проспективное обсервационное
- 18. Результат исследования – при индивидуализированной поддержке прогестероном нет достоверных различий в исходе наступления клинической беременности (и
- 19. Индивидуализированная поддержка прогестероном на момент эмбриотрансфера – Labarta et al. Цель: проанализировать влияние индивидуализированной поддержки лютеиновой
- 20. Индивидуализированная поддержка прогестероном на момент эмбриотрансфера – Labarta et al. Дизайн: ретроспективное когортное исследование, с 1
- 21. Гормональный мониторинг. ESHRE guidelines Повышает ли добавление гормональной оценки (эстрадиол/прогестерон/ЛГ) к ультразвуковому мониторингу эффективность и безопасность
- 22. Мониторинг эстрадиола За последние 8 лет - нет ни одного нового рандомизированного исследования мониторинга эстрадиола Cochrane
- 23. Мониторинг эстрадиола. Ретроспективные исследования По сравнению с циклами со снижением сывороточного эстрадиола (СЭ) на ≤ 20
- 24. Мониторинг эстрадиола Ретроспективные исследования Частота клинической беременности была самой высокой у пациенток с отношением Е2 к
- 25. Эстрадиол и его рецепторы (ER). Новые перспективы Исследование Liu et al. 2017 показало, что ФСГ стимулирует
- 26. Эстрадиол и его рецепторы (ER). Новые перспективы Исследование Liu 2017 определило потенциальную роль E2-ER в контроле
- 27. Роль ЛГ Ооциты и клетки кумулюса не имеют собственных рецепторов к ЛГ, овуляция регулируется опосредованно через
- 28. Мониторинг ЛГ Мониторинг ЛГ для принятия решения о назначении антагонистов во время КОС (Liu M, Liu
- 29. Вопросы для будущих дискуссий Есть ли сейчас в клинической практике адекватные маркеры-предикторы качества ооцитов? Оценивается ли
- 31. Скачать презентацию
Слайд 2Тезисы
Больше данных за то, что повышение уровня прогестерона в позднюю фолликулярную фазу
Тезисы
Больше данных за то, что повышение уровня прогестерона в позднюю фолликулярную фазу

DuoStim не влияет на качество яйцеклеток/эмбрионов – количество эмбрионов даже больше в лютеиновую фазу у пациенток с бедным ответом. Нет данных за негативный эффект прогестерон на яйцеклетки/эмбрион в ЛФ.
Повышение уровня прогестерона влияет на качество эндометрия+ медленная скорость роста эмбрионов –риск асинхронизации окна имплантации, ограничение для переносов в свежем цикле
Ооциты и клетки кумулюса не имеют собственных рецепторов к ЛГ, но имеют рецепторы к прогестерону (P4). Прогестерон, возможно, тормозит продолжение мейоза в ооцитах и снижает уровень cAMP (одна из энергомолекул).
Гранулезные клетки под воздействием ЛГ паракринно влияют на ооцит и клетки кумулюса.
Слайд 3Преждевременное повышение прогестерона в фолликулярную фазу (ФФ)
Повышенный прогестерон регистрируется в 5-38% циклов
Преждевременное повышение прогестерона в фолликулярную фазу (ФФ)
Повышенный прогестерон регистрируется в 5-38% циклов

Историческая эволюция взглядов на повышенный прогестерон: в 2010х годах произошла смена «отсечки» уровня прогестерона для дихотомического анализа с 0,9 до 1,5-2,2 нг/мл
До сих пор остается неясным эффект повышенного уровня прогестерона в фолликулярную фазу на исходы протоколов КОС, а также является ли это причиной или ассоциацией с неудачами созревания яйцеклетки/ имплантации/потери беременности.
Слайд 4Преждевременное повышение прогестерона в ФФ и качество эмбрионов. Область для дискуссий?
Обнаружена разница
Преждевременное повышение прогестерона в ФФ и качество эмбрионов. Область для дискуссий?
Обнаружена разница

Разница между эмбрионами не обнаружена
Слайд 5Преждевременная лютеинизация или повышенный уровень прогестерона – где эта грань?
Частота (%) имплантации
Преждевременная лютеинизация или повышенный уровень прогестерона – где эта грань?
Частота (%) имплантации

Кривая (сверху А и С) и линейная (снизу B и D) зависимости
Слайд 6Длина фолликулярной фазы ассоциировано с частотой клинической беременности
При непрерывном анализе длины фолликулярной
Длина фолликулярной фазы ассоциировано с частотой клинической беременности
При непрерывном анализе длины фолликулярной

Bakkensen JB, Christou G, Dimitriadis I, James K, Souter I. The effect of follicular phase length on cycle outcomes and endometrial development in gonadotrophin ovarian stimulation/intrauterine insemination cycles. Reprod Biomed Online. 2020 Mar;40(3):362-368. doi: 10.1016/j.rbmo.2019.12.007. Epub 2019 Dec 16. PMID: 32061522.
Слайд 7Dual Stim - большее количество яйцеклеток и эуплоидных эмбрионов с участием стимуляции
Dual Stim - большее количество яйцеклеток и эуплоидных эмбрионов с участием стимуляции

Лютеиновая фаза стимуляции (ЛФС) привел к более высокому среднему количеству собранных ооцитов, чем ФФС; однако их компетентность (т.е. оплодотворение, бластоцисты, показатели эуплоидии и клинические результаты после переноса эуплоидного одиночного эмбриона) были сопоставимы. Важно отметить, что частота пациентов, получивших хотя бы одну эуплоидную бластоцисту, увеличилась с 42,3% (n = 131/310) после FPS до 65,5% (n = 203/310) с участием ооцитов, полученных в LPS.
Vaiarelli A, Cimadomo D, Trabucco E, Vallefuoco R, Buffo L, Dusi L, Fiorini F, Barnocchi N, Bulletti FM, Rienzi L, Ubaldi FM. Double Stimulation in the Same Ovarian Cycle (DuoStim) to Maximize the Number of Oocytes Retrieved From Poor Prognosis Patients: A Multicenter Experience and SWOT Analysis. Front Endocrinol (Lausanne). 2018 Jun 14;9:317. doi: 10.3389/fendo.2018.00317. PMID: 29963011; PMCID: PMC6010525.
Было зарегистрировано получение большего количества ооцитов (и, следовательно, больше эмбрионов) на стадии ЛФС, чем на стадии ФФС у пациенток с бедным ответом.
Luo, Y., Sun, L., Dong, M. et al. The best execution of the DuoStim strategy (double stimulation in the follicular and luteal phase of the same ovarian cycle) in patients who are poor ovarian responders. Reprod Biol Endocrinol 18, 102 (2020). https://doi.org/10.1186/s12958-020-00655-3
Слайд 8Преждевременное повышение прогестерона в ФФ и частота клинической беременности
Авторами обзора Kalakota et
Преждевременное повышение прогестерона в ФФ и частота клинической беременности
Авторами обзора Kalakota et

Интересно, что результаты различаются между теми, кто перенес свежий и замороженный ЭТ. В частности, у реципиентов с повышенным уровнем прогестерона в сыворотке во время циклов забора ооцитов, которым был проведен замороженный ЭТ, и у реципиентов, получивших донорские ооциты в ходе донорских циклов с повышенным уровнем прогестерона в сыворотке, были одинаковые, если не повышенные, показатели имплантации, родов за перенос, беременность, продолжающаяся беременность и аналогичные показатели выкидышей.
Кроме того, не было никакой разницы в кумулятивных показателях живорождения, т. е. количестве живорождений в одном цикле ВРТ, между теми, у кого был повышенный уровень прогестерона по сравнению с нормальным, после переноса замороженных эмбрионов и PGT-A.
В исследованиях, посвященных свежему ЭТ, наблюдалось снижение показателей частоты наступления беременности и продолжающейся беременности, а также показателей живорождения.
Повышенный уровень прогестерона в сыворотке в фолликулярную фазу оказывает минимальное влияние на качество ооцитов и эмбрионов. Влияние свежего эмбриотрансфера на клинические исходы предположительно отражает влияние повышенного уровня прогестерона в сыворотке на эндометрий (Kalakota et al. 2022)
Слайд 9Мониторинг прогестерона на момент эмбриотрансфера
ВОПРОC ИССЛЕДОВАНИЯ
Существует ли порог сывороточного прогестерона (P) в
Мониторинг прогестерона на момент эмбриотрансфера
ВОПРОC ИССЛЕДОВАНИЯ
Существует ли порог сывороточного прогестерона (P) в

ВЫВОД
Уровни P в сыворотке <8,8 нг / мл в день ET снижают частоту продолжающихся беременностей (OPR) (беременностей >12 недель) как в циклах с собственными, так и с донорскими ооцитами.
РАСШИРЕННОЕ ПРИМЕНЕНИЕ РЕЗУЛЬТАТОВ
Это исследование определило порог сывороточного P как 8,8 нг / мл в день ЭТ для циклов подготовки искусственного эндометрия, необходимых для оптимизации результатов, в циклах с собственными или донорскими ооцитами.
У одной трети пациенток, получающих ПМК, был обнаружен недостаточный уровень сывороточного прогестерона, что, в свою очередь, влияет на успех цикла АРТ. Мониторинг уровней P в середине лютеиновой фазы рекомендуется при использовании микронизированного вагинального прогестерона для корректировки доз в соответствии с потребностями пациента.
Слайд 10Криоэмбриотрансфер в естественном vs ЗГТ цикле
Было включено 18 РКИ*, в которых сравнивали
Криоэмбриотрансфер в естественном vs ЗГТ цикле
Было включено 18 РКИ*, в которых сравнивали

В этом обзоре не было найдено достаточных доказательств в поддержку использования одного режима цикла вместо другого при подготовке к криоЭТ у женщин с пониженной фертильностью и регулярными овуляторными циклами. Наиболее распространенными методами криоЭТ являются естественный цикл (с триггером ХГЧ или без него) или подготовка эндометрия с ГТ (с применением агонистов ГнРГ или без них). Было выявлено только четыре прямых сравнения этих двух модальностей, и не было обнаружено достаточных доказательств в поддержку применения определенной модальности.
*на момент 2 декабря 2016 года
Слайд 11Криоэмбриотрансфер в естественном vs ЗГТ цикле
2017 – Ретроспективное когортное исследование (65 ЕЦ
Криоэмбриотрансфер в естественном vs ЗГТ цикле
2017 – Ретроспективное когортное исследование (65 ЕЦ

2019 - Ретроспективное когортное исследование (1265 циклов, 860 женщин) – криоЭТ в ЕЦ повышает частоту имплантации по сравнению с ЗГТ (эстрогены transdermal или per os). 2
2022 – Ретроспективное когортное исследование – (2920 циклов) – частота живорождения в ЗГТ цикле ниже. Самая высокая частота была в модифицированном ЕЦ (c ХГЧ-триггером)3
1 Melnick, Alexis P et al. “Replacing single frozen-thawed euploid embryos in a natural cycle in ovulatory women may increase live birth rates compared to medicated cycles in anovulatory women.” Journal of assisted reproduction and genetics vol. 34,10 (2017): 1325-1331. doi:10.1007/s10815-017-0983-6
2 Cardenas Armas DF et al. Frozen-thawed blastocyst transfer in natural cycle increase implantation rates compared artificial cycle. Gynecol Endocrinol. 2019 Oct;
3 Kadour-Peero, Einav et al. “A comparison of frozen-thawed embryo transfer protocols in 2920 single-blastocyst transfers.” Archives of gynecology and obstetrics vol. 306,3 (2022): 887-892. doi:10.1007/s00404-022-06588-z
Слайд 12ДИЗАЙН ИССЛЕДОВАНИЯ, РАЗМЕР, ПРОДОЛЖИТЕЛЬНОСТЬ
Это проспективное когортное исследование было проведено в период с
ДИЗАЙН ИССЛЕДОВАНИЯ, РАЗМЕР, ПРОДОЛЖИТЕЛЬНОСТЬ
Это проспективное когортное исследование было проведено в период с

ГРУППЫ ПАЦИЕНТОВ И МЕТОДЫ
Пациентам до 50 лет с трехслойным эндометрием ≥6,5 мм перенесен перенос одной или двух бластоцист. Всего было проанализировано 1150 пациентов, получавших собственные ооциты без доимплантационного генетического тестирования на анеуплоидии (PGT-A) (n = 184), собственные ооциты с PGT-A (n = 308) или донорские ооциты (n = 658). Первичной конечной точкой анализа была частота продолжающей беременности (OPR) после 12 недели беременности, основанный на уровнях P в сыворотке, измеренных непосредственно перед ET.
ОСНОВНЫЕ РЕЗУЛЬТАТЫ И РОЛЬ ШАНСА
У женщин с сывороточным уровнем P <8,8 нг / мл (30-я процентиль) частота OPR (36,6% против 54,4%) и частота живорождений (35,5% против 52,0%) были значительно ниже, чем у остальных пациенток. Многомерная логистическая регрессия показала, что сывороточный P <8,8 нг / мл был независимым фактором, влияющим на OPR в общей популяции и в трех группах лечения. Значительная отрицательная корреляция наблюдалась между уровнями P в сыворотке и ИМТ, массой тела и временем между последней дозой P и анализами крови, а положительная корреляция была обнаружена с возрастом, ростом и количеством дней на ЗГТ. Многомерная логистическая регрессия показала, что только масса тела была независимым фактором для представления уровней P в сыворотке <8,8 нг / мл. Акушерские и перинатальные исходы не различались у пациенток с продолжающейся беременностью, независимо от уровня сывороточного прогестерона выше / ниже 8,8 нг/мл.
ОГРАНИЧЕНИЯ, ПРИЧИНЫ ВНИМАНИЯ
Были включены только женщины с поддержкой ЛФ микронизированным вагинальным прогестероном. Экстраполяция на другие формы введения P требует подтверждения.
Мониторинг прогестерона на момент эмбриотрансфера
Слайд 13Группы исследований
Группы исследований

Слайд 14Протокол лечения
УЗИ
Контроль
E2 + Pg
УЗИ
Контроль
E2 + Pg за 1-2 часа до
Протокол лечения
УЗИ
Контроль
E2 + Pg
УЗИ
Контроль
E2 + Pg за 1-2 часа до
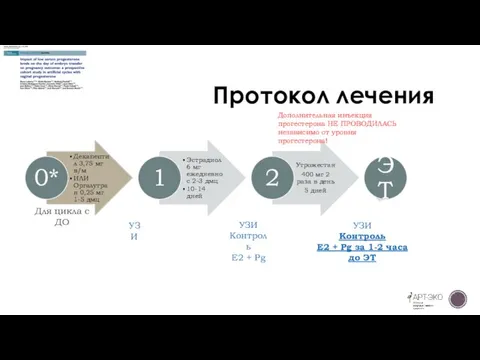
УЗИ
Для цикла с ДО
Дополнительная инъекция прогестерона НЕ ПРОВОДИЛАСЬ независимо от уровня прогестерона!
Слайд 15Исходы
Возраст 39,6 +/- 4,6 лет
М-ЭХО 8.8 +/- 1,5 мм
88% - перенос одной
Исходы
Возраст 39,6 +/- 4,6 лет
М-ЭХО 8.8 +/- 1,5 мм
88% - перенос одной

У женщин с сывороточным уровнем P <8,8 нг / мл (30-я процентиль) частота OPR (36,6% против 54,4%) и частота живорождений (35,5% против 52,0%) были значительно ниже, чем у остальных пациенток.
Слайд 16Индивидуализированная поддержка прогестероном на момент эмбриотрансфера – Alvarez et al.
Вопрос исследования:
Индивидуализированная поддержка прогестероном на момент эмбриотрансфера – Alvarez et al.
Вопрос исследования:

Улучшает ли индивидуальная поддержка лютеиновой фазы (iLPS) в соответствии с уровнем прогестерона в сыворотке за день до переноса эуплоидных замороженных эмбрионов (FET) исходы беременности, при условии старта iLPS за день до переноса эмбрионов?
Краткий вывод:
Пациенты с низким уровнем P в сыворотке за день до эуплоидного FET могут получить пользу от добавления ежедневных подкожных инъекций P , при старте за день до FET, и достичь репродуктивных результатов, аналогичных группе, у которой наблюдался исходный адекватный уровень P.
Более широкое значение результатов:
Исследование предоставило информацию об ``окне возможностей '' для улучшения показателей продолжающейся беременности и частоты выкидышей посредством ежедневной п/к инъекций в случаях недостаточного уровня P за день до криоЭТ (P <10,6 нг / мл) и восстановления значения на день криоЭТ (P> 10,6 нг / мл). Учитывались только эуплоидные криоЭT при ЗГТ, что позволило избежать одной из основных причин выкидыша и неудачной имплантации и преодолеть мешающие факторы, такие как женский возраст, качество эмбриона или протоколы стимуляции яичников.
Слайд 17Индивидуализированная поддержка прогестероном на момент эмбриотрансфера – Alvarez et al.
Дизайн, размер,
Индивидуализированная поддержка прогестероном на момент эмбриотрансфера – Alvarez et al.
Дизайн, размер,

Проспективное обсервационное исследование было проведено вв период с ноября 2018 г. по январь 2020 г. с участием пациентов, которым проводилась ПГТ по поводу анеуплоидий (ПГТ-А), циклы ЭКО и последующие ЭКО на фоне заместительной гормональной терапии (ЗГТ). Всего было проанализировано 574 цикла (453 пациента): 348 циклов (из них 342 завершились эуплоидным криоЭТ) с адекватным P в день, предшествующий криоЭТ, и 226 циклов (из них 220 завершились эуплоидным криоЭТ) при условии iLPS после низкого P на день предшествующий криоЭТ и восстановленного уровня P на день переноса.
Участники / материалы, постановка, методы.
Всего было включено 574 цикла ЗГТ-криоЭТ (453 пациента). Для подготовки эндометрия использовалась стандартная ЗГТ. Уровни P были измерены за день до эуплоидного криоЭТ. Уровень P> 10,6 нг / мл считался адекватным, и на следующий день выполняли эуплоидный FET (группа 1 криоЭТ). При уровне P <10,6 нг/мл, который был расценен как низкий, была начата iLPS в виде ежедневных инъекций прогестерона подкожно, и на следующий день был проведен новый анализ P. КриоЭТ проводился только в тот день, когда был достигнут восстановленный уровень P>10,6 нг / мл (98,2% случаев) (группа криоЭТ 2).
Основные результаты и роль шанса.
Демографические данные пациента и параметры цикла были сопоставимы между обеими группами эуплоидных криоЭТ (группа 1 и группа 2) с точки зрения возраста, веса, уровней эстрадиола и P, и количества перенесенных эмбрионов. Не было обнаружено статистически значимых различий в отношении частоты клинической беременности (56,4% против 59,1%: разница частоты (RD) -2,7%, 95% ДИ [-11,4; 6,0]), частоты продолжающейся беременности (49,4% против 53,6%: RD -4,2%, 95% ДИ [-13,1; 4,7]) или коэффициент живорождения (49,1% против 52,3%: RD -3,2%, 95% ДИ [-12; 5,7]). Также не было обнаружено значительных различий в отношении частоты выкидышей (12,4% против 9,2%: RD 3,2%, 95% ДИ [-4,3; 10,7]).
Ограничения, причины для осторожности:
Оценивалась только iLPS в виде ежедневных подкожных иньекций прогестерона. Время для инъекции не было запротоколировано. После наступления беременности определение уровня P в сыворотке не проводилось.
Слайд 18Результат исследования – при индивидуализированной поддержке прогестероном нет достоверных различий в исходе
Результат исследования – при индивидуализированной поддержке прогестероном нет достоверных различий в исходе

Частота наступления клинической беременности
Слайд 19Индивидуализированная поддержка прогестероном на момент эмбриотрансфера – Labarta et al.
Цель: проанализировать
Индивидуализированная поддержка прогестероном на момент эмбриотрансфера – Labarta et al.
Цель: проанализировать

Вывод(ы): Индивидуализированная поддержка лютеиновой фазы для пациентов с низким уровнем P в сыворотке приводит к достижению LBR, аналогичному у пациентов с адекватным уровнем P в сыворотке.
Слайд 20Индивидуализированная поддержка прогестероном на момент эмбриотрансфера – Labarta et al.
Дизайн: ретроспективное
Индивидуализированная поддержка прогестероном на момент эмбриотрансфера – Labarta et al.
Дизайн: ретроспективное

Пациенты: Всего было проанализировано 2275 пациентов, проверенных на уровень P в сыворотке крови в день переноса бластоцисты. В течение периода исследования у 1299 пациентов уровень P в сыворотке был ≥9,2 нг / мл, тогда как у 550 пациентов уровень P в сыворотке был <9,2 нг / мл, и они получили iLPS. Кроме того, для сравнения использовалась историческая группа из 426 пациентов с уровнями P в сыворотке <9,2 нг / мл, но без iLPS. Включенные в исследование пациентки были в возрасте ≤50 лет с адекватной морфологией эндометрия после приема эстрогенов. Всем женщинам была предоставлена поддержка лютеиновой фазы с помощью микронизированного вагинального P (MVP). Пациентки с индивидуальным началом экзогенного P согласно тесту на рецептивность эндометрия, а также с диагностированными полипами, миомами, деформирующими полость, или гидросальпинксом не были включены в анализ.
Вмешательство: В качестве рутинной практики с декабря 2018 года пациенты с низким уровнем P в сыворотке получали iLPS с ежедневной инъекцией 25 мг подкожного P со дня переноса эмбриона (ET) в дополнение к стандартному LPS (400 мг микронизированного вагинального прогестерона дважды в день).
Основное измерение результата: коэффициент живорождения (LBR).
Результат(ы): LBR составлял 44,9% в случаях iLPS по сравнению с 45,0% у пациентов с нормальным уровнем P в сыворотке (грубое отношение шансов [OR], 1,0; 95% доверительный интервал [CI], 0,82–1,22). По результатам регрессионного анализа, низкие уровни прогестерона в сыворотке не повлияли на LBR после поправки на возможные искажающие факторы (возраст, происхождение ооцита, свежий или криоЭТ, день ЭТ, качество эмбриона, количество перенесенных эмбрионов) (скорректированный OR, 0,99; 95% ДИ 0,79-1,25). Аналогичным образом не наблюдалось различий в других исходах беременности между группами. LBR был значительно выше в группе пациентов, получавших дополнительный подкожный P (iLPS), по сравнению с исторической группой с низким уровнем P в сыворотке и без iLPS (44,9% против 37,3%; OR 1,37; 95% CI, 1,06-1,78. ). В общей популяции пациенты с уровнем P <9,2 нг / мл на день ЭТ были немного моложе, имели более высокий индекс массы тела и более низкие уровни эстрадиола и P во время фазы пролиферации по сравнению с пациентами с уровнями P ≥9,2 нг / мл. Никаких различий не наблюдалось в отношении времени между крайней дозой микронизированного прогестерона и определением сывороточного прогестерона. После многомерного логистического регрессионного анализа только индекс массы тела и уровни эстрадиола в пролиферативной фазе были статистически значимыми. Значительные различия в LBR наблюдались между пациентами с уровнями P в сыворотке <9,2 нг / мл без iLPS и пациентами с уровнями P в сыворотке ≥9,2 нг / мл при использовании как собственных, так и донорских ооцитов.
Слайд 21Гормональный мониторинг. ESHRE guidelines
Повышает ли добавление гормональной оценки (эстрадиол/прогестерон/ЛГ) к ультразвуковому мониторингу
Гормональный мониторинг. ESHRE guidelines
Повышает ли добавление гормональной оценки (эстрадиол/прогестерон/ЛГ) к ультразвуковому мониторингу

Добавление измерения эстрадиола к ультразвуковому мониторингу, вероятно, не рекомендуется. (Kwan et al., 2014)
Добавление гормональной панели, состоящей из комбинации измерений эстрадиола, прогестерона и ЛГ, к ультразвуковому мониторингу, вероятно, не рекомендуется. (Golan et al., 1994; Wiser et al., 2012)
Слайд 22Мониторинг эстрадиола
За последние 8 лет - нет ни одного нового рандомизированного
Мониторинг эстрадиола
За последние 8 лет - нет ни одного нового рандомизированного

Cochrane review от 12 апреля 2021 обновление (предыдущая версия Kwan от 2014 года)- недостаточно данных для выводов об эффективности мониторинга эстрадиола.
Выбор того или иного метода может зависеть от удобства его использования и связанных с этим затрат. (Kwan et al. 2021)
Слайд 23Мониторинг эстрадиола.
Ретроспективные исследования
По сравнению с циклами со снижением сывороточного эстрадиола (СЭ)
Мониторинг эстрадиола.
Ретроспективные исследования
По сравнению с циклами со снижением сывороточного эстрадиола (СЭ)

Вывод: самопроизвольное снижение уровня СЭ неблагоприятно повлияло на результаты ЭКО с линейной корреляцией между процентным снижением и количеством извлеченных ооцитов. Снижение СЭ может повторяться в последующих циклах.
Grin L, Berkovitz-Shperling R, Zohav E, Namazov A, Leyetes S, Friedler S. Do spontaneously decreasing estradiol levels prior to triggering of ovulation adversely impact in vitro fertilization outcomes? Clin Exp Reprod Med. 2020 Sep;47(3):213-220. doi: 10.5653/cerm.2019.03419. Epub 2020 Aug 11. PMID: 32777872; PMCID: PMC7482948.
Слайд 24Мониторинг эстрадиола
Ретроспективные исследования
Частота клинической беременности была самой высокой у пациенток с отношением
Мониторинг эстрадиола
Ретроспективные исследования
Частота клинической беременности была самой высокой у пациенток с отношением

В то время как отношение шансов (OR) для клинической беременности, где EOR = 250–750 против EOR > 1500, составляло 3,4 (p < 0,001; 95 % ДИ 2,67–4,34), не наблюдалось статистически значимой корреляции в отношении оплодотворения, частоты дробления или количество эмбрионов хорошего качества в зависимости от EOR.
Serum estradiol: oocyte ratio as a predictor of reproductive outcome: an analysis of data from> 9000 IVF cycles in the Republic of Ireland DA Vaughan, C Harrity, ES Sills, EV Mocanu - Journal of assisted reproduction and genetics, 2016
Слайд 25Эстрадиол и его рецепторы (ER). Новые перспективы
Исследование Liu et al. 2017 показало,
Эстрадиол и его рецепторы (ER). Новые перспективы
Исследование Liu et al. 2017 показало,

ЛГ, наоборот, снижает уровни ERα и ERβ как in vivo, так и in vitro, как и ФСГ in vitro, что, в свою очередь, снижает уровни NPPC/NPR2 и cGMP, тем самым запуская гидролиз цАМФ с помощью PDE3A, и ооцит возобновляет мейоз.
Liu, W., Xin, Q., Wang, X. et al. Estrogen receptors in granulosa cells govern meiotic resumption of pre-ovulatory oocytes in mammals. Cell Death Dis 8, e2662 (2017). https://doi.org/10.1038/cddis.2017.82
Слайд 26Эстрадиол и его рецепторы (ER). Новые перспективы
Исследование Liu 2017 определило потенциальную роль
Эстрадиол и его рецепторы (ER). Новые перспективы
Исследование Liu 2017 определило потенциальную роль

Результаты исследования показали, что гонадотропины индуцируют созревание ооцитов за счет снижения уровня натрийуретического пептида и рецептора к нему NPPC/NPR2, контролируемых эстрадиоловыми рецепторами (ER), у мышей. Более того, авторы обнаружили, что взаимодействие E2-ER также контролируют экспрессию натрийуретического пептида и его рецепторов NPPC и NPR2 (NPPC/NPR2), а LH снижает уровни ER в человеческих пристеночных гранулёзных клетках.
Принимая во внимание предыдущие сообщения о том, что пик ЛГ/ХГЧ перед овуляцией снижает секрецию NPPC в фолликулярной жидкости человека, авторы предположили, что система E2-ERs может также контролировать возобновление мейоза ооцитов человека в ответ на стимуляцию гонадотропинами путем регулирования уровней NPPC и NPR2. Это может обеспечить новый подход к лечению IVM ооцитов в клинической практике.
Слайд 27Роль ЛГ
Ооциты и клетки кумулюса не имеют собственных рецепторов к ЛГ, овуляция
Роль ЛГ
Ооциты и клетки кумулюса не имеют собственных рецепторов к ЛГ, овуляция

Пик ЛГ влияет на Hippo сигнальные пути в гранулёзных клетках, которые вовлечены в синтез и выброс молекул, воздействующих паракринно на ооцит и клетки кумулюса.
Godin, P., Tsoi, M.F., Morin, M. et al. The granulosa cell response to luteinizing hormone is partly mediated by YAP1-dependent induction of amphiregulin. Cell Commun Signal 20, 72 (2022). https://doi.org/10.1186/s12964-022-00843-
Слайд 28Мониторинг ЛГ
Мониторинг ЛГ для принятия решения о назначении антагонистов во время КОС
Мониторинг ЛГ
Мониторинг ЛГ для принятия решения о назначении антагонистов во время КОС

Повышение уровня ЛГ было ассоциировано со снижением количества полученных ооцитов в протоколе КОС (Zhang W, Reprod Biol Endocrinol , 2022)
Прогестин-прайминг протокол был ассоциирован с более низкой частотой преждевременного пика ЛГ в группе со сниженным овариальным резервом. (Guan et al. Front. Endocrinol. 2021)
Слайд 29Вопросы для будущих дискуссий
Есть ли сейчас в клинической практике адекватные маркеры-предикторы качества
Вопросы для будущих дискуссий
Есть ли сейчас в клинической практике адекватные маркеры-предикторы качества

Стоит ли фокусироваться на тактике определения группы риска фолликулов с нарушенным ответом гранулезных клеток?
Стоит ли больше ориентироваться на результаты предыдущего цикла для предикции качества эмбрионов нежели на гормональный мониторинг?
Влияет ли количество предыдущих циклов стимуляции овуляции и их тип на качество яйцеклеток?
 The anatomy of the thyroid
The anatomy of the thyroid Менструальный цикл
Менструальный цикл Профилактика табакокурения
Профилактика табакокурения 21 февраля - День фельдшера
21 февраля - День фельдшера Бронхиальная астма
Бронхиальная астма Моё призвание – медицина
Моё призвание – медицина Значение анатомо-физиологических особенностей детского организма при организации ухода за детьми
Значение анатомо-физиологических особенностей детского организма при организации ухода за детьми Причины возникновения нарушений речи
Причины возникновения нарушений речи Общие принципы лечения лучевых поражений
Общие принципы лечения лучевых поражений Пиогенные кокки. (Лекция 8)
Пиогенные кокки. (Лекция 8) ЧМТ. Классификация. Патогенез
ЧМТ. Классификация. Патогенез История развития нейрохирургии
История развития нейрохирургии Эпидемический паротит
Эпидемический паротит Внутренние среды организма. Кровь
Внутренние среды организма. Кровь Пневмония. Виды пневмонии
Пневмония. Виды пневмонии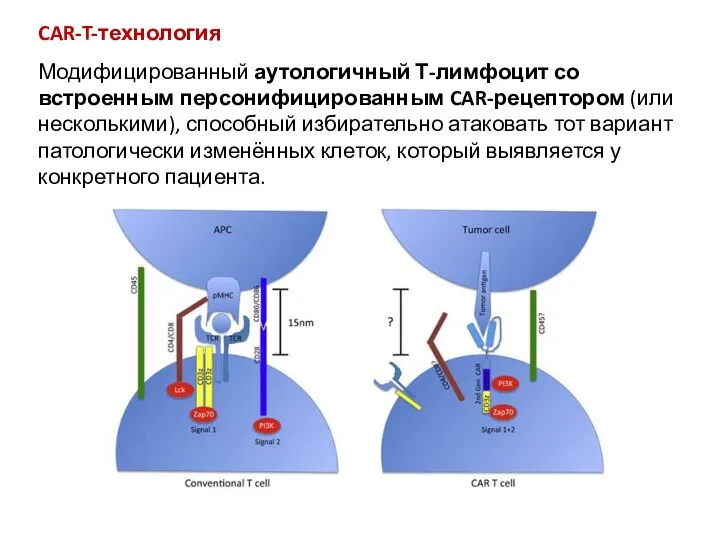 CAR-T-технология
CAR-T-технология Потребности пациента
Потребности пациента Организмге механикалық жайттардың зақымдаушы әсері
Организмге механикалық жайттардың зақымдаушы әсері Антигиперурекимические средства
Антигиперурекимические средства Основы больничной гигиены
Основы больничной гигиены Как подготовить иммунитет ребенка к детскому саду
Как подготовить иммунитет ребенка к детскому саду Лекция2ПринцЛечНелин
Лекция2ПринцЛечНелин Нарушения углеводного обмена
Нарушения углеводного обмена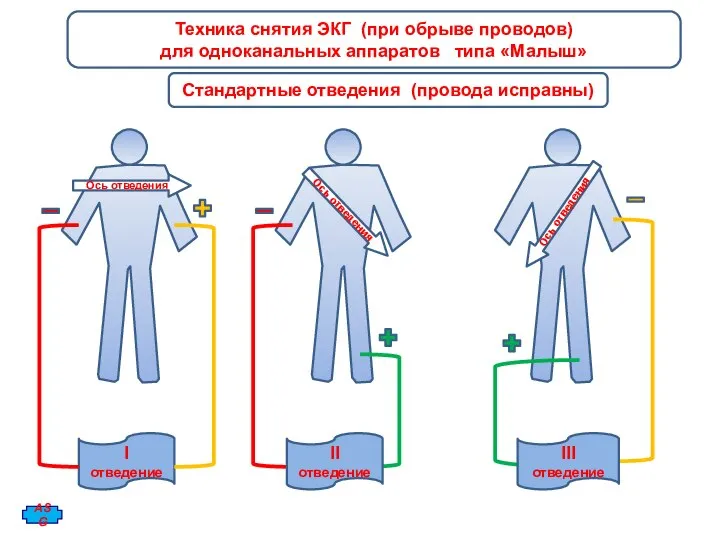 Техника снятия ЭКГ (при обрыве проводов) для одноканальных аппаратов типа Малыш
Техника снятия ЭКГ (при обрыве проводов) для одноканальных аппаратов типа Малыш Речь как функция мозга
Речь как функция мозга Противотуберкулезные препараты
Противотуберкулезные препараты Профилактика нарушения зрения у детей
Профилактика нарушения зрения у детей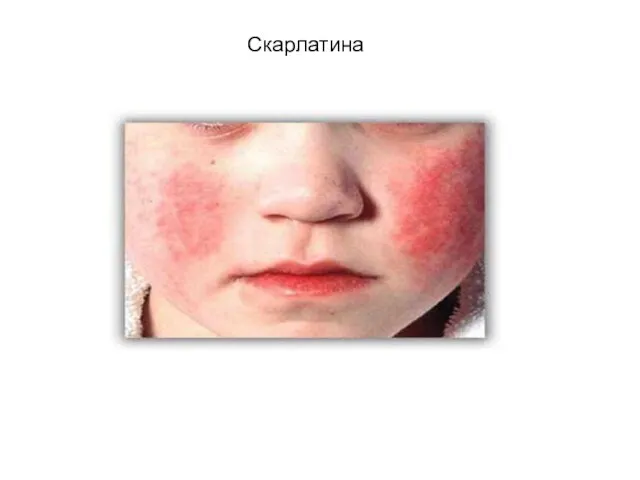 Детские инфекции
Детские инфекции