Содержание
- 2. Химические реакции - это процессы, в результате которых из одних веществ образуются другие, отличающиеся от них
- 3. Классификация По числу и составу реагирующих веществ По изменению степени окисления химических элементов, образующих вещества По
- 4. По числу и составу реагирующих веществ Реакции, идущие без изменения состава веществ Реакции, идущие с изменением
- 5. По изменению степени окисления Окислительно-восстановительные Реакции, идущие без изменения степеней окисления химических элементов
- 6. По тепловому эффекту Экзотермические Эндотермические
- 7. По агрегатному состоянию реагирующих веществ Гомогенные Гетерогенные
- 8. По участию катализатора Каталитические Некаталитические
- 9. По направлению Необратимые Обратимые
- 10. Получение аллотропных модификаций C (графит) C (алмаз)
- 11. С изменением состава Соединения Разложения Замещения Обмена
- 12. Реакции соединения – из двух и более веществ образуется одно более сложное 2H2 + O2 2H2O
- 13. Реакции разложения – из одного вещества образуется два и более 2HgO 2Hg + O2 2KNO3 2KNO2
- 14. Реакции замещения – атомы простого вещества замещают атомы в сложном веществе Mg + 2HCl MgCl2 +
- 15. Реакции обмена – вещества обмениваются своими составными частями CO2+Ca(OH)2 CaCO3 +H2O K2S + 2HCl H2S +
- 16. Окислительно-восстановительные реакции 0 0 +4 -2 C + O2 CO2 0 +4 C – 4e C
- 17. Реакции протекающие без изменения степени окисления + -2 + -2 + -2 + Li2O + H2O
- 18. Экзотермические - реакции протекающие с выделением теплоты 4P + 5O2 2P2O5 + Q CH4+2O2 CO2+2H2O +
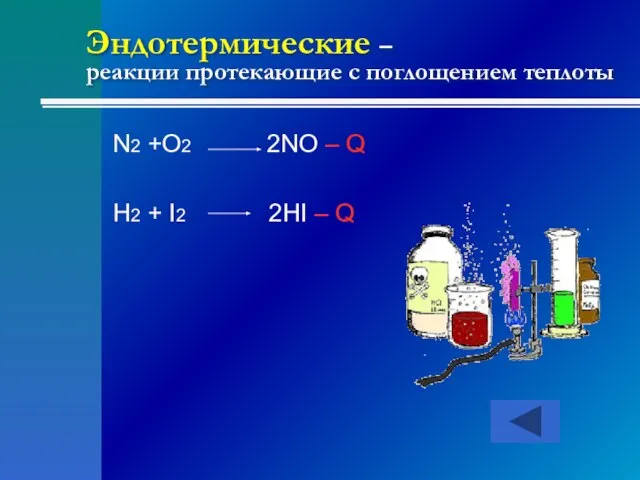
- 19. Эндотермические – реакции протекающие с поглощением теплоты N2 +O2 2NO – Q H2 + I2 2HI
- 20. Гомогенные – реакции в которых исходные вещества и продукты реакции находятся в одном агрегатном состоянии H2
- 21. Гетерогенные - реакции в которых исходные вещества и продукты реакции находятся в разных агрегатных состояниях Ca(т)
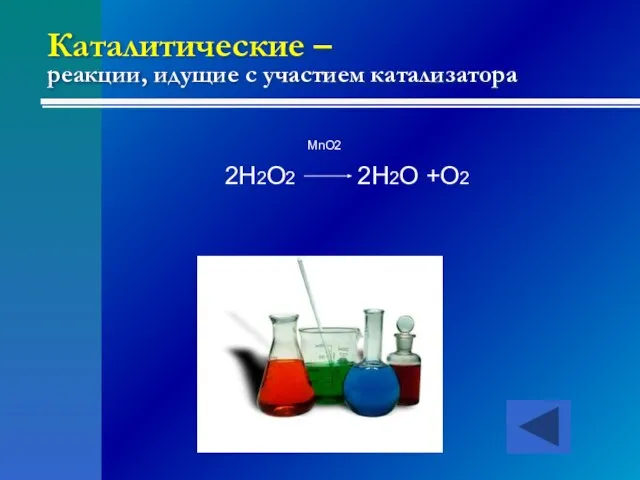
- 22. Каталитические – реакции, идущие с участием катализатора MnO2 2H2O2 2H2O +O2
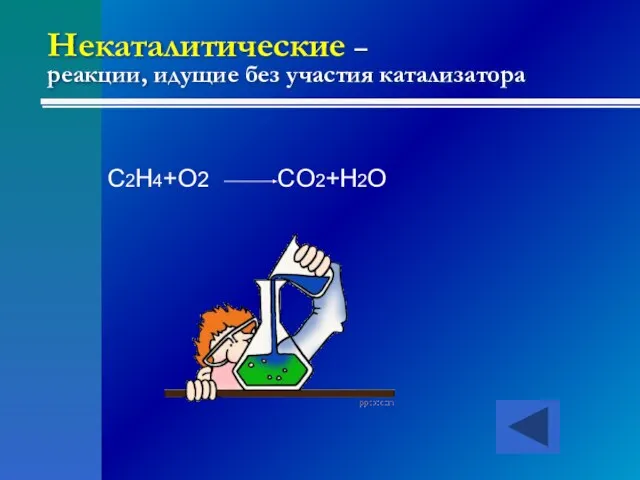
- 23. Некаталитические – реакции, идущие без участия катализатора C2H4+O2 CO2+H2O
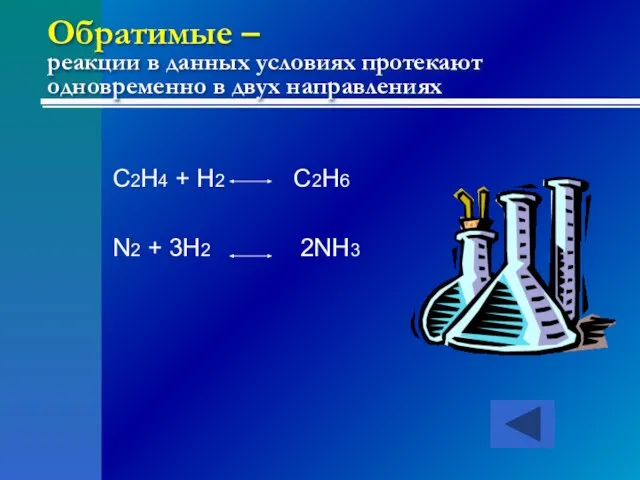
- 24. Обратимые – реакции в данных условиях протекают одновременно в двух направлениях C2H4 + H2 C2H6 N2
- 25. Необратимые – реакции в данных условиях протекают только в одном направлении H2SO4+BaCl2 BaSO4 + 2HCl 2Na+2H2O
- 26. Составим характеристику процесса синтеза аммиака 0 0 Fe – 3 + N2 (г) + 3H2 (г)
- 28. Скачать презентацию





















 Личность как предмет изучения
Личность как предмет изучения «1С-Рейтинг:Микрокредитная организация»
«1С-Рейтинг:Микрокредитная организация» Создание сводного электронного каталога "Книжные памятники Архангельской области": итоги и перспективы
Создание сводного электронного каталога "Книжные памятники Архангельской области": итоги и перспективы Линейная функция
Линейная функция Финансирование инновационной деятельности. Финансовые инновации в современной России
Финансирование инновационной деятельности. Финансовые инновации в современной России Анализируем художественный текст
Анализируем художественный текст Правоохранительные органы РФ
Правоохранительные органы РФ Желтый блокнот. Что такое проект? Пять П проекта
Желтый блокнот. Что такое проект? Пять П проекта Одежда и украшения. Вторая половина XIX века
Одежда и украшения. Вторая половина XIX века Организаторское поведение
Организаторское поведение Боеприпасы. Взрыватели и трубки
Боеприпасы. Взрыватели и трубки Математика для малышей
Математика для малышей Условия жизни разных народов
Условия жизни разных народов КИСЕЛЕ КИШЕ
КИСЕЛЕ КИШЕ Calculate your visit
Calculate your visit Анатомия класса. Схожесть с др. языками
Анатомия класса. Схожесть с др. языками Электронное телевидение
Электронное телевидение Круговорот воды в природе
Круговорот воды в природе Страхи в младшем школьном возрасте
Страхи в младшем школьном возрасте Русская армия в 18 веке и её знаменитые полководцы
Русская армия в 18 веке и её знаменитые полководцы Управление информационными ресурсами
Управление информационными ресурсами Свойства площадей. Площадь прямоугольника. Площадь параллелограмма
Свойства площадей. Площадь прямоугольника. Площадь параллелограмма Контрперенос и принципы работы бессознательного
Контрперенос и принципы работы бессознательного Упрощенный рассказ о моде. Часть 1. Платья и под ними. Ампир
Упрощенный рассказ о моде. Часть 1. Платья и под ними. Ампир Пищеварительная система у позвоночных животных
Пищеварительная система у позвоночных животных Что такое космогрядка
Что такое космогрядка Символика калужской области
Символика калужской области Презентация на тему Строение и функции пищеварительной системы
Презентация на тему Строение и функции пищеварительной системы