Содержание
- 2. План Идеальные газы Распределение Больцмана Распределение Максвелла Одноатомный идеальный газ Двухатомный идеальный газ Многоатомный идеальный газ
- 3. Идеальные газы Идеальный газ – газ, взаимодействие между частицами которого пренебрежимо слабое взаимодействие на любых расстояниях
- 4. Распределение Больцмана . Вероятность молекуле идеального газа находится в некотором квантовом состоянии, т.е. число молекул в
- 5. Распределение Больцмана как следствие большого канонического распределения Силового взаимодействия нет. У молекул могут быть только обменные
- 6. Распределение Больцмана как следствие большого канонического распределения Среднее число частиц на уровне для идеального газа Статистическая
- 7. H-теорема Больцмана Утверждает, что в состоянии равновесия энтропия идеального газа должна иметь максимальное значение Покажем, что
- 8. Энтропия неравновесного идеального газа и распределение Больцмана Классическая статистика:
- 9. Энтропия неравновесного идеального газа и распределение Больцмана В равновесии выполняется первое начало термодинамики Тогда при условиях
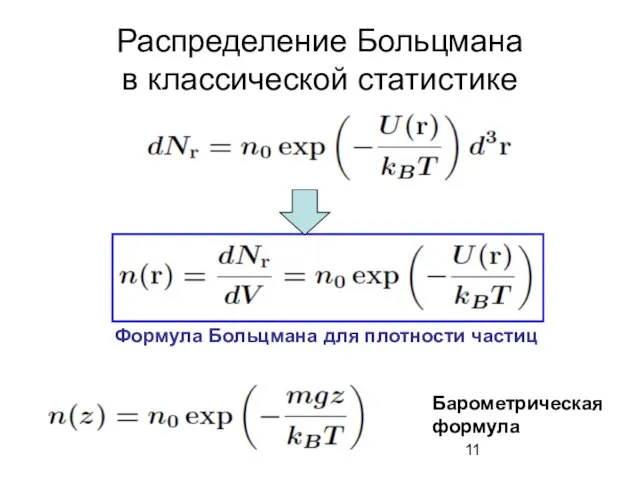
- 10. Распределение Больцмана в классической статистике Распределение по квантовым состояниям нужно заменить на распределение молекул по фазовому
- 11. Распределение Больцмана в классической статистике Формула Больцмана для плотности частиц Барометрическая формула
- 12. Распределение Максвелла-Больцмана Энергию молекулы всегда можно разделить на 2 части а поэтому можно рассматривать отдельно распределение
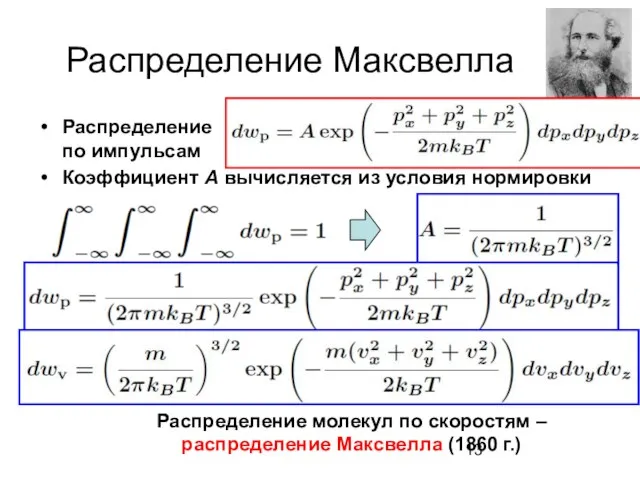
- 13. Распределение Максвелла . Распределение по импульсам Коэффициент А вычисляется из условия нормировки Распределение молекул по скоростям
- 14. Закон равнораспределения энергии Среднее значение скорости Средний квадрат скорости На каждую квадратичную степень свободы приходится энергия
- 15. Свободная энергия идеального газа Поскольку частицы, по сути, распределены по уровням энергии молекулы, а не по
- 16. Свободная энергия идеального газа Молекула имеет поступательные классические степени свободы и квантовые состояния: Тогда свободная энергия
- 17. Уравнение состояния идеального газа С помощью свободной энергии можно вычислить например, давление газа Уравнение состояние любого
- 18. Энергия и теплоемкость идеального газа Энергия газа, как и его энтальпия, является функцией только температуры (из-за
- 19. Закон равнораспределения в классической статистике В молекуле атомы совершают малые колебания, поэтому потенциальная энергия их взаимодействия
- 20. Закон равнораспределения в классической статистике В формуле для свободной энергии уберем температуру в подынтегральном выражении заменой
- 21. Закон равнораспределения в классической статистике Тогда На каждую переменную равная доля энергии kT/2
- 22. Распределение молекул по энергии в классической статистике Объем фазового пространства Явную зависимость от ε получаем заменой
- 23. Одноатомный идеальный газ Статистическая сумма в свободной энергии необходима для расчета внутренней структуры молекул идеального газа
- 24. Теплоемкость одноатомного газа Итак, свободная энергия Тогда энтропия газа равна Внутренняя энергия Теплоемкость Отметим, что теплоемкость
- 25. Атомы с тонкой структурой В этом случае атомы обладают вырожденными энергетическими уровнями. Вырождение равно (2S+1), если
- 26. Применимость статистики Больцмана Условие применимости следует из малости чисел что точно выполняется для всех уровней, если
- 27. Двухатомный идеальный газ Двухатомный газ имеет смысл рассматривать только при температурах, малых по сравнению с энергией
- 28. Энергия идеального газа
- 29. Свободная энергия Статистическая сумма равна
- 30. Свободная энергия Свободная энергия поступательная колебательная вращательная электронная
- 31. Колебательное движение Ранее уже было вычислено, что для спектра статистическая сумма равна Свободная энергия позволяет вычислить
- 32. Колебательное движение При высоких температурах С osc T квантовая классическая NkT/2 на степени свободы кинетической энергии
- 33. Вращательное движение Двухатомная молекула 2 различных атома 2 одинаковых атома (перестановка ядер не изменяет состояние!). Примером
- 34. Одинаковые . атомы . Водород Н2 ортоводород – состояния с большим ядерным стат. весом (кратность вырождения
- 35. Вращательное движение для различных атомов Низкие температуры В статистической сумме одной частицы можно оставить только два
- 36. Вращательное движение для различных атомов Высокие температуры В статистической сумме нужно учитывать очень много слагаемых, что
- 37. Вращательное движение для различных атомов NkT/2 на первую вращательную степень свободы NkT/2 на вторую вращательную степень
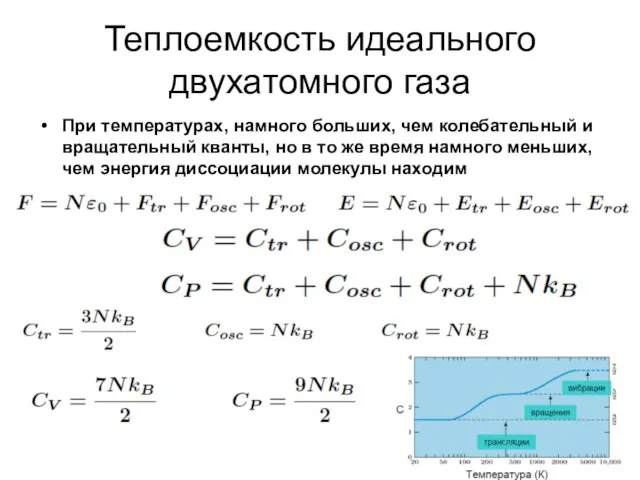
- 38. Теплоемкость идеального двухатомного газа При температурах, намного больших, чем колебательный и вращательный кванты, но в то
- 40. Скачать презентацию


































 Праведный по вере
Праведный по вере Пьер и Мария кюри
Пьер и Мария кюри Игра волейбол (5-6 класс)
Игра волейбол (5-6 класс) Загадки «Лингвистических сказочек»
Загадки «Лингвистических сказочек» «КОМПЬЮТЕРНОЕ РИСОВАНИЕ»
«КОМПЬЮТЕРНОЕ РИСОВАНИЕ» Формирование приёмов умственной деятельности учащихся Психолого-педагогический семинар
Формирование приёмов умственной деятельности учащихся Психолого-педагогический семинар Презентация на тему По декоративно-прикладному искусству
Презентация на тему По декоративно-прикладному искусству  Презентация на тему Угадай мелодию
Презентация на тему Угадай мелодию Презентация на тему Использование приемов деятельностного метода обучения в написании сочинения-рассуждения
Презентация на тему Использование приемов деятельностного метода обучения в написании сочинения-рассуждения Строение и работа сердца 8 класс
Строение и работа сердца 8 класс Презентация на тему Заповедники и национальные парки России
Презентация на тему Заповедники и национальные парки России Страшное слово - СПИД
Страшное слово - СПИД Особенности интернет-маркетинга в автобизнесе
Особенности интернет-маркетинга в автобизнесе Введение в управление персоналом
Введение в управление персоналом Интервью.
Интервью. Лекция 5. Транспортные задачии задачи о назначениях
Лекция 5. Транспортные задачии задачи о назначениях Разведение овец
Разведение овец Малый проект
Малый проект Гамбург – Берн – Рим
Гамбург – Берн – Рим Крестьянская война под предводительством Е.И.Пугачева
Крестьянская война под предводительством Е.И.Пугачева Гробницы Египта.
Гробницы Египта. Презентация на тему Климат России
Презентация на тему Климат России Центр сопровождения проектов "Открытие"
Центр сопровождения проектов "Открытие" 152-ФЗ:Соблюдать нельзя игнорировать
152-ФЗ:Соблюдать нельзя игнорировать Коррупция в системе государственной службы
Коррупция в системе государственной службы Микропроцессорные устройства
Микропроцессорные устройства Руководство и лидерство
Руководство и лидерство Программирование на языке VBA
Программирование на языке VBA