Содержание
- 2. При изучении термодинамических процессов определяются: 1) закономерность изменения параметров состояния рабочего тела, то есть выводится уравнение
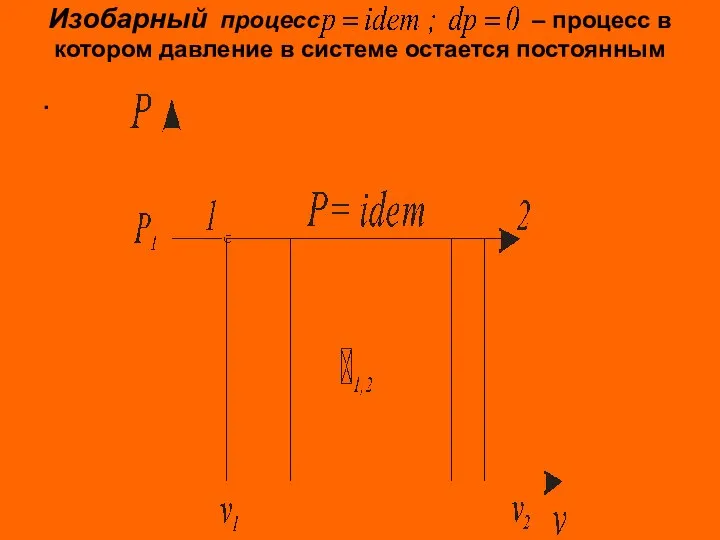
- 3. Изобарный процесс – процесс в котором давление в системе остается постоянным .
- 4. Изобарные процессы подвода или отвода теплоты происходят в поршневых двигателях внутреннего сгорания, газотурбинных, паросиловых, холодильных установках
- 5. Для идеального газа Количество теплоты, подведенной к рабочему телу или отведенной от него в изобарном процессе,
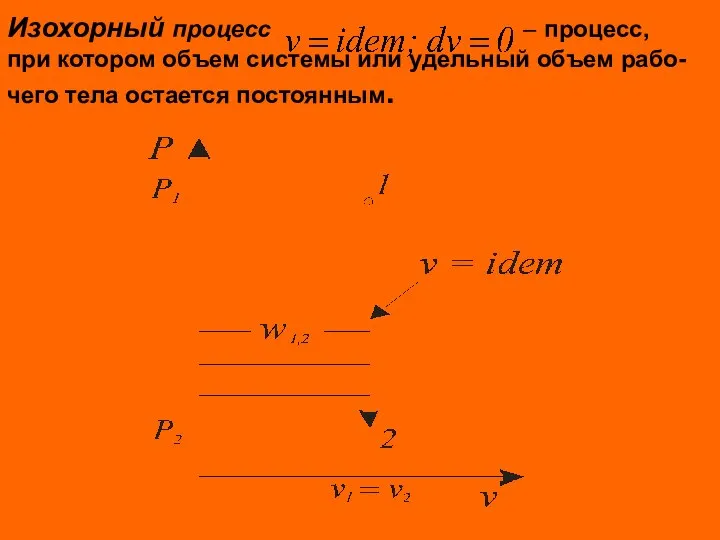
- 6. Изохорный процесс – процесс, при котором объем системы или удельный объем рабо- чего тела остается постоянным.
- 7. В изохорных процессах происходит увеличение или уменьшение давления, что связано с соответствен – ным изменением температуры
- 8. Удельная термодинамическая и потенциальная работы в изохорном процессе определяются из соотно- шений Для идеального газа Количество
- 9. Для идеального газа Изопотенциальный процесс – термодинамический процесс изменения состояния системы, при котором значение потенциальной функции
- 10. Для идеального газа, согласно уравнению Клапейрона изопотенциальный процесс является и изотермическим . Удельная термодинамическая и потенциальная
- 11. Нетрудно заметить, что постоянство приводит к условию Поэтому, в изопотенциальном процессе численные значения термодинамической и потенциальной
- 12. Для идеального газа pv=RT=idem (изотермический) Количество теплоты, подведенной к рабочему телу или отведенной от него в
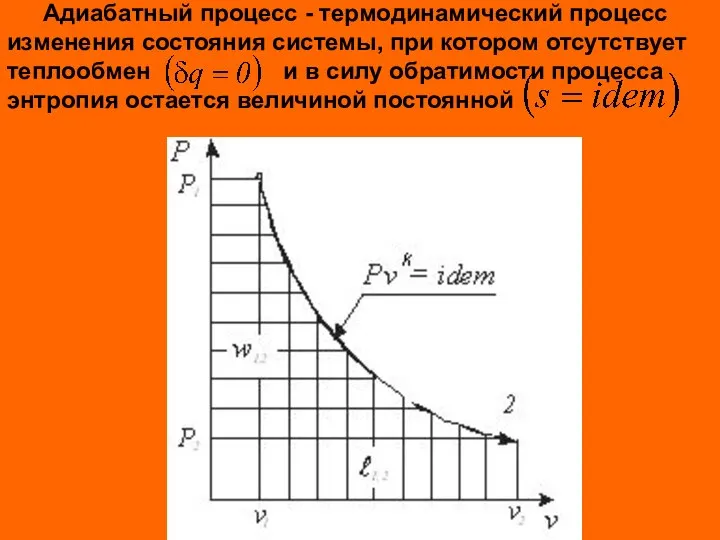
- 13. Адиабатный процесс - термодинамический процесс изменения состояния системы, при котором отсутствует теплообмен и в силу обратимости
- 14. Из выражения первого начала термодинамики для простого тела при условии имеем Отсюда следует выражение для показателя
- 15. После интегрирования при условия постоянства показателя процесса имеем Для идеального газа показатель адиабаты равен k= cp/cv
- 16. Из уравнения адиабатного процесса получим выражение для связи параметров состояния потенцируя имеем
- 17. Выражения конечных (интегральных) величин термодинамической и потенциальных работа в адиабат- ном процесс можно получить при сопоставлении
- 18. Интегрируя последнее выражение с учетом того, что k=idem, получим интегрального уравнения термодинамической работы Введем понятие характеристики
- 19. Окончательно имеем уравнения для определения термодинамической и потенциальной работы Различные уравнения для определения характе- ристики расширения
- 20. Применительно для идеального газа имеем:
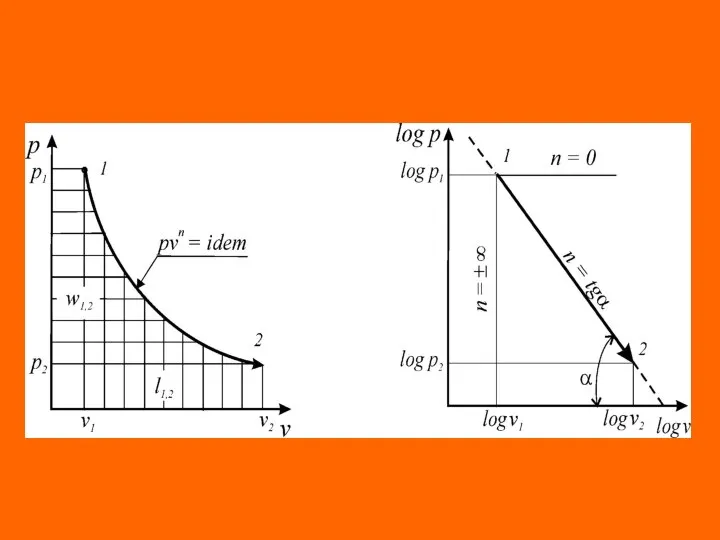
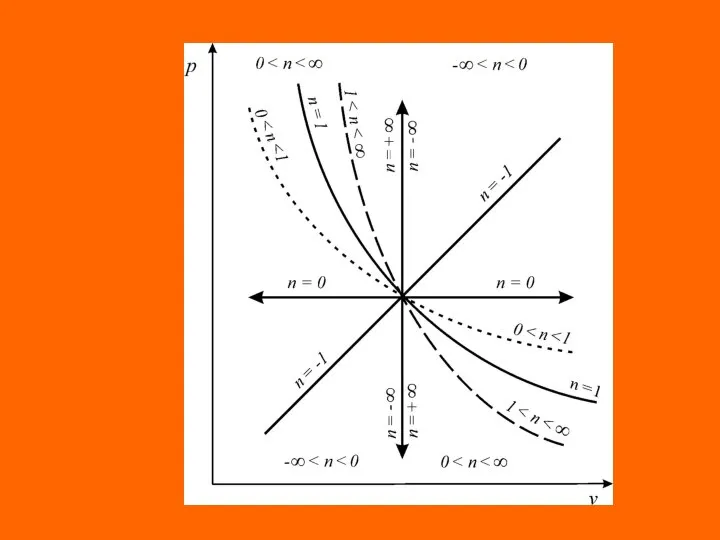
- 21. Уравнения перечисленных простейших и любых других термодинамических процессов могут быть представлены одним уравнением. Это уравнение назы-
- 22. где п – показатель политропы, являющий в рассматриваемом процессе постоянной величиной, которая может иметь любые частные
- 24. Это значит, что постоянный показатель политропы определяется соотношением потенциальной и термодинамической работ в элементарном или конечном
- 25. Из соотношения показателя политропи следует, что для изобарного процесса , для изохорного процесса nv = ±
- 26. Работа в политропных процессах Выражения конечных (интегральных) величин термодинамической и потенциальных работ в политро- пных процессах
- 27. Теплообмен в политропном процессе для простых тел выводится также на основе рассмотрения выражения первого начала термодинамики
- 28. Введем следующие обозначения: При этом выражение примет вид: Подставив полученное уравнение в выражение первого начала термодинамики
- 29. Для определения величин ( и ) рассмотрим два термодинамических процесса: Изоэнергетический процесс (u = idem, du
- 30. С учетом полученных соотношений для определения av и ap, находим выражения для расчета удельных значений изменения
- 33. Скачать презентацию

























 Презентация на тему Биография Нильса Бора
Презентация на тему Биография Нильса Бора  Викторина о физике
Викторина о физике Виды деформации в механике. Растяжение и сжатие
Виды деформации в механике. Растяжение и сжатие Свойства веществ
Свойства веществ Линзы. Оптические приборы. Практическая работа
Линзы. Оптические приборы. Практическая работа Квалификационная работа. Тема: Спроектировать сборочную оснастку для сборки воздушный тормоз орбитального корабля-ракетоплана
Квалификационная работа. Тема: Спроектировать сборочную оснастку для сборки воздушный тормоз орбитального корабля-ракетоплана Презентация по физике "Внутреннее устройство разных типов двигателей" -
Презентация по физике "Внутреннее устройство разных типов двигателей" -  Методы наблюдения и регистрации элементарных частиц
Методы наблюдения и регистрации элементарных частиц Презентация на тему Телевизор
Презентация на тему Телевизор  Закон сохранения энергии в механике
Закон сохранения энергии в механике Колебания. Колебательные системы
Колебания. Колебательные системы Технологии обработки металлов, выполняемые в ССХТ
Технологии обработки металлов, выполняемые в ССХТ Вклад советских учёных-физиков в Великую Победу
Вклад советских учёных-физиков в Великую Победу Электростатическое поле
Электростатическое поле Зависимость центростремительной силы от массы, радиуса и угловой скорости
Зависимость центростремительной силы от массы, радиуса и угловой скорости Звук. Определение
Звук. Определение Статистическая теория радиотехнических систем. Нормальный случайный процесс. (Лекция 7)
Статистическая теория радиотехнических систем. Нормальный случайный процесс. (Лекция 7) Закон Ома для участка цепи
Закон Ома для участка цепи Навозоудаление
Навозоудаление Причины изменения технического состояния автомобилей
Причины изменения технического состояния автомобилей Поляризация света
Поляризация света Магнитный поток
Магнитный поток Виды теплопередачи. Тепловые явления
Виды теплопередачи. Тепловые явления Введение. Принципы радио- и телевещания. Особенности антенно-фидерных устройств и РРВ. Лекция 1,2
Введение. Принципы радио- и телевещания. Особенности антенно-фидерных устройств и РРВ. Лекция 1,2 Двухмасовый маховик
Двухмасовый маховик Электрический ток в растворах и расплавах электролитов
Электрический ток в растворах и расплавах электролитов Бензиновый ДВС
Бензиновый ДВС Электромагнитное излучение
Электромагнитное излучение