Содержание
- 2. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Химическая термодинамика изучает взаимные переходы различных видов энергии при химических процессах (растворении, испарении,
- 3. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Первый закон термодинамики Энергия не исчезает и не возникает из ничего, а только
- 4. Интенсивные параметры – это параметры, которые не зависят от массы и размеров системы. Это температура, плотность,
- 5. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Первый закон ТД для закрытой системы: В изобарно-изотермических условиях, в которых функционируют живые
- 6. Современные формулировки ПЕРВОГО ЗАКОНА ТЕРМОДИНАМИКИ Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и
- 7. Энтальпия – это термодинамическая функция, характеризующая энергетическое состояние системы при изобарно-изотермических условиях. Теплота, полученная системой при
- 8. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Количество теплоты, которое выделяется или поглощается при проведении химических реакций в изобарно-изотермических условиях,
- 9. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Стандартные условия: n-количество вещества – 1 моль; P-давление – 760 мм рт.ст.=101325 Па;
- 10. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Например: Стандартная энтальпия сложного вещества равна энтальпии реакции получения 1 моль этого вещества
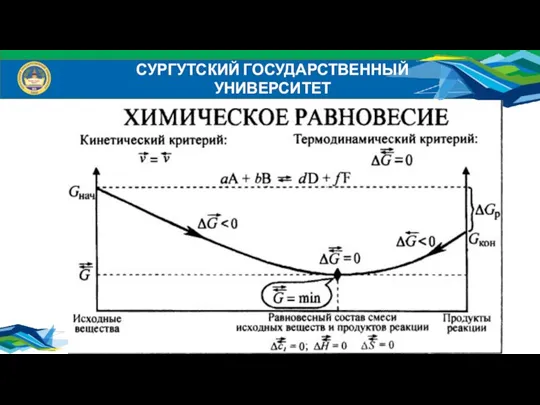
- 11. Закон Гесса (1840 г.) Тепловой эффект химической реакции при постоянном объеме или постоянном давлении не зависит
- 12. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Закон Гесса можно проиллюстрировать следующей схемой:
- 13. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Следствия из закона Гесса Следствие 1. Стандартная энтальпия химической реакции (тепловой эффект химической
- 14. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Например, рассчитаем энтальпию реакции получения мочевины в организме из аммиака и оксида углерода(IV):
- 15. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Следствие 2. Стандартная энтальпия химической реакции (тепловой эффект химической реакции) равна разности стандартных
- 16. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Закон Лавуазье-Лапласа (является следствием закона сохранения энергии) Тепловой эффект прямой реакции всегда равен
- 17. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Самопроизвольным (спонтанным) является процесс, который совершается без затраты работы извне и который уменьшает
- 18. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Изменение стандартной энтропии химической реакции определяется разностью алгебраических сумм стандартных энтропий продуктов реакции
- 19. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ΔG = ΔH - TΔS стандартные энергии Гиббса исходных веществ и продуктов реакции;
- 20. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Формулировки второго закона термодинамики Формулировка Клаузиуса (1850 г): теплота сама по себе не
- 21. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
- 22. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ где a, b, c, d – стехиометрические коэффициенты. Тогда энергия Гиббса химической реакции
- 23. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ где a, b, c, d – стехиометрические коэффициенты. Тогда энергия Гиббса химической реакции,
- 24. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Изохорный процесс Функция Гельмгольца: Если процесс протекает в растворе, то свободную энергию Гельмгольца
- 25. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
- 26. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Калориметрия (лат. Color – тепло и metro – измеряю) – это сово- купность
- 28. Скачать презентацию
























 Теория валентных связей
Теория валентных связей Исследование воздействия плазмы метана на свойства оксида графена
Исследование воздействия плазмы метана на свойства оксида графена Углеводороды: получение и свойства
Углеводороды: получение и свойства Атом- сложная частица
Атом- сложная частица Тренажер. Химические свойства солей
Тренажер. Химические свойства солей VVEDENIE_V_OGRANIChESKUYu_KhIMIYu
VVEDENIE_V_OGRANIChESKUYu_KhIMIYu Основания. 8 класс
Основания. 8 класс Электролиз растворов и расплавов
Электролиз растворов и расплавов Химическая картина мира. Предмет химии
Химическая картина мира. Предмет химии Контрольная работа
Контрольная работа Генетические ряды Fe2+ и Fе3+. Качественные реакции на Fе2+ и Fе3+
Генетические ряды Fe2+ и Fе3+. Качественные реакции на Fе2+ и Fе3+ Презентация на тему Всё об алюминии
Презентация на тему Всё об алюминии  Обобщение по теме Теория химического строения органических веществ
Обобщение по теме Теория химического строения органических веществ Химические свойства солей
Химические свойства солей Классификация веществ. Кислоты. Основания. Соли
Классификация веществ. Кислоты. Основания. Соли Изменение химмотологических свойств цетанповышающей присадки в процессе хранения
Изменение химмотологических свойств цетанповышающей присадки в процессе хранения Органическая химия как наука. Основные положения теории строения химических соединений. Структурная изомерия
Органическая химия как наука. Основные положения теории строения химических соединений. Структурная изомерия Презентация на тему Типы химических реакций на примере свойств воды
Презентация на тему Типы химических реакций на примере свойств воды  Л-1-4
Л-1-4 Презентация на тему Получение галогенов. Биологическое значение и применение галогенов
Презентация на тему Получение галогенов. Биологическое значение и применение галогенов  Санитарно-гигиенические показатели питьевой воды
Санитарно-гигиенические показатели питьевой воды Магний (Mg)
Магний (Mg) Физические и химические свойства алкенов
Физические и химические свойства алкенов Строение атома. Экзаменационные вопросы
Строение атома. Экзаменационные вопросы Responsible Aluminium Framework
Responsible Aluminium Framework Очистка поверхности медного сплава
Очистка поверхности медного сплава Алкины
Алкины Химические свойства и применение этилена
Химические свойства и применение этилена