Содержание
- 2. Количество металлов среди всех химических элементов
- 3. Расположение элементов – металлов в ПСХЭ: 1 группа главная подгруппа – щелочные металлы 2 группа главная
- 4. Большая часть металлов существует в природе в виде минеральных образований - руд Некоторые неактивные металлы существуют
- 5. Металлы – это химические элементы, атомы которых отдают электроны внешнего ( предвнешнего) электронного слоя, превращаясь в
- 6. Главные особенности элементов металлов. Число валентных электронов (1-3 ). Сравнительно большие радиусы атомов. Небольшие значения электроотрицательности
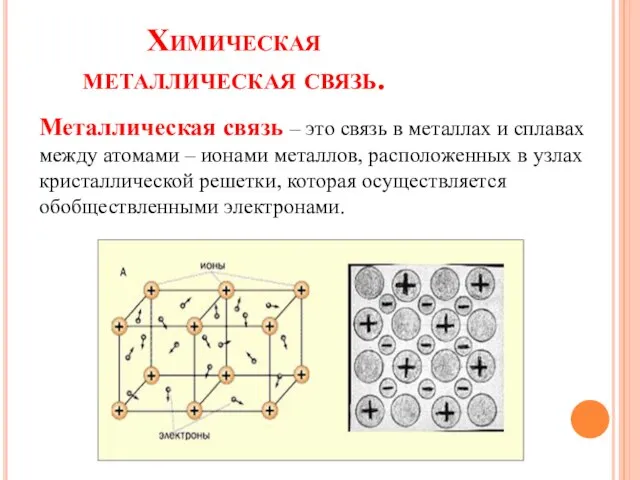
- 7. Химическая металлическая связь. Металлическая связь – это связь в металлах и сплавах между атомами – ионами
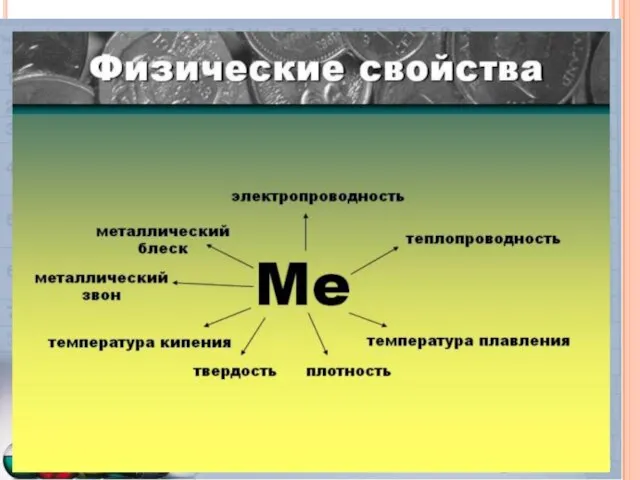
- 8. Металлы – простые вещества. Все металлы обладают общими физическими свойствами: Пластичность – смещение слоев ионов под
- 10. Взаимодействие металлов с галогенами o +2 -1 2Са + Н 2О → 2Сa(ОН) o +3 -1
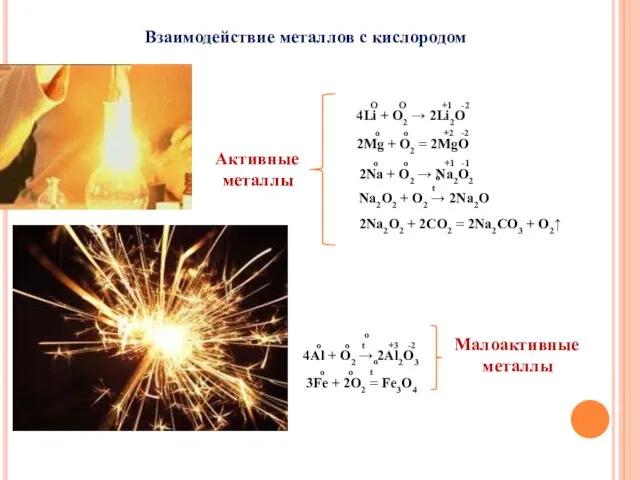
- 11. Взаимодействие металлов с кислородом Активные металлы O O +1 -2 4Li + O2 → 2Li2O o
- 12. o +1 -1 +2 -1 o Zn + 2HCl → ZnCl2 + H2 Взаимодействие металлов с
- 13. Химические свойства металлов 1. Все металлы проявляют только восстановительные свойства 2. Атомы металлов легко отдают электроны
- 14. Применение металлов
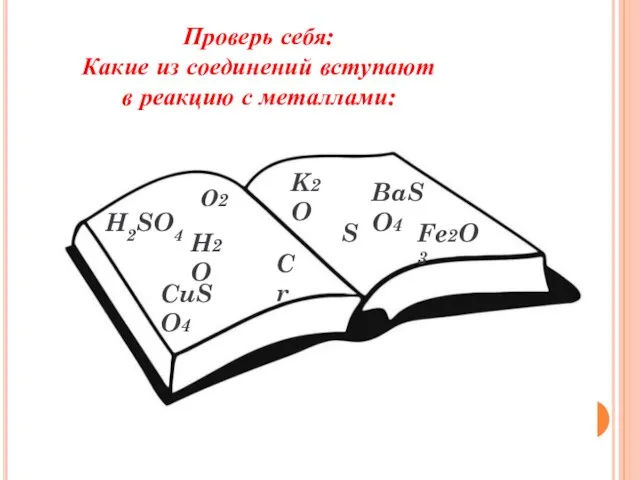
- 15. Проверь себя: Какие из соединений вступают в реакцию с металлами: О2 K2O CuSO4 H2O S BaSO4
- 17. Скачать презентацию










 Оксиды. Классификация, химические и физические свойства. Индивидуальные свойства
Оксиды. Классификация, химические и физические свойства. Индивидуальные свойства Полимерные материалы и изделия
Полимерные материалы и изделия Реакции обмена
Реакции обмена Презентация на тему Хлороводород. Соляная кислота
Презентация на тему Хлороводород. Соляная кислота  Неорганический мозговой штурм
Неорганический мозговой штурм Кумарон - индендық полимерлер
Кумарон - индендық полимерлер Химическая термодинамика. Термодинамические потенциалы
Химическая термодинамика. Термодинамические потенциалы Основания. Классификация
Основания. Классификация Основания и их свойства
Основания и их свойства ОВР химияПрезентация
ОВР химияПрезентация Спирты. Тест
Спирты. Тест смеси
смеси Расчет физических свойств нефтепродуктов. Практическая работа 1
Расчет физических свойств нефтепродуктов. Практическая работа 1 Подготовка к контрольной работе по теме «Изменения, происходящие с веществами
Подготовка к контрольной работе по теме «Изменения, происходящие с веществами Аллотропия Аллотропные видоизменения (модификации)
Аллотропия Аллотропные видоизменения (модификации)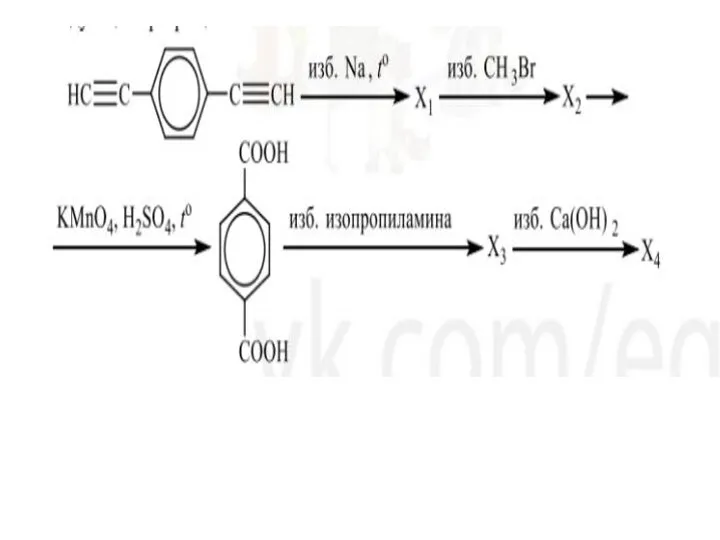 Арены
Арены Алюминий и сплавы алюминия
Алюминий и сплавы алюминия Ионы кальция, как важное звено в нейроцитотоксическом действии кадмия
Ионы кальция, как важное звено в нейроцитотоксическом действии кадмия Классификация простейших неорганических соединений. Свойства оксидов. Кислоты. Щёлочи
Классификация простейших неорганических соединений. Свойства оксидов. Кислоты. Щёлочи Уровень С1 в ГИА
Уровень С1 в ГИА Структура електронної оболонки атома. Енергетичні рівні та підрівні
Структура електронної оболонки атома. Енергетичні рівні та підрівні Substancje chemiczne
Substancje chemiczne Углерод и его свойства
Углерод и его свойства Химическая связь. Метод валентных связей
Химическая связь. Метод валентных связей Внеклассное мероприятие по химии Первоначальные химические понятия
Внеклассное мероприятие по химии Первоначальные химические понятия 9. Потомки светоносного элемента
9. Потомки светоносного элемента Химическая связь
Химическая связь Непредельные углеводороды ряда этиленовых
Непредельные углеводороды ряда этиленовых