Содержание
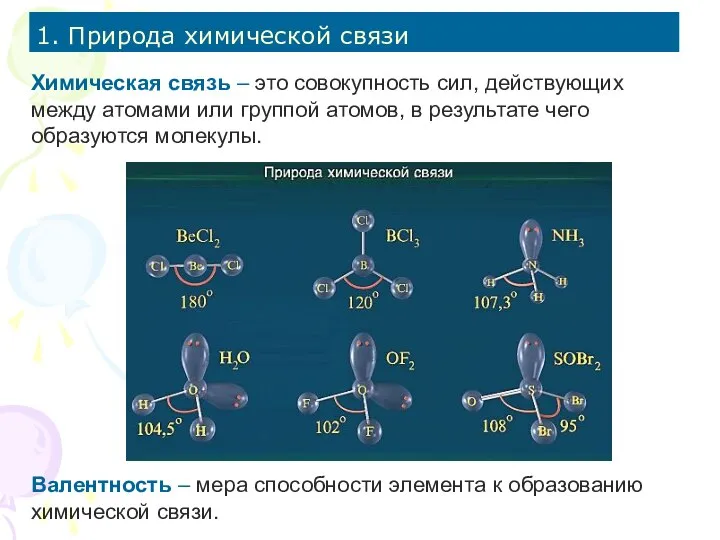
- 2. 1. Природа химической связи Химическая связь – это совокупность сил, действующих между атомами или группой атомов,
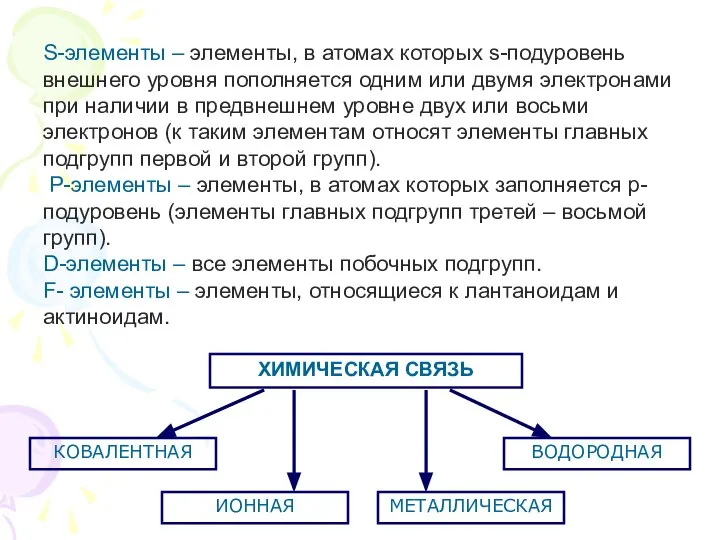
- 3. S-элементы – элементы, в атомах которых s-подуровень внешнего уровня пополняется одним или двумя электронами при наличии
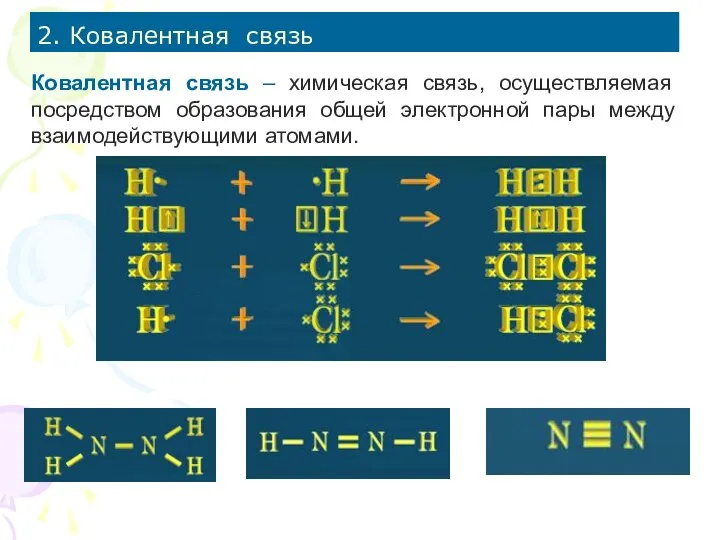
- 4. 2. Ковалентная связь Ковалентная связь – химическая связь, осуществляемая посредством образования общей электронной пары между взаимодействующими
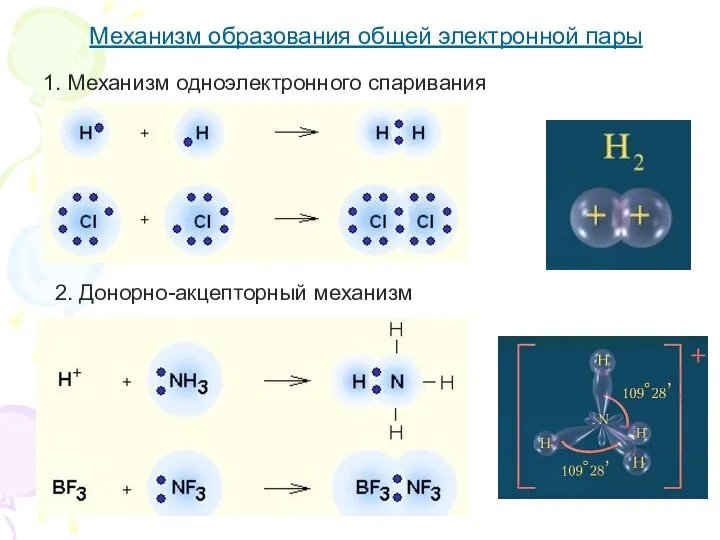
- 5. Механизм образования общей электронной пары 1. Механизм одноэлектронного спаривания 2. Донорно-акцепторный механизм
- 6. Основные характеристики ковалентной связи Длина связи – межъядерное расстояние между химически связанными атомами. Измеряется в нанометрах
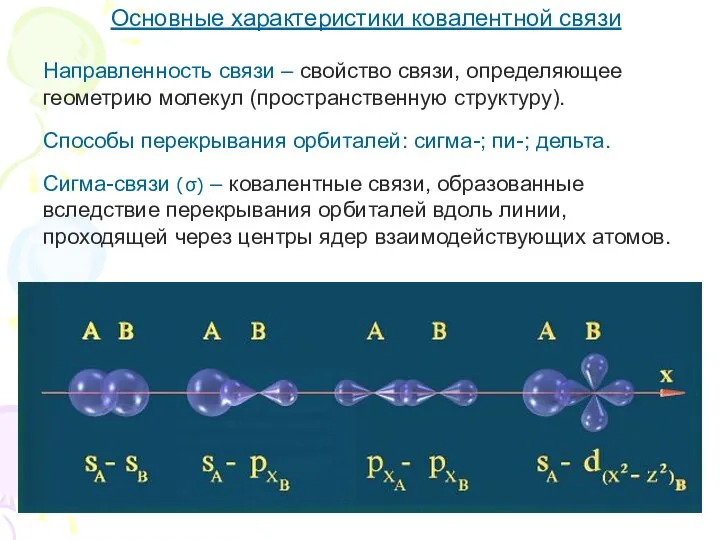
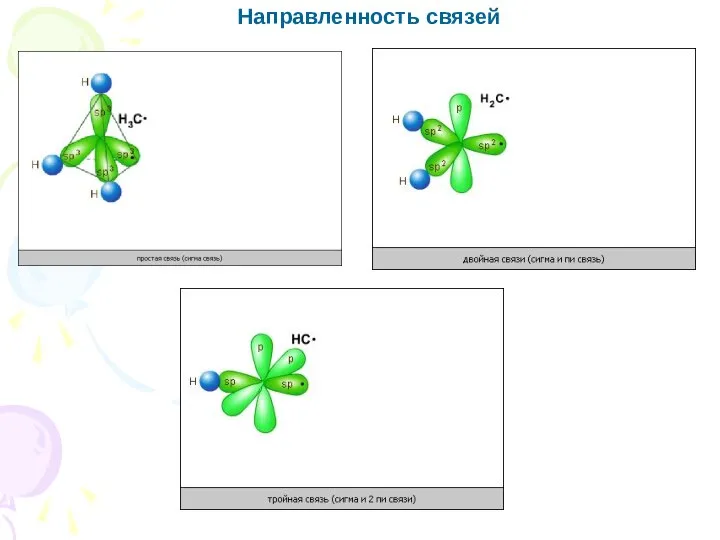
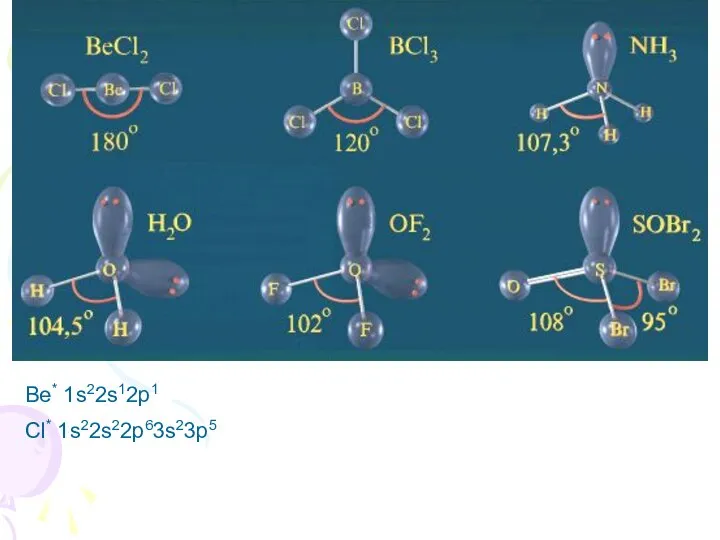
- 7. Основные характеристики ковалентной связи Направленность связи – свойство связи, определяющее геометрию молекул (пространственную структуру). Способы перекрывания
- 8. Основные характеристики ковалентной связи Пи-связи (π-) – связи, сформированные при перекрывании орбиталей по обе стороны от
- 9. Направленность связей
- 10. Be* 1s22s12p1 Cl* 1s22s22p63s23p5
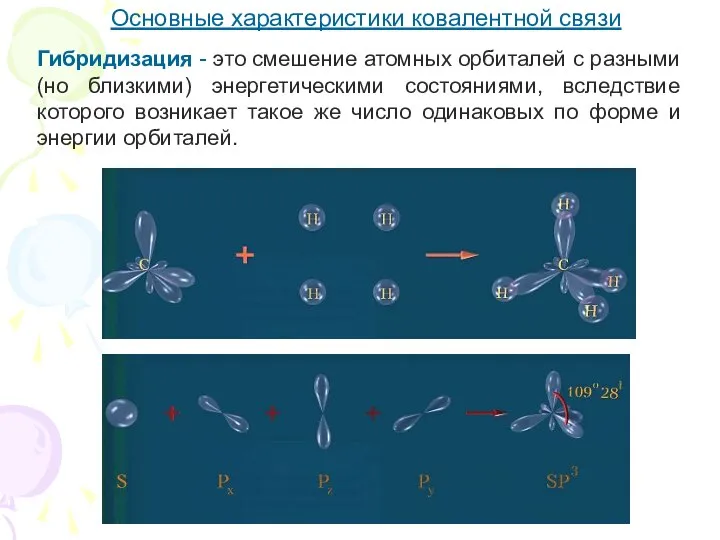
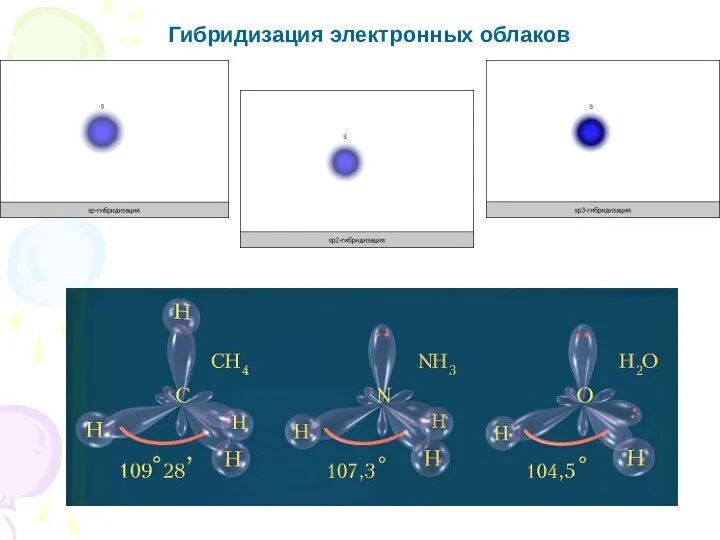
- 11. Основные характеристики ковалентной связи Гибридизация - это смешение атомных орбиталей с разными (но близкими) энергетическими состояниями,
- 12. Гибридизация электронных облаков
- 13. Основные характеристики ковалентной связи Полярность связи – характеризует состояние сдвига общей электронной пары в сторону более
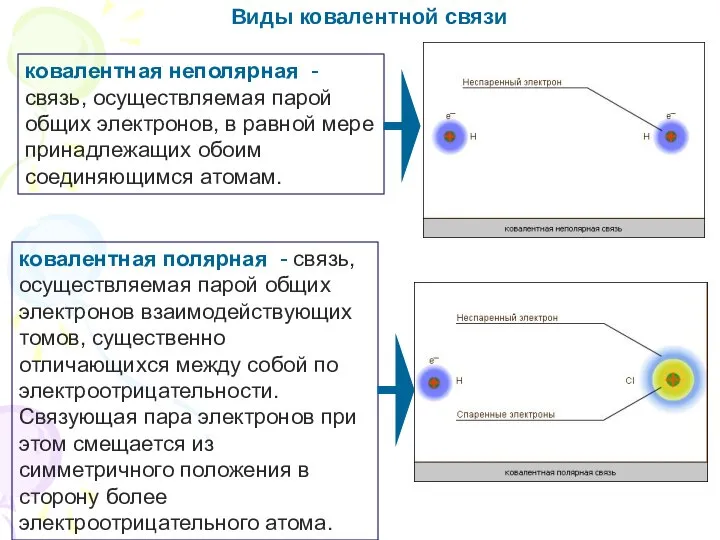
- 14. Виды ковалентной связи ковалентная неполярная - связь, осуществляемая парой общих электронов, в равной мере принадлежащих обоим
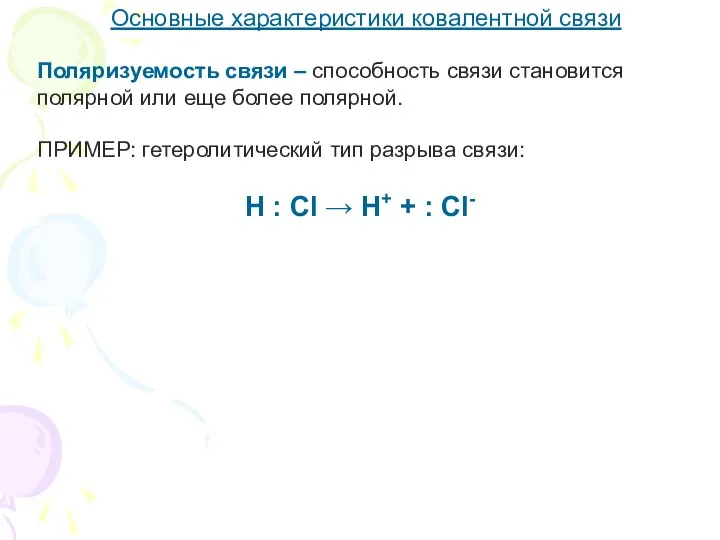
- 15. Основные характеристики ковалентной связи Поляризуемость связи – способность связи становится полярной или еще более полярной. ПРИМЕР:
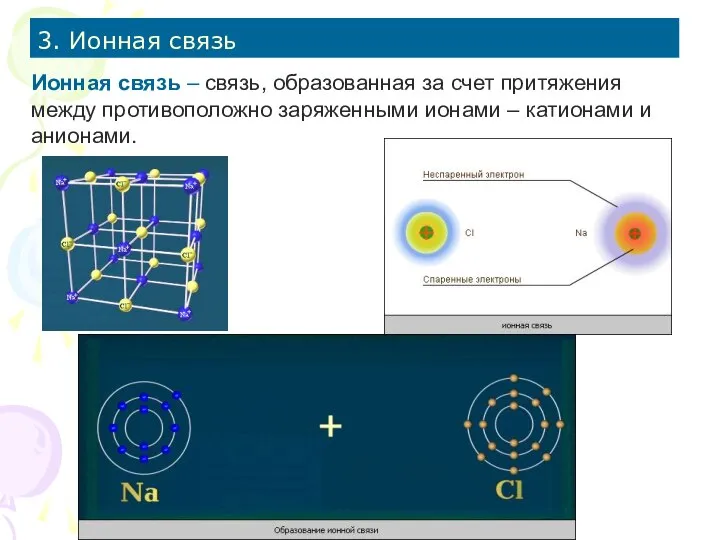
- 16. 3. Ионная связь Ионная связь – связь, образованная за счет притяжения между противоположно заряженными ионами –
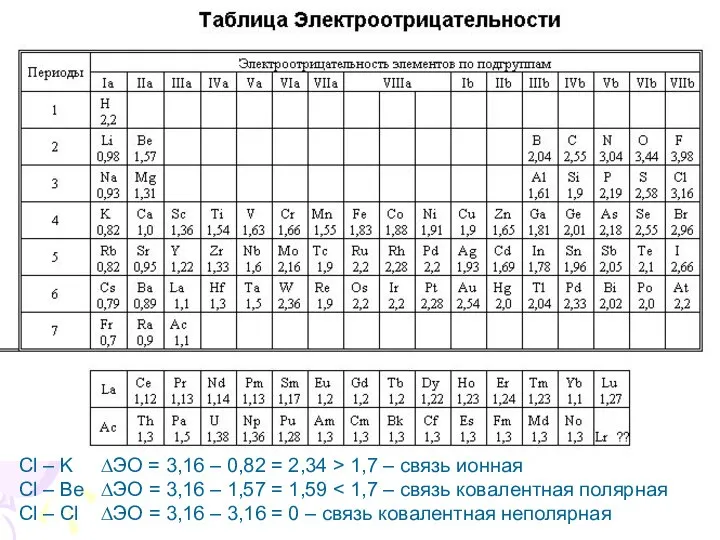
- 17. Cl – K ∆ЭО = 3,16 – 0,82 = 2,34 > 1,7 – связь ионная Cl
- 18. 4. Металлическая связь Металлическая связь – химическая связь, основанная на обобществлении валентных электронов, принадлежащих всем атомам
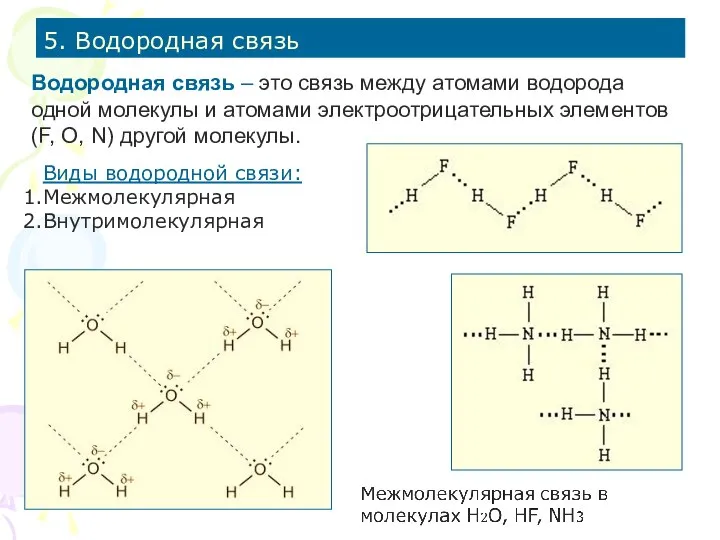
- 19. 5. Водородная связь Водородная связь – это связь между атомами водорода одной молекулы и атомами электроотрицательных
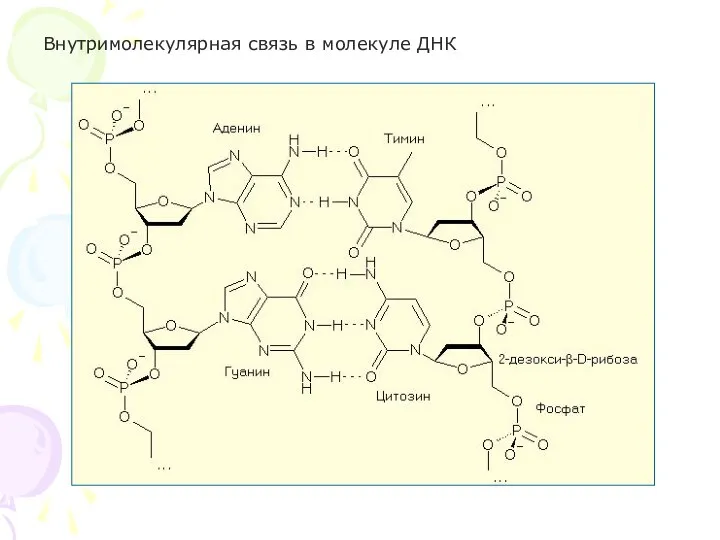
- 20. Внутримолекулярная связь в молекуле ДНК
- 21. 6. Кристаллические решетки Вещества, находящиеся в твердом образуют кристаллические решетки Кристаллические решётки веществ-это упорядоченное расположение частиц(атомов,
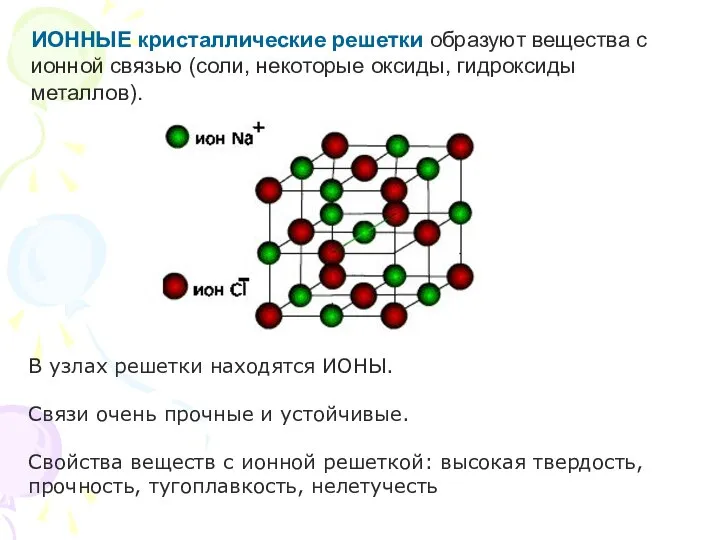
- 22. ИОННЫЕ кристаллические решетки образуют вещества с ионной связью (соли, некоторые оксиды, гидроксиды металлов). В узлах решетки
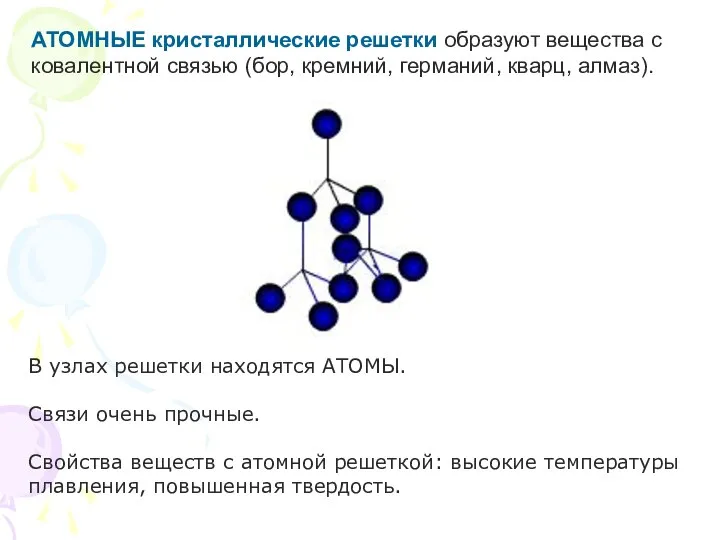
- 23. АТОМНЫЕ кристаллические решетки образуют вещества с ковалентной связью (бор, кремний, германий, кварц, алмаз). В узлах решетки
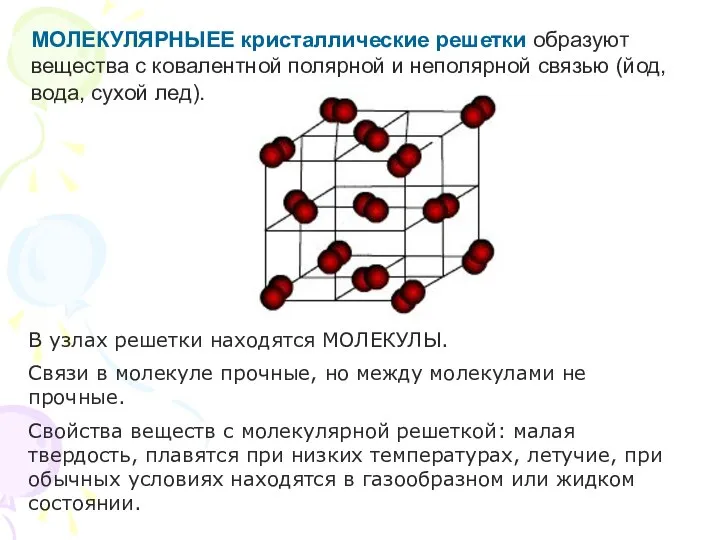
- 24. МОЛЕКУЛЯРНЫЕЕ кристаллические решетки образуют вещества с ковалентной полярной и неполярной связью (йод, вода, сухой лед). В
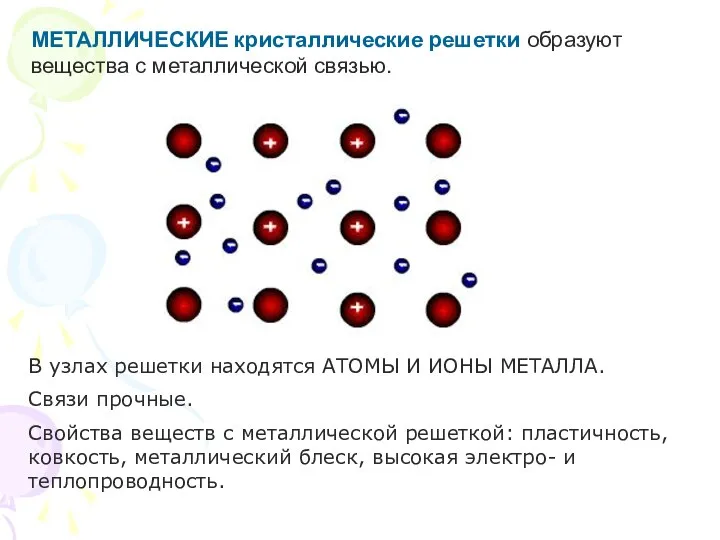
- 25. МЕТАЛЛИЧЕСКИЕ кристаллические решетки образуют вещества с металлической связью. В узлах решетки находятся АТОМЫ И ИОНЫ МЕТАЛЛА.
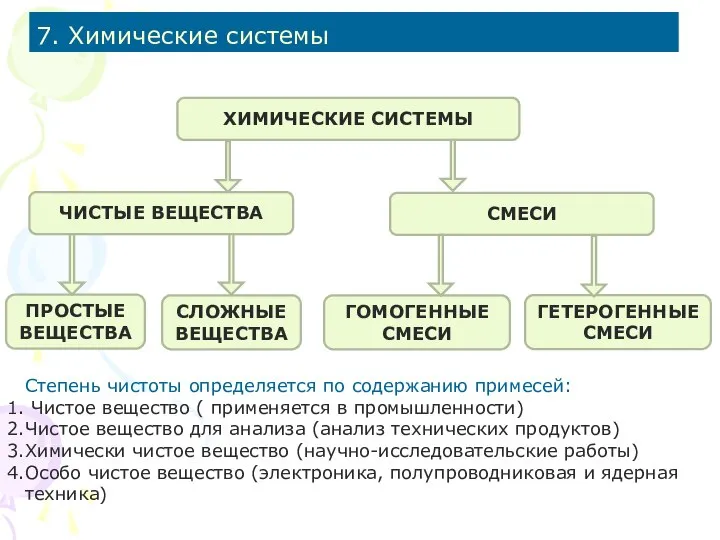
- 26. 7. Химические системы ХИМИЧЕСКИЕ СИСТЕМЫ ЧИСТЫЕ ВЕЩЕСТВА СМЕСИ ПРОСТЫЕ ВЕЩЕСТВА СЛОЖНЫЕ ВЕЩЕСТВА ГОМОГЕННЫЕ СМЕСИ ГЕТЕРОГЕННЫЕ СМЕСИ
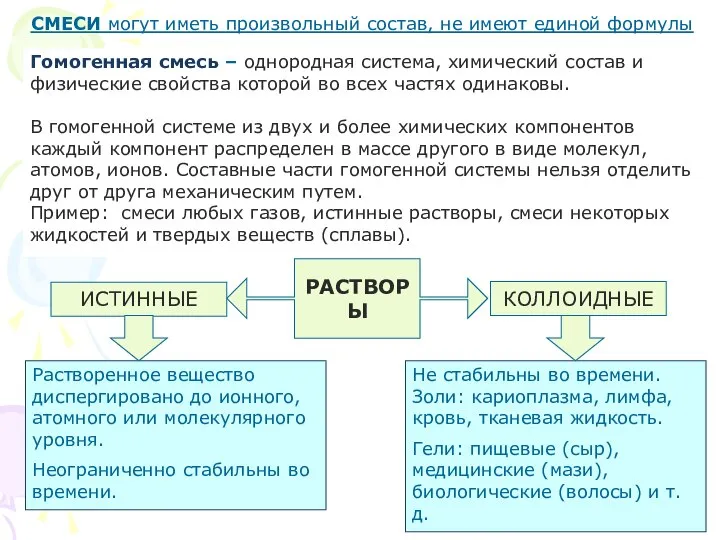
- 27. Гомогенная смесь – однородная система, химический состав и физические свойства которой во всех частях одинаковы. В
- 29. Скачать презентацию





 Электроны в кристаллах. Квантовая теория свободных электронов в металлах
Электроны в кристаллах. Квантовая теория свободных электронов в металлах Гравиметрический анализ. Лекция 1
Гравиметрический анализ. Лекция 1 Презентация на тему Великие ученые-химики
Презентация на тему Великие ученые-химики  Альдегиды, гомология, изомерия, номенклатура
Альдегиды, гомология, изомерия, номенклатура Соединения железа в природе
Соединения железа в природе Относительная атомная масса элементов
Относительная атомная масса элементов Соли
Соли Понятие о спиртах
Понятие о спиртах Соединения серы. Сернистая и серная кислоты
Соединения серы. Сернистая и серная кислоты Опыты с водой
Опыты с водой Твердые материалы для художественно-оформительских работ
Твердые материалы для художественно-оформительских работ Свойства растворов электролитов
Свойства растворов электролитов teoria_Butlerova
teoria_Butlerova Металлы. Группы металлов
Металлы. Группы металлов Презентация на тему Менделеев Дмитрий Иванович
Презентация на тему Менделеев Дмитрий Иванович  Химические свойства основных классов неорганических соединений
Химические свойства основных классов неорганических соединений Высокоэффективная жидкостная препаративная хроиматография
Высокоэффективная жидкостная препаративная хроиматография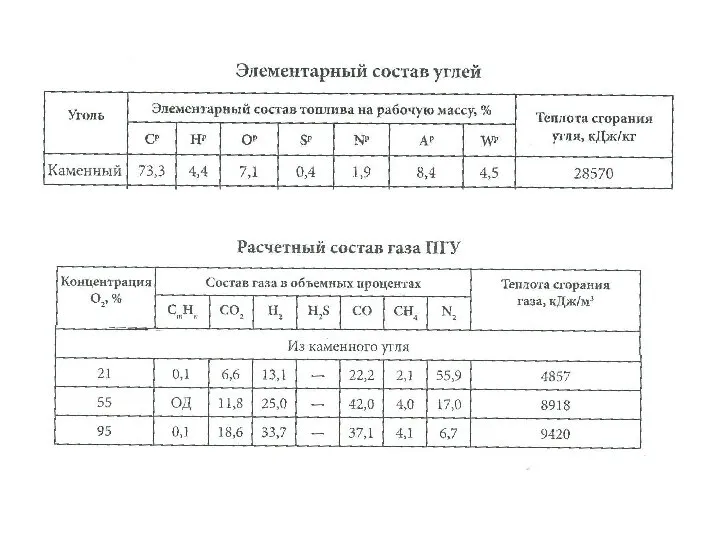 Элементарный состав углей
Элементарный состав углей Соединения галогенов
Соединения галогенов Презентация на тему Щавелевая кислота
Презентация на тему Щавелевая кислота  Химия в космосе Автор: Гриб Яна ученица 8а класса школа №484. Научный руководитель: Бирюкова Зоя Владимировна.
Химия в космосе Автор: Гриб Яна ученица 8а класса школа №484. Научный руководитель: Бирюкова Зоя Владимировна. Тривиальные названия веществ, наиболее часто встречаемых в ЕГЭ
Тривиальные названия веществ, наиболее часто встречаемых в ЕГЭ Основные положения теории строения органических соединений А. М. Бутлерова. Многообразие органических соединений
Основные положения теории строения органических соединений А. М. Бутлерова. Многообразие органических соединений Исследование кокаина методом ГХ-МС
Исследование кокаина методом ГХ-МС Металлы
Металлы Многогранность- моё второе имя. Задача
Многогранность- моё второе имя. Задача Вирощування кристалів солей
Вирощування кристалів солей Материаловедение. Полимерные материалы
Материаловедение. Полимерные материалы