Слайд 2Цель урока:
Разобраться, что такое «степень окисления»
Научиться находить степень окисления по формуле

Слайд 3Поваренная соль NaCl
«Хлеб да соль» - пожелание добра
«Надо вместе съесть пуд

соли, чтобы узнать человека»
За какое время это можно сделать?
Пуд – 16 кг
3,5 – 5,5 кг в год
Примерно 2 года
Слайд 4Влияние Na на организм человека
Хранят простое вещество «натрий» как Кощееву смерть.
Как может

повлиять натрий на организм человека?
Слайд 5Влияние Cl2 на организм человека
Хлор – отравляющее вещество, применявшееся во время первой

мировой войны
Слайд 6Образование сложного вещества
Na0 +11 2е,8е,1е
Cl0 +17 2e,8e,7e
Какой вид связи может образоваться

между этими атомами?
Na0 + Cl0 → Na+ + Cl- → Na+Cl-
Слайд 7Ковалентная полярная связь
За счет чего дополняется внешний уровень у ковалентных соединений?
Какие
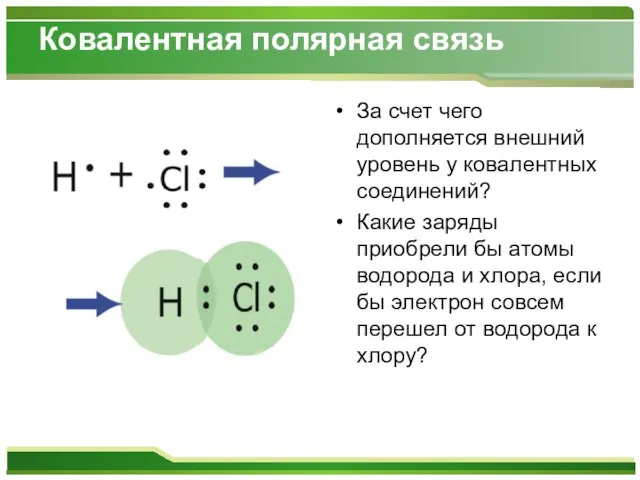
заряды приобрели бы атомы водорода и хлора, если бы электрон совсем перешел от водорода к хлору?
Слайд 8Ковалентная неполярная связь
Можно ли в простых веществах отнести общие пары к какому-то
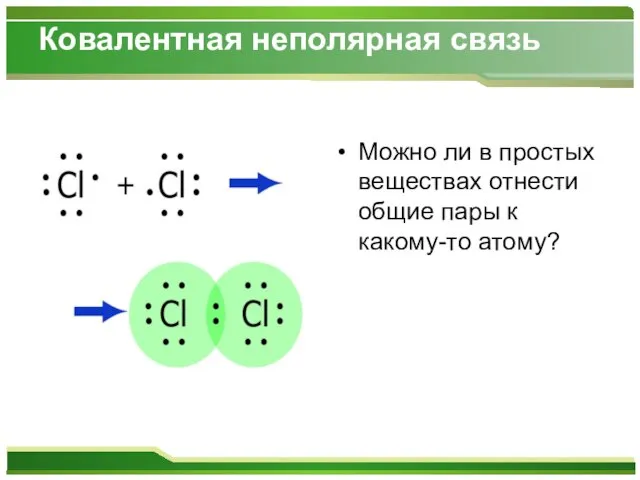
атому?
Слайд 9Сравним соединения
H - Cl
Cl - Cl
Na - Cl
Независимо от полярности связи валентность
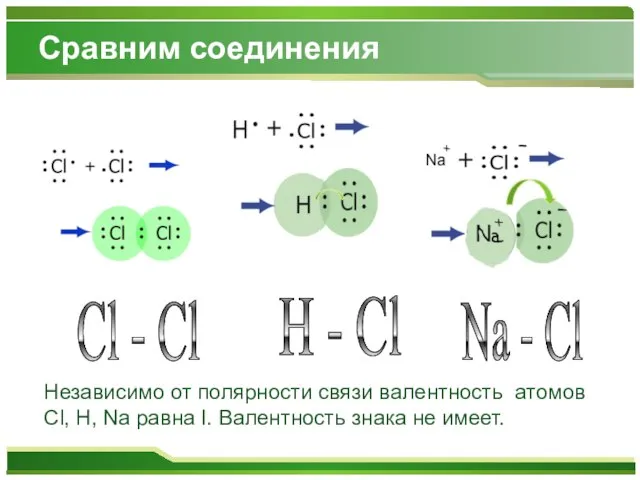
атомов Cl, H, Na равна I. Валентность знака не имеет.
Слайд 10Степень окисления –
это условный заряд атомов химических элементов в соединении, вычисленный

на основе предположения, что все соединения состоят из ионов
Слайд 11Правила определения с.о.
С.о. атомов в простых веществах = 0
С.о. фтора = -1
С.о.

кислорода = -2 (кроме Н2О2-1, O+2F2)
С.о. водорода = +1 (кроме МеН-1)
С.о.Ме I, II, III групп = номеру группы
С.о неМе «+» = номеру группы
С.о. неМе «-» = 8 – номер группы
Слайд 12Возможные с.о.
Положительная «+» равна числу отданных электронов. Максимальная с.о. равна номеру группы
Отрицательная

«-» равна числу принятых электронов. Минимальная с.о. равна 8 – номер группы
Нулевое значение с.о. имеют атомы в молекулах с неполярной связью
Слайд 13Промежуточные с.о.
Рассмотрим возможные с.о. серы – S
Максимальная +6 SO3
Минимальная -2 H2S
Сера может

проявлять с.о. 0,+2,+4 – это промежуточные с.о.
Слайд 14Определение с.о.
N2O3
На первом месте стоит элемент с «+» с.о., на втором с

«-»
У кислорода постоянная с.о.=-2
У азота переменная с.о.
x -2
N2O3
Стр.67 прочитайте как найти x
Слайд 15Задание 1
Определите С.О. по формулам
Cl2O7, NaH, Na2S, MgO, H3N, N2, Al2S3, Cu2O















 Амины, азо- и диазосоединения (продолжение)
Амины, азо- и диазосоединения (продолжение) Установочная лекция по специальной химии для студентов специальности Прикладная геология
Установочная лекция по специальной химии для студентов специальности Прикладная геология Химияның негізгі түсініктері мен зандары
Химияның негізгі түсініктері мен зандары Получение и примененипе радиоактивные изотопы
Получение и примененипе радиоактивные изотопы Патриотическое воспитание школьников на уроках
Патриотическое воспитание школьников на уроках Исследовательский проект по химии на тему: Жесткость воды и способы ее устранения
Исследовательский проект по химии на тему: Жесткость воды и способы ее устранения Синтез.Малахит
Синтез.Малахит О́лово — элемент 14-й группы периодической системы химических элементов
О́лово — элемент 14-й группы периодической системы химических элементов Химические формулы
Химические формулы Органические вещества клетки. Липиды. (10 класс)
Органические вещества клетки. Липиды. (10 класс) Основные законы химии
Основные законы химии Лабораторное оборудование. Тесты
Лабораторное оборудование. Тесты Алкены-1 (строение, изомерия, номенклатура)
Алкены-1 (строение, изомерия, номенклатура) Промышленное получение аминокислот и их применение в медицине и диетологии
Промышленное получение аминокислот и их применение в медицине и диетологии Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях
Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях Вода… Химические названия
Вода… Химические названия Свойства воды. Физические свойства
Свойства воды. Физические свойства Транс-жиры
Транс-жиры Изомерия и ее виды
Изомерия и ее виды Химия ионных жидкостей
Химия ионных жидкостей Строение углеводородов
Строение углеводородов Основные понятия химии
Основные понятия химии Гравиметрический анализ (ГА) - метод количественного химического анализа, основанный на точном измерении массы определяемого
Гравиметрический анализ (ГА) - метод количественного химического анализа, основанный на точном измерении массы определяемого Альдегиды, гомология, изомерия, номенклатура
Альдегиды, гомология, изомерия, номенклатура Вольфрам
Вольфрам Обобщение темы Органические вещества. Классификация органических веществ по углеродному скелету
Обобщение темы Органические вещества. Классификация органических веществ по углеродному скелету Количество теплоты, для получения углекислого газа. Химическое равновесие. Примеры. (Лекция 4)
Количество теплоты, для получения углекислого газа. Химическое равновесие. Примеры. (Лекция 4) Мышьяк (As)
Мышьяк (As)