Содержание
- 2. Что такое химия? Тезис: химия – наука о превращениях вообще. Это так? Давайте превратим во что-нибудь
- 3. Основная задача химии – изучить возможности и закономерности таких превращений веществ, которые сопровождаются перераспределением электронной плотности
- 4. Пространственная организация вещества – т.е., его строение – определяет все свойства этого вещества. Таким образом, возникает
- 5. Физико-химический анализ (ФХА) ФХА основан на построении и геометрическом анализе диаграмм состояния и диаграмм состав-свойство. О
- 6. Фаза – совокупность таких гомогенных тел системы, которые характеризуются одинаковыми свойствами и находятся в состоянии равновесия.
- 7. Этот квадрант плоскости назовем пространством состояний однокомпонентной системы. В пространстве состояний каждой фазе соответствует область, то
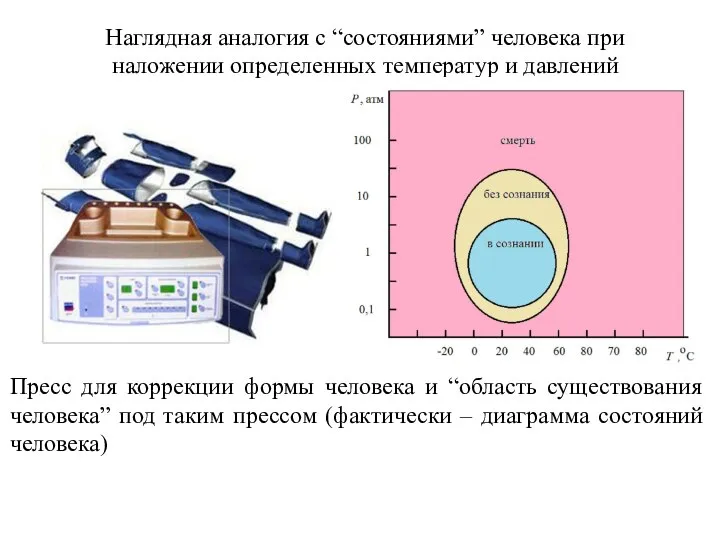
- 8. Наглядная аналогия с “состояниями” человека при наложении определенных температур и давлений Пресс для коррекции формы человека
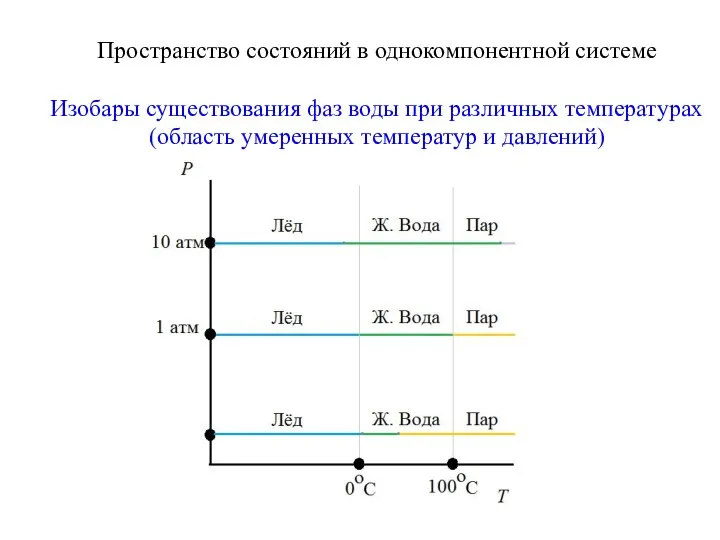
- 9. Пространство состояний в однокомпонентной системе Изобары существования фаз воды при различных температурах (область умеренных температур и
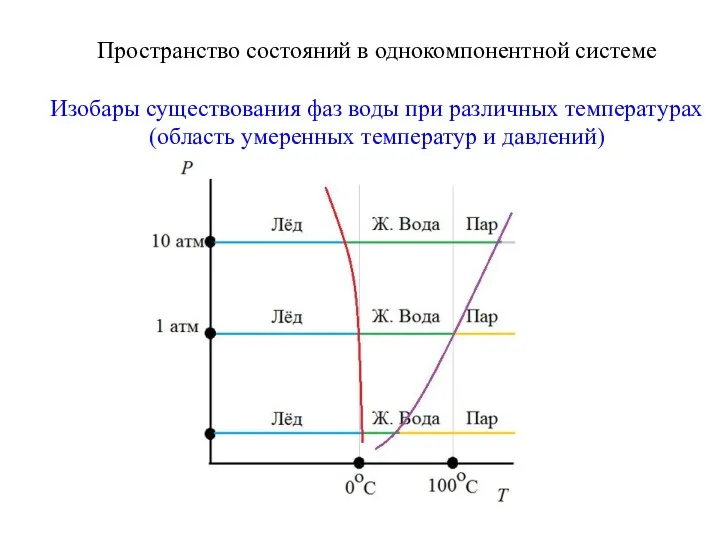
- 10. Пространство состояний в однокомпонентной системе Изобары существования фаз воды при различных температурах (область умеренных температур и
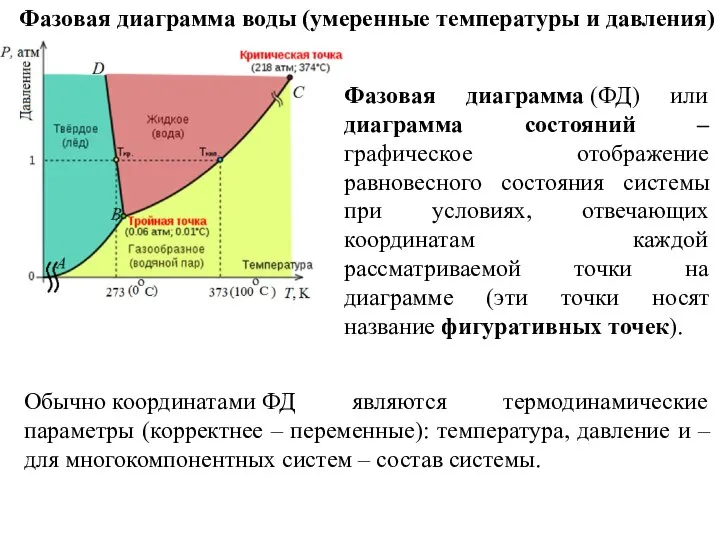
- 11. Фазовая диаграмма воды (умеренные температуры и давления) Обычно координатами ФД являются термодинамические параметры (корректнее – переменные):
- 12. Фазовая диаграмма воды (умеренные температуры и давления) - состояния сосуществования фаз и области сосуществования фаз (для
- 13. Принципы, положенные в основу ФХА и построения фазовых диаграмм (принципы Курнакова) Принцип непрерывности: если в системе
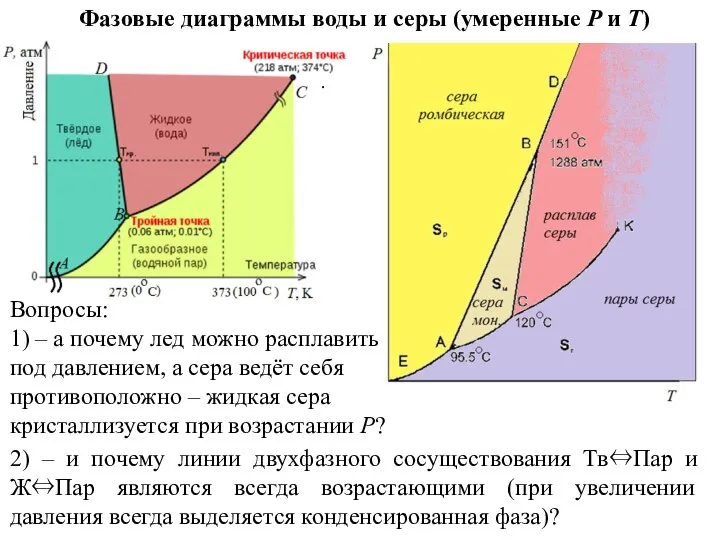
- 14. Фазовые диаграммы воды и серы (умеренные P и T) . Вопросы: 1) – а почему лед
- 15. . Еще вопрос: 3) – отрицательный наклон линии Тв⇔Ж (здесь – BD) всегда коррелирует с тем,
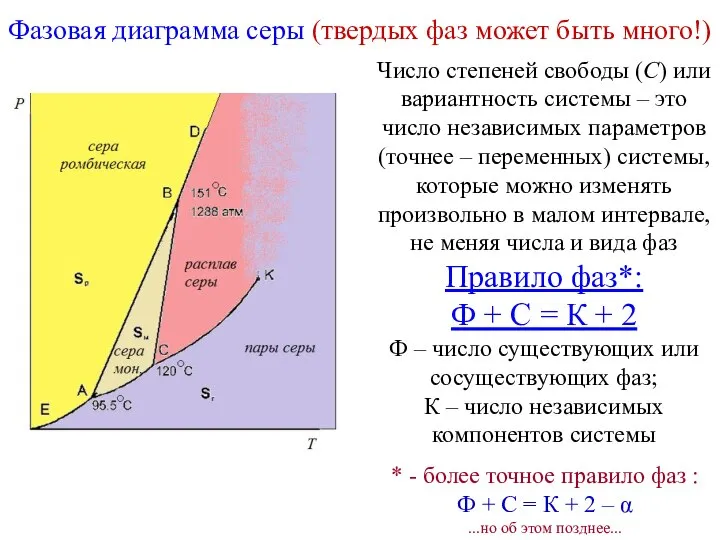
- 16. Фазовая диаграмма серы (твердых фаз может быть много!) Число степеней свободы (С) или вариантность системы –
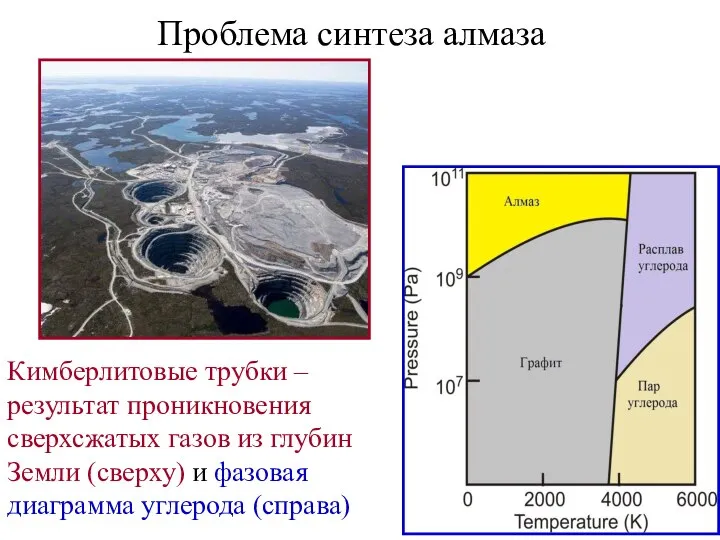
- 17. Проблема синтеза алмаза Кимберлитовые трубки – результат проникновения сверхсжатых газов из глубин Земли (сверху) и фазовая
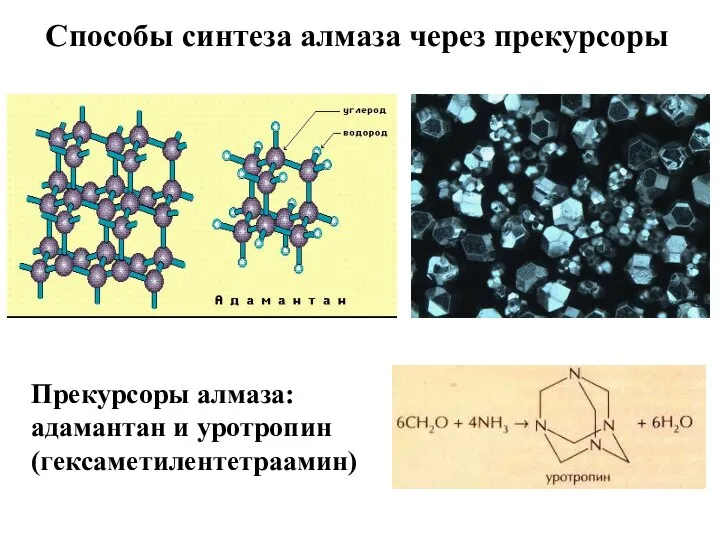
- 18. Способы синтеза алмаза через прекурсоры Прекурсоры алмаза: адамантан и уротропин (гексаметилентетраамин)
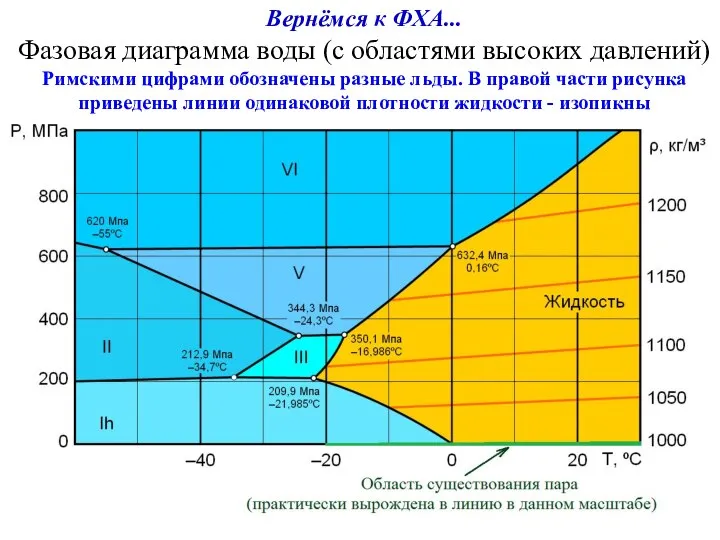
- 19. Вернёмся к ФХА... Фазовая диаграмма воды (с областями высоких давлений) Римскими цифрами обозначены разные льды. В
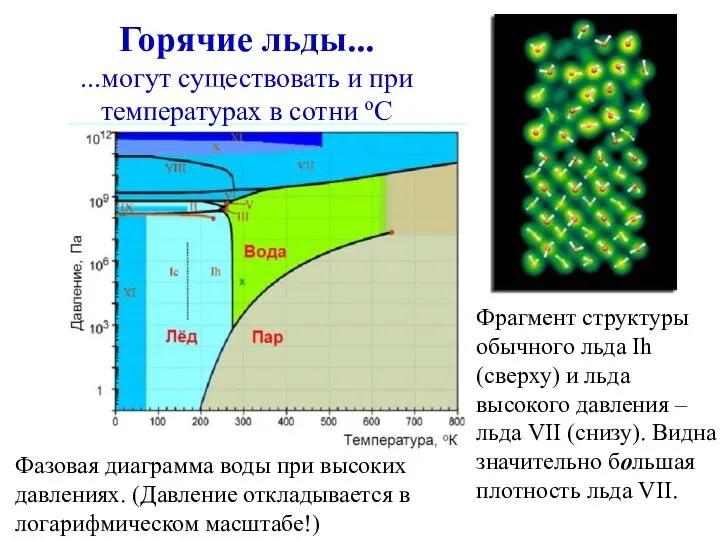
- 20. Фрагмент структуры обычного льда Ih (сверху) и льда высокого давления – льда VII (снизу). Видна значительно
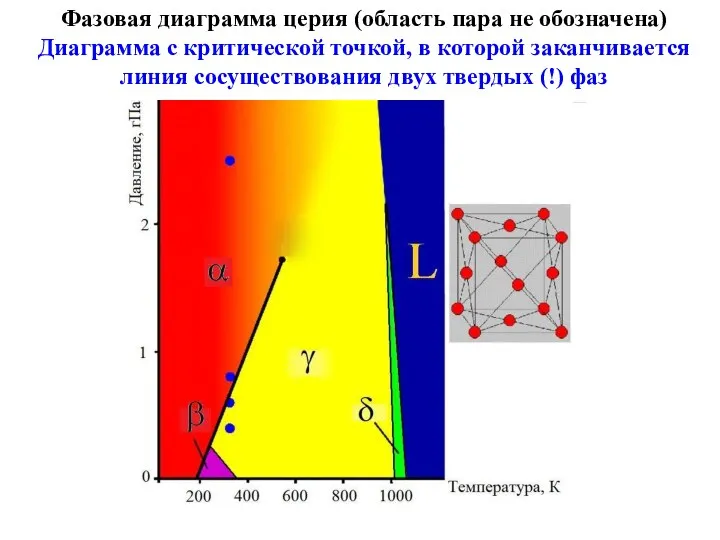
- 21. Фазовая диаграмма церия (область пара не обозначена) Диаграмма с критической точкой, в которой заканчивается линия сосуществования
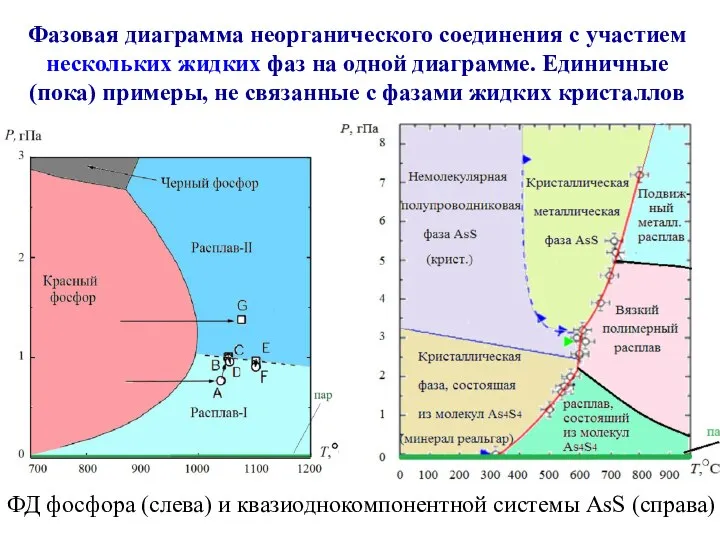
- 22. ФД фосфора (слева) и квазиоднокомпонентной системы AsS (справа) Фазовая диаграмма неорганического соединения с участием нескольких жидких
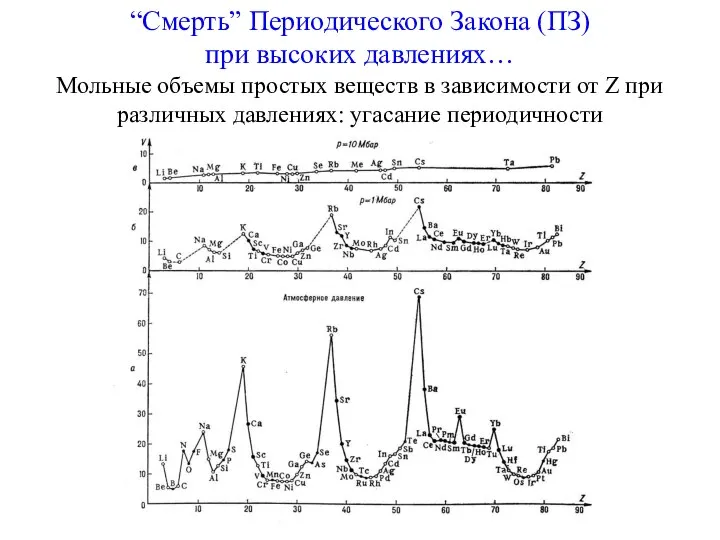
- 23. “Смерть” Периодического Закона (ПЗ) при высоких давлениях… Мольные объемы простых веществ в зависимости от Z при
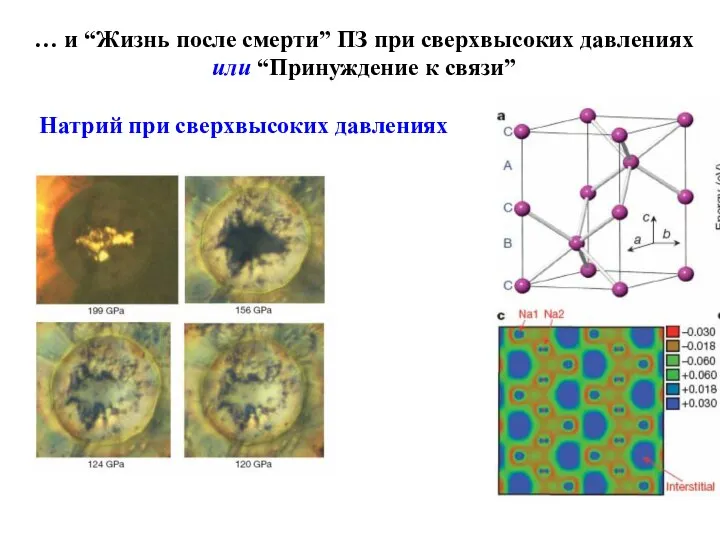
- 24. … и “Жизнь после смерти” ПЗ при сверхвысоких давлениях или “Принуждение к связи” Натрий при сверхвысоких
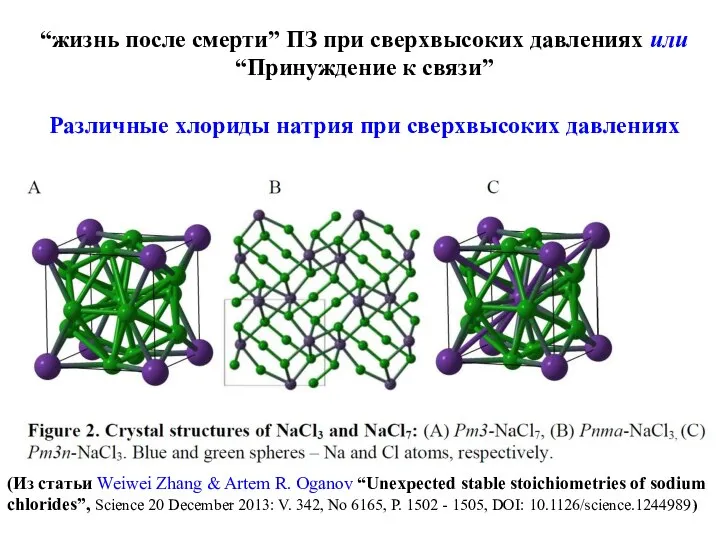
- 25. “жизнь после смерти” ПЗ при сверхвысоких давлениях или “Принуждение к связи” Различные хлориды натрия при сверхвысоких
- 27. Скачать презентацию









 Кислотность почв с.Берёзовка МОУ «СОШ с.Берёзовка» Колесников Иван, 9 класс Пряхина Виктория, 8 класс
Кислотность почв с.Берёзовка МОУ «СОШ с.Берёзовка» Колесников Иван, 9 класс Пряхина Виктория, 8 класс Химические методы анализа. Аналитические методы контроля в техносферной безопасности. Лекция 6
Химические методы анализа. Аналитические методы контроля в техносферной безопасности. Лекция 6 Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Химическая реакция в потоке в одномерном случае. Уравнение неразрывности
Химическая реакция в потоке в одномерном случае. Уравнение неразрывности Химические свойства оксидов
Химические свойства оксидов Побочная подгруппа VII группы периодической системы
Побочная подгруппа VII группы периодической системы Многообразие органических веществ
Многообразие органических веществ Обозначения групп симметрии по Шенфлису
Обозначения групп симметрии по Шенфлису Клеящие материалы
Клеящие материалы Презентация на тему Обратимость химических реакций. Химическое равновесие
Презентация на тему Обратимость химических реакций. Химическое равновесие  Материаловедение. Адсорбционные материалы. Металлоорганические каркасы
Материаловедение. Адсорбционные материалы. Металлоорганические каркасы Классификация белков
Классификация белков Химическая термодинамика
Химическая термодинамика Классификация веществ
Классификация веществ Кислород
Кислород Распределение электронов в атомах
Распределение электронов в атомах Валентность (от латинского valentia – сила)
Валентность (от латинского valentia – сила) Презентация на тему Войди в природу другом
Презентация на тему Войди в природу другом  Якісні реакції органічних речовин
Якісні реакції органічних речовин Презентация на тему Химические синонимы
Презентация на тему Химические синонимы  Основные законы химии
Основные законы химии Магний
Магний Коррозия металлов
Коррозия металлов Генетическая связь между классами неорганических веществ
Генетическая связь между классами неорганических веществ ГАЛОГЕНЫ
ГАЛОГЕНЫ Алкины: получение и свойства
Алкины: получение и свойства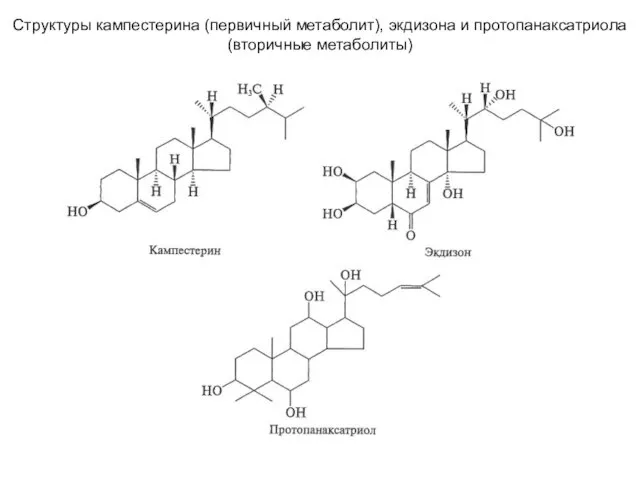 Структуры кампестерина (первичный метаболит), экдизона и протопанаксатриола (вторичные метаболиты)
Структуры кампестерина (первичный метаболит), экдизона и протопанаксатриола (вторичные метаболиты) Методы очистки воды от тяжелых металлов Выполнила: студентка 4 курса 41 группы естественно-географического факультета Кузнецова
Методы очистки воды от тяжелых металлов Выполнила: студентка 4 курса 41 группы естественно-географического факультета Кузнецова