Содержание
- 2. CH3COOH ↔ CH3COO- + H+ Kдисс = [CH3COO-][H+] / [CH3COOH] C0 = [CH3COO-] + [CH3COOH] α
- 3. Сильные: α > 0.3 Ka>10-1 Средние: 0.03 Слабые: α Сила электролитов Активность — «эффективная» концентрация a
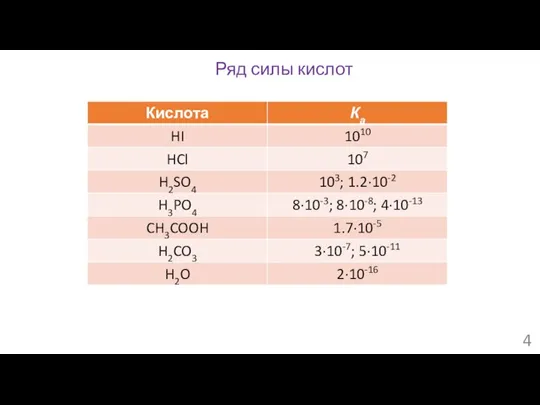
- 4. Ряд силы кислот
- 5. Кислотность воды и растворов H2O ↔ OH- + H+ Kдисс = [OH-]∙[H+] / [H2O] Ионное произведение
- 6. Задача Рассчитать рН 0.1М раствора масляной (одноосновной) кислоты, если её степень диссоциации равна 1.5%.
- 7. Задача Рассчитать рН 0.1М раствора масляной (одноосновной) кислоты, если её степень диссоциации равна 1.5%. НА ↔
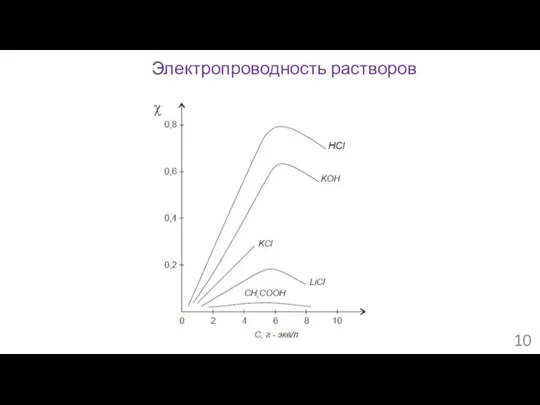
- 9. Электропроводность растворов Закон Ома: I = U/R Сопротивление проводника: R = ρ∙L/S Проводимость 1/R = 1/ρ
- 10. Электропроводность растворов
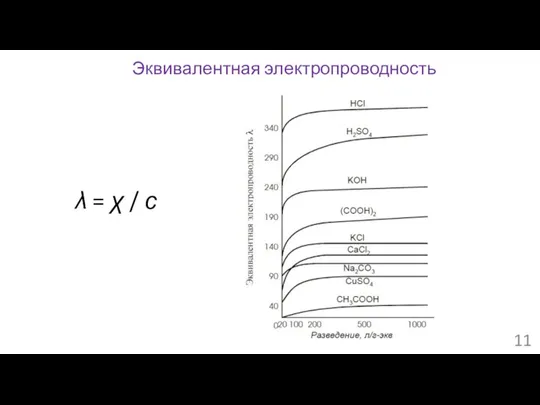
- 11. Эквивалентная электропроводность λ = χ / с
- 12. λ∞ = λ+ + λ- α = λ/ λ∞ Эквивалентная электропроводность и подвижность ионов
- 13. Аномальная подвижность H+ и OH- эстафетный механизм
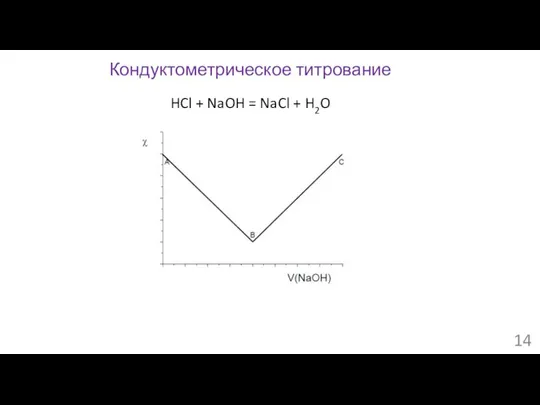
- 14. Кондуктометрическое титрование HCl + NaOH = NaCl + H2O
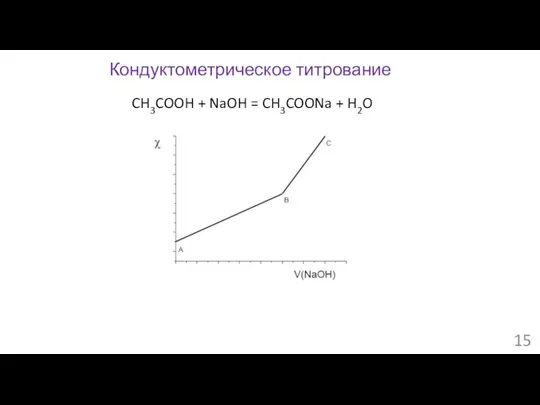
- 15. Кондуктометрическое титрование CH3COOH + NaOH = CH3COONa + H2O
- 16. Гальванический элемент
- 17. Гальванический элемент
- 18. Гальванический элемент
- 19. Стандартные потенциалы Е0
- 20. ЕХC = ЕAg,0 + (0.059/1)∙log(aAg+) = 0.222 В Хлорсеребряный электрод Ag | AgCl | KClнасыщ. AgCl
- 21. ЕХГ = ЕХГ,0 + (0.059/2)∙log(aх∙а2Н2/агх) = = ЕХГ,0 - 0.059∙pH Определение рН
- 22. Задача ЭДС гальванического элемента, состоящего из хлорсеребряного и хингидронного электродов, равна 0.32 Вольт. Найти рН хингидронного
- 24. Скачать презентацию
![CH3COOH ↔ CH3COO- + H+ Kдисс = [CH3COO-][H+] / [CH3COOH] C0 =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1110452/slide-1.jpg)

![Кислотность воды и растворов H2O ↔ OH- + H+ Kдисс = [OH-]∙[H+]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1110452/slide-4.jpg)













 Основные принципы работы химических сенсоров
Основные принципы работы химических сенсоров Истина - дочь времени, а не авторитета
Истина - дочь времени, а не авторитета Магний - активный, но под защитой
Магний - активный, но под защитой Подгруппа кислорода. Решение экспериментальных задач
Подгруппа кислорода. Решение экспериментальных задач Состав и свойства нефти. Химический состав нефтяной смеси
Состав и свойства нефти. Химический состав нефтяной смеси Презентация на тему Основные химические понятия
Презентация на тему Основные химические понятия  564481
564481 Пластмассы
Пластмассы Презентация по Химии "Соединения алюминия"
Презентация по Химии "Соединения алюминия"  Материаловедение. Деформация и разрушение материалов. (Тема 4)
Материаловедение. Деформация и разрушение материалов. (Тема 4) Окислительновосстановительные реакции. 9 класс
Окислительновосстановительные реакции. 9 класс Презентация на тему Классификация химических реакций
Презентация на тему Классификация химических реакций  Алканы в торфянисто-подзолисто-глееватых почвах Габов Д.Н., Безносиков В.А., Кондратенок Б.М., Груздев И.В.
Алканы в торфянисто-подзолисто-глееватых почвах Габов Д.Н., Безносиков В.А., Кондратенок Б.М., Груздев И.В. Химическая связь
Химическая связь _Периодический закон. Распределение электронов по энергетическим уровням и подуровням (1)
_Периодический закон. Распределение электронов по энергетическим уровням и подуровням (1) V группа. Побочная подгруппа
V группа. Побочная подгруппа Организация физической защиты ДРМ
Организация физической защиты ДРМ Кислород и озон
Кислород и озон Выращивание кристаллов соли (домашний эксперимент)
Выращивание кристаллов соли (домашний эксперимент) Сплавы металлов
Сплавы металлов Вода - самое удивительное вещество в природе. (8 класс)
Вода - самое удивительное вещество в природе. (8 класс) Бутлєров
Бутлєров Взаимодействие молекул (7 класс)
Взаимодействие молекул (7 класс) Классы неорганических соединений Подготовка к ЕГЭ
Классы неорганических соединений Подготовка к ЕГЭ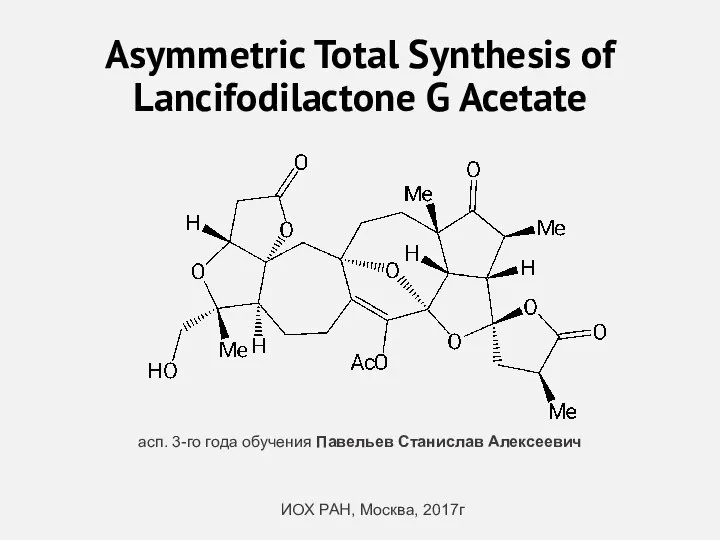 Asymmetric Total Synthesis of Lancifodilactone G Acetate
Asymmetric Total Synthesis of Lancifodilactone G Acetate Исследование методов синтеза 5-аминосалициловой кислоты
Исследование методов синтеза 5-аминосалициловой кислоты Дисперсные системы
Дисперсные системы Основания. 8 класс
Основания. 8 класс