Содержание
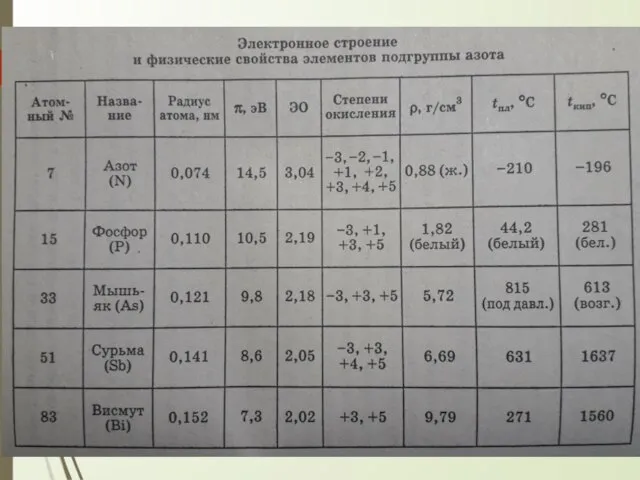
- 3. Химия элементов V группы очень разнообразна и, учитывая необычные свойства элементов, при изучнии ее разбивают на
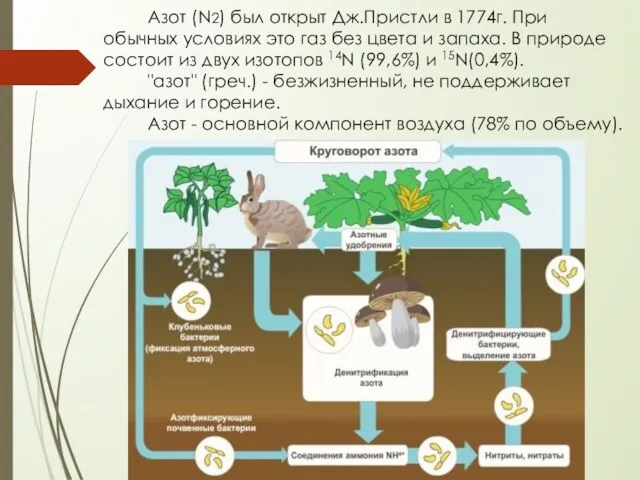
- 4. Азот (N2) был открыт Дж.Пристли в 1774г. При обычных условиях это газ без цвета и запаха.
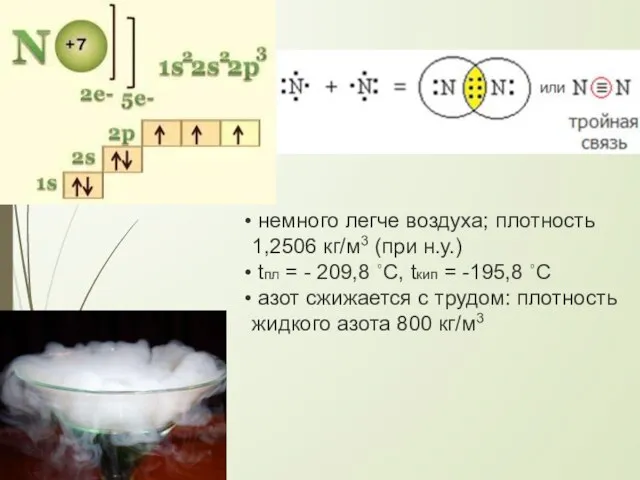
- 5. немного легче воздуха; плотность 1,2506 кг/м3 (при н.у.) tпл = - 209,8 ∘C, tкип = -195,8
- 6. СПОСОБЫ ПОЛУЧЕНИЯ АЗОТА Промышленные способы: Ректификация (разделение) жидкого воздуха: сначала улетучивается N2 (tкип= -196∘C); затем О2
- 7. ХИМИЧЕСКИЕ СВОЙСТВА: Молекулярный азот — химически инертное вещество, поэтому легко реагирует только с металлами: Азот при
- 8. С неметаллами азот реагирует тяжелее: для инициирования и ускорения реакций необходимо применять высокие температуры, искровые электрические
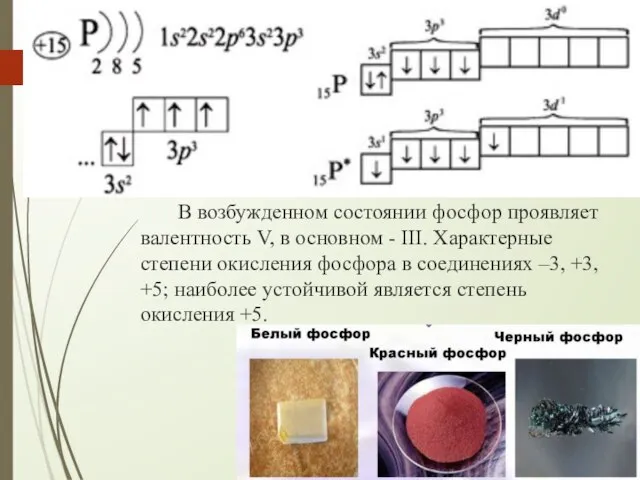
- 9. В возбужденном состоянии фосфор проявляет валентность V, в основном - III. Характерные степени окисления фосфора в
- 10. Р4 - белый фосфор мягкий, как воск, плавится и кипит без разложения, обладает чесночным запахом. На
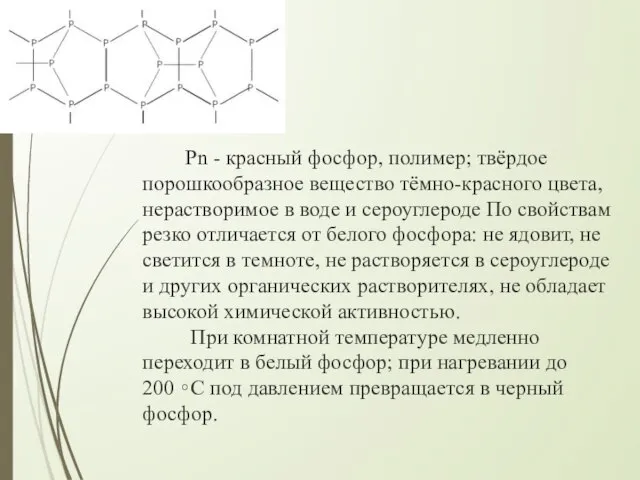
- 11. Рn - красный фосфор, полимер; твёрдое порошкообразное вещество тёмно-красного цвета, нерастворимое в воде и сероуглероде По
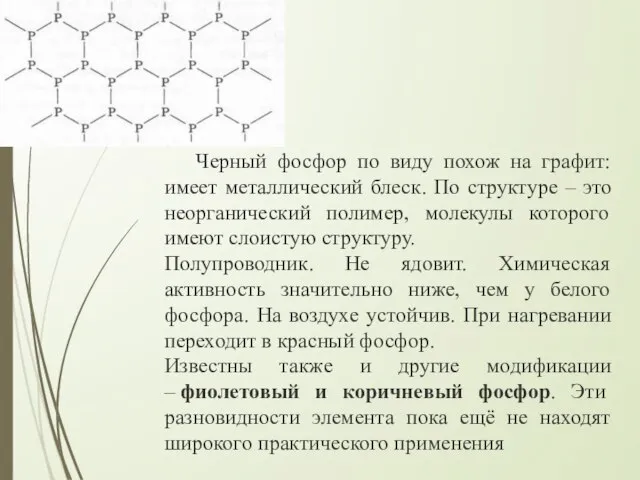
- 12. Черный фосфор по виду похож на графит: имеет металлический блеск. По структуре – это неорганический полимер,
- 13. ХИМИЧЕСКИЕ СВОЙСТВА ФОСФОРА Наиболее активным в химическом отношении является белый фосфор (но на практике предпочитают работать
- 14. 1) При взаимодействии с водой фосфор диспропорционирует (является и окислителем и восстановителем одновременно) с образованием фосфина
- 15. 3) Фосфор не реагирует с большинством кислот, однако сильные кислоты-окислители (азотная, серная, хлорная) превращают фосфор в
- 16. 4) Реакция окисления также происходит при поджигании спичек, в качестве окислителя выступает бертолетова соль:
- 18. Скачать презентацию









 Тосол. Гликолевые антифризы
Тосол. Гликолевые антифризы Презентация на тему Химический алфавит
Презентация на тему Химический алфавит  Термодинамика. Лекция №2
Термодинамика. Лекция №2 Пористые стекла
Пористые стекла 897386 (2)
897386 (2) Презентация на тему Дисахариды
Презентация на тему Дисахариды  Арены. Бензол
Арены. Бензол Хром. Месторождения
Хром. Месторождения Окислительно-восстановительные реакции. Метод электронного баланса
Окислительно-восстановительные реакции. Метод электронного баланса Алканы. Свойства. Строение и применение
Алканы. Свойства. Строение и применение Образование и получение веществ
Образование и получение веществ Презентация на тему Водород (9 класс)
Презентация на тему Водород (9 класс)  Стекло. Определение стекла
Стекло. Определение стекла Леция 1. Природа сил взаимодействия. Методы исследования комплексообразования:
Леция 1. Природа сил взаимодействия. Методы исследования комплексообразования: Строение и химические свойства галогенов
Строение и химические свойства галогенов Автоматизация процесса сушки миксера печи СКН
Автоматизация процесса сушки миксера печи СКН Каучук. История открытия каучука
Каучук. История открытия каучука Устройство лабораторного штатива
Устройство лабораторного штатива Химические свойства алкенов. Получение
Химические свойства алкенов. Получение Дисперсные системы
Дисперсные системы Электрохимия. Экзаменационные вопросы
Электрохимия. Экзаменационные вопросы Занимательные задачи по химии
Занимательные задачи по химии Химические реакции
Химические реакции Химия и нанотехнологии
Химия и нанотехнологии Презентация на тему Коррозия
Презентация на тему Коррозия  Химическое сопротивление материалов
Химическое сопротивление материалов Алгоритм решения задач по химии.
Алгоритм решения задач по химии. Алканы и алкены
Алканы и алкены