Слайд 2Alkalické kovy
– prvky I.A skupiny okrem vodíka:
lítium, sodík, draslík, rubídium, cézium a
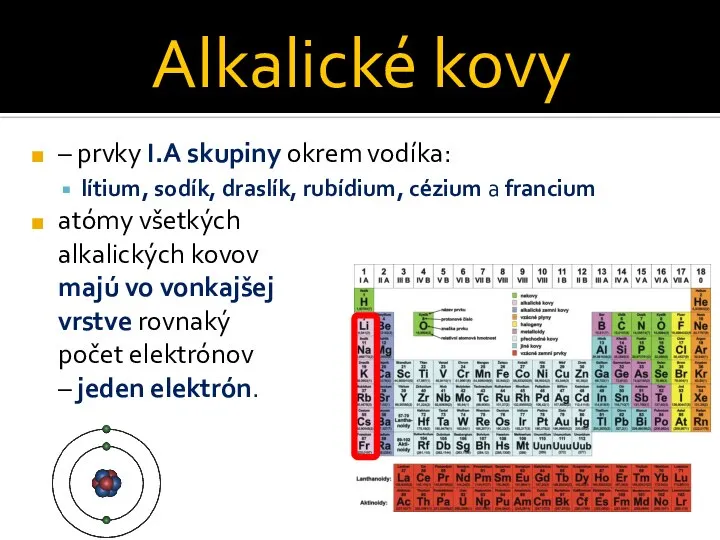
francium
atómy všetkých
alkalických kovov
majú vo vonkajšej
vrstve rovnaký
počet elektrónov
– jeden elektrón.
Слайд 3Vlastnosti
na reze sú striebrolesklé,
sú mäkké, preto sa dajú krájať nožom,
majú malú hustotu

a nízku teplotu topenia,
na vzduchu sa rýchlo pokrývajú vrstvou kyslíka, preto sa uchovávajú v petroleji,
sú veľmi reaktívne a majú nízke hodnoty elektronegativity, preto ľahko odovzdávajú elektrón a tvoria tak katióny, napr. :
Li – 1e- ? Li+
Слайд 4Vlastnosti
alkalické kovy charakteristicky sfarbujú plameň:
červený žltý ružovo- fialová modrá
fialový

Слайд 5Sodík a draslík
sú neušľachtilé a veľmi reaktívne kovy, v zlúčeninách majú oxidačné

číslo +I,
sú to významné biogénne prvky, ich katióny sa zúčastňujú na životne dôležitých procesoch v tele,
katióny Na+ a K+ sa nachádzajú v mydlách a v skle
kvapalný sodík a draslík tvoria chladiacu zmes v jadrových reaktoroch
Слайд 6Draslík
potrebuje človek na činnosť krvného obehu, tráviaceho a nervového systému,
jeho hlavným zdrojom

je ovocie a zelenina,
jeho nedostatok sa prejavuje poruchami činnosti svalov,
do pôdy sa dostáva v podobe draselných hnojív





 Основания. Схема образования гидроксида натрия
Основания. Схема образования гидроксида натрия Алкан бутан (C4H10)
Алкан бутан (C4H10) Состав атома
Состав атома Классификация коррозионных процессов металлов
Классификация коррозионных процессов металлов Лекция1Тов
Лекция1Тов Адсорбция. Механизмы адсорбции. Термодинамика адсорбции. Лекция 5
Адсорбция. Механизмы адсорбции. Термодинамика адсорбции. Лекция 5 Валентность, классы и номенклатура неорганических веществ
Валентность, классы и номенклатура неорганических веществ Водные биоресурсы и аквакультура. Расчеты в объемном анализе
Водные биоресурсы и аквакультура. Расчеты в объемном анализе Основания
Основания тб в кабинете биологии [Автосохраненный]
тб в кабинете биологии [Автосохраненный] Основные понятия термодинамики.Первое начало термодинамики и его применимость к биосистемам. (Лекция 04)
Основные понятия термодинамики.Первое начало термодинамики и его применимость к биосистемам. (Лекция 04) Практическая работа №5. Качественные реакции на анионы 1-3 групп
Практическая работа №5. Качественные реакции на анионы 1-3 групп Марганец. Химия элементов. Кислородосодержащие соединения
Марганец. Химия элементов. Кислородосодержащие соединения Химия в нашей жизни
Химия в нашей жизни Избыток, недостаток. Решение задач
Избыток, недостаток. Решение задач Процессы минералообразования
Процессы минералообразования Закономерности изменения окислительно-востановительных свойств соединений в периодах и группах
Закономерности изменения окислительно-востановительных свойств соединений в периодах и группах Получение и применение аренов
Получение и применение аренов Оксиды. Классификация оксидов
Оксиды. Классификация оксидов Лекция 6 Смазочные масла
Лекция 6 Смазочные масла Спирты. Тест
Спирты. Тест ОСОБЕННОСТИ СТРОЕНИЯ, РЕАКЦИОННОЙ СПОСОБНОСТИ И МЕТОДЫ СИНТЕЗА АЛКИНОВ
ОСОБЕННОСТИ СТРОЕНИЯ, РЕАКЦИОННОЙ СПОСОБНОСТИ И МЕТОДЫ СИНТЕЗА АЛКИНОВ Презентация на тему Химическая связь
Презентация на тему Химическая связь  Закалка и отпуск стали. Ознакомление со структурами серого и белого чугуна. Распознавание руд железа
Закалка и отпуск стали. Ознакомление со структурами серого и белого чугуна. Распознавание руд железа Сераорганические соединения
Сераорганические соединения Химическае препараты
Химическае препараты Срспальфа-олефинсульфанаттар
Срспальфа-олефинсульфанаттар Презентация по Химии "Строение и физические свойства металлов"
Презентация по Химии "Строение и физические свойства металлов"