Содержание
- 2. ЖИДКИЕ МЕТАЛЛЫ Важнейшим физико-химическим процессом при получении стальных слитков является переход стали из жидкого состояния в
- 3. Рентгеноструктурные исследования, а также исследования физико-химических свойств жидкости позволили установить, что жидкие металлы по своей структуре
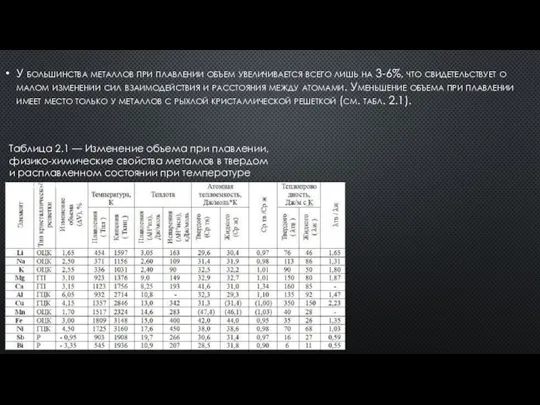
- 4. У большинства металлов при плавлении объем увеличивается всего лишь на 3-6%, что свидетельствует о малом изменении
- 5. На сохранение условий взаимодействия между атомами при плавлении металлов указывают значения теплоты плавления, которая у металлов
- 6. В настоящее время наибольшее распространение получили три основные теории строения металлических расплавов: теория “свободного объема”, теория
- 7. Теория свободного объема предполагает, что каждая молекула большую часть времени движется внутри ячейки, ограниченной соседними молекулами.
- 8. Теория дырок основана на допущении, что степень порядка в расположении атомов жидкости меньше чем у кристалла,
- 9. «Кластерная» модель жидкости предполагает, что наряду с ближним порядком в жидкости существуют значительно большие области упорядочения,
- 10. ТВЕРДЫЕ МЕТАЛЛЫ Все металлы и сплавы в твердом состоянии имеют кристаллическое строение. В отличие от некристаллических
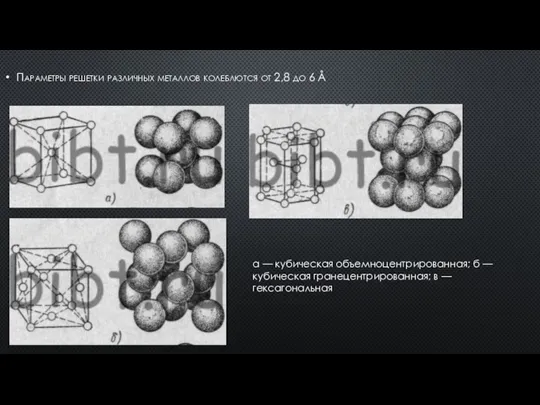
- 11. Параметры решетки различных металлов колеблются от 2,8 до 6 Å а — кубическая объемноцентрированная; б —
- 12. Для наглядного представления о расположении атомов в кристалле используют пространственные схемы в виде элементарных кристаллических ячеек.
- 13. Взаимное расположение атомов в пространстве, количество атомов в решетке и междуатомные пространства характеризуют свойства металла (электропроводность,
- 14. ЗОНАЛЬНАЯ ЛИКВАЦИЯ Ликвация — неоднородность химического состава литейного сплава в различных частях отливки, возникающая при ее
- 15. Зональная ликвация — химическая неоднородность в отдельных объемах отливки, т. е. различие химического состава в разных
- 17. Скачать презентацию












 Роль железа в жизни общества и в здоровье человека
Роль железа в жизни общества и в здоровье человека Биохимия витаминов и коферментов
Биохимия витаминов и коферментов Водород: знакомый и незнакомый. 9 класс
Водород: знакомый и незнакомый. 9 класс Изучение ТЭД и ОВР в школьном курсе химии
Изучение ТЭД и ОВР в школьном курсе химии Изомерия
Изомерия Электролитическая диссоциация
Электролитическая диссоциация Коррозия металлов
Коррозия металлов Композитные материалы
Композитные материалы Геометрия молекул
Геометрия молекул Презентация на тему Этиловый спирт и его влияние на здоровье человека
Презентация на тему Этиловый спирт и его влияние на здоровье человека  Алкены-2 (электрофильные реакции)
Алкены-2 (электрофильные реакции) Искусственные полимеры
Искусственные полимеры Алканы, алкены, алкины
Алканы, алкены, алкины Степень окисления
Степень окисления Разбор контрольной работы. Химия (9 класс)
Разбор контрольной работы. Химия (9 класс) Скорость химических реакций
Скорость химических реакций Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Идентификация С-конца ПП цепи
Идентификация С-конца ПП цепи Презентация на тему Кальций
Презентация на тему Кальций  Геохимические процессы в литосфере Земли и геобаротермометрия
Геохимические процессы в литосфере Земли и геобаротермометрия Стеариновая кислота
Стеариновая кислота Алюминий и его сплавы, их характеристика. Деформируемые сплавы алюминия. Деформируемые и литейные сплавы алюминия
Алюминий и его сплавы, их характеристика. Деформируемые сплавы алюминия. Деформируемые и литейные сплавы алюминия Презентация в 8 классе к уроку по химии на тему__
Презентация в 8 классе к уроку по химии на тему__ Неметаллические материалы
Неметаллические материалы 8. Изотопы. Ядерные реакции
8. Изотопы. Ядерные реакции Расчетная ячейка при МД моделировании. Граничные условия. Элементарная ячейка для атомов аргона
Расчетная ячейка при МД моделировании. Граничные условия. Элементарная ячейка для атомов аргона Диссоциация кислот
Диссоциация кислот Роль элементов 5 группы
Роль элементов 5 группы