Слайд 3БЕРИЛЛИЙ (Beryllium) Be – химический элемент II группы периодической системы Менделеева, атомный

номер 4, атомная масса 9,0122; легкий светло-серый металл. Имеет один стабильный изотоп 9Ве.
Слайд 4*Прежде всего несколько (их может быть гораздо больше!) ответов на вопрос: «Что

может нам дать бериллий?»... Самолет, вес которого вдвое меньше обычного; ...ракетное топливо с наивысшим удельным импульсом; ...пружины, способные выдержать до 20 миллиардов (!) циклов нагрузки – пружины, не знающие усталости, практически вечные.
*А в начале нашего века в справочниках и энциклопедиях о бериллии говорилось: «Практического применения не имеет». Открытый еще в конце XVIII в. бериллий 100 с лишним лет оставался «безработным» элементом, хотя химикам уже были известны его уникальные и очень полезные свойства. Для того чтобы эти свойства перестали быть «вещью в себе», требовался определенный уровень развития науки и техники. В 30-х годах академик А.Е. Ферсман называл бериллий металлом будущего. Сейчас о бериллии можно и должно говорить как о металле настоящего.
Слайд 5Бериллиесодержащие минералы известны с древности. Некоторые из них добывались на Синайском полуострове

еще в 17 в. до н.э. Название берилл встречается у греческих и латинских (Beryll) античных писателей. Сходство берилла и изумруда отмечал Плиний Старший: «Берилл, если подумать, имеет ту же природу, что и смарагд (изумруд), или, по крайней мере, очень похожую»
Слайд 6Бериллий был открыт в 1798. Французский кристаллограф и минералог Рене Жюст Гаюи

(1743–1822), отметив сходство твердости, плотности и внешнего вида зеленовато-голубых кристаллов берилла из Лиможа и зеленых кристаллов изумруда из Перу
Слайд 7Рене Жюст предложил французскому химику Никола Луи Воклену (1763–1829) проанализировать берилл и

изумруд, чтобы узнать, не являются ли они химически идентичными. В результате Воклен показал, что оба минерала содержат не только оксиды алюминия и кремния, как было известно и раньше, но также и новую «землю», которая очень напоминала оксид алюминия, но, в отличие от него, реагировала с карбонатом аммония и не давала квасцов. Именно этими свойствами Воклен и воспользовался для разделения оксидов алюминия и неизвестного элемента.
Слайд 8В виде простого вещества элемент, открытый Вокленом, впервые получил немецкий химик Фридрих

Вёлер (1800–1882) в 1828, восстанавливая хлорид бериллия калием:
BeCl2 + 2K = Be + 2KCl
Слайд 9Бериллий легко растворяется в разбавленных водных растворах кислот (соляной, серной, азотной), однако

холодная концентрированная азотная кислота пассивирует металл. Реакция бериллия с водными растворами щелочей сопровождается выделением водорода и образованием гидроксобериллатов:
Be + 2NaOH(р) + 2H2O = Na2[Be(OH)4] + H2
Слайд 10При проведении реакции с расплавом щелочи при 400–500° С образуются диоксобериллаты:
Be + 2NaOH(ж)

= Na2BeO2 + H2
Слайд 11Металлический бериллий быстро растворяется в водном растворе NH4HF2. Эта реакция имеет технологическое значение

для получения безводного BeF2 и очистки бериллия:
Be + 2NH4HF2 = (NH4)2[BeF4] + H2
Слайд 12Для выделения металлического бериллия его оксид или гидроксид сначала переводят в хлорид

или фторид. Металл получают электролизом расплавленных смесей хлоридов бериллия и щелочных элементов или действием магния на фторид бериллия при температуре около 1300° С:
BeF2 + Mg = MgF2 + Be
Слайд 13Смесь соединений радия и бериллия долгое время использовалась как удобный лабораторный источник

нейтронов, образующихся по ядерной реакции:
9Be + 4He = 12C + 1n
*В 1932 при использовании именно этой смеси английским физиком Джеймсом Чедвиком был открыт нейтрон.
Слайд 14С помощью бериллия улучшают качество поверхности деталей машин и механизмов. Для этого

готовое изделие выдерживают в порошке бериллия при 900–1000° С, и его поверхность делается тверже, чем у лучших сортов закаленной стали.
Слайд 15Еще одна важная область применения бериллия – в ядерных реакторах, так как
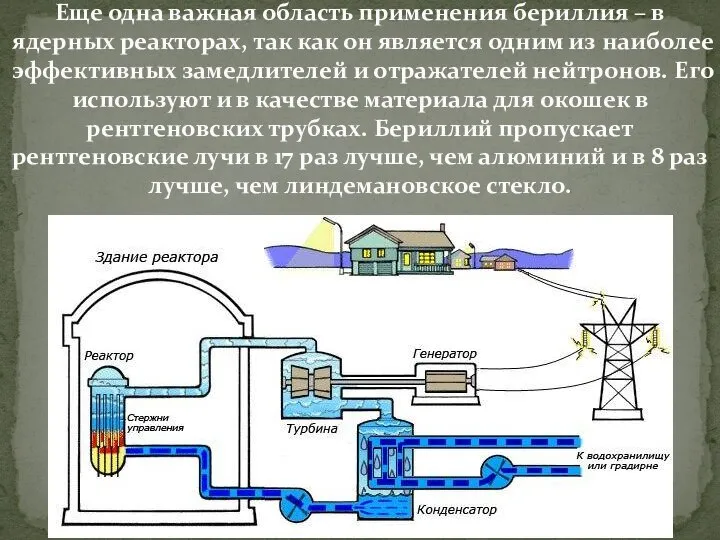
он является одним из наиболее эффективных замедлителей и отражателей нейтронов. Его используют и в качестве материала для окошек в рентгеновских трубках. Бериллий пропускает рентгеновские лучи в 17 раз лучше, чем алюминий и в 8 раз лучше, чем линдемановское стекло.
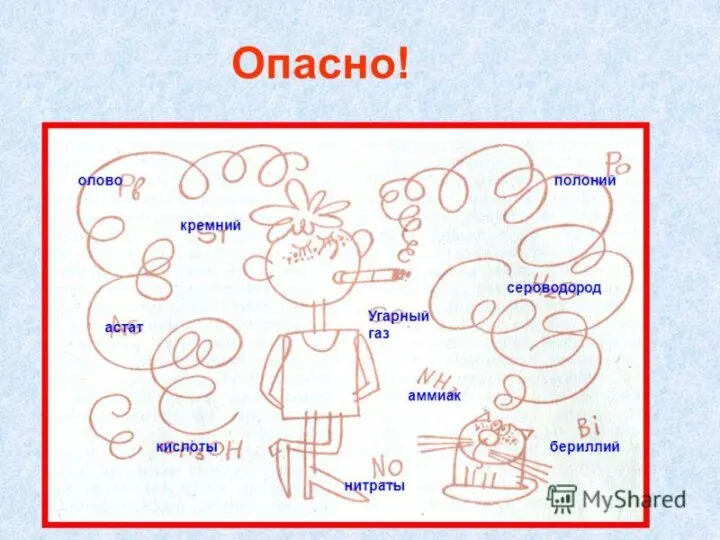
Слайд 17Бериллий не относится к биологически важным химическим элементам. В то же время,

повышенное содержание бериллия опасно для здоровья. Соединения бериллия очень ядовиты, особенно в виде пыли и дыма, обладают аллергическим и канцерогенным действием, раздражают кожу и слизистые оболочки. При попадании в легкие могут вызвать хроническое заболевание – бериллиоз (легочная недостаточность). Заболевания легких, кожи и слизистых оболочек могут возникнуть через 10–15 лет после прекращения контакта с бериллием.
Слайд 20ЧТО ТАКОЕ АЛЮМИНИЙ?
Лёгкий, прочный, стойкий к коррозии и функциональный – именно это

сочетание качеств сделало алюминий главным конструкционным материалом нашего времени. Алюминий есть в домах, в которых мы живем, автомобилях, поездах и самолетах, на которых мы преодолеваем расстояния, в мобильных телефонах и компьютерах, на полках холодильников и в современных интерьерах. А ведь еще 200 лет назад об этом металле мало что было известно.
Слайд 21Алюминий – серебристо-белый металл, 13-й элемент периодической таблицы Менделеева. Невероятно, но факт: алюминий

– самый распространенный металл на Земле, на него приходится более 8% всей массы земной коры, и это третий по распространенности химический элемент на нашей планете после кислорода и кремния.
Слайд 22Но каким бы распространенным ни был алюминий, его открытие стало возможным только,

когда в распоряжении ученых появился новый инструмент, позволяющий расщеплять сложные вещества на простые, – электрический ток.
Слайд 23И в 1824 году с помощью процесса электролиза датский физик Ханс Кристиан
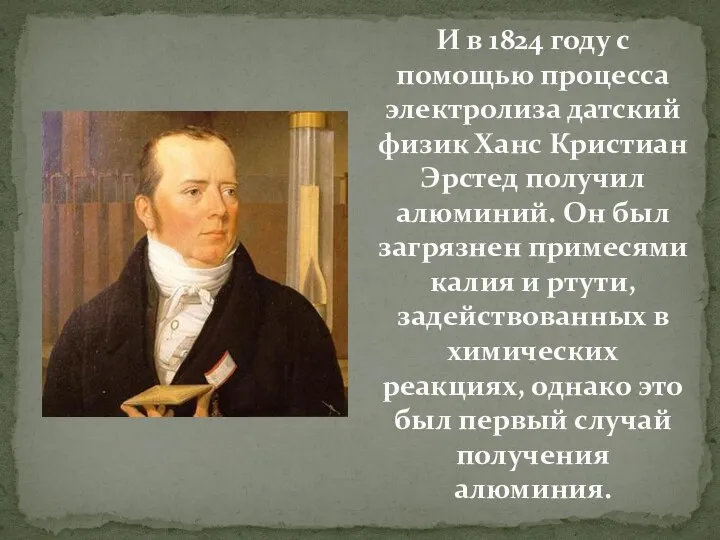
Эрстед получил алюминий. Он был загрязнен примесями калия и ртути, задействованных в химических реакциях, однако это был первый случай получения алюминия.
Слайд 24Алюминий имеет редкое сочетание ценных свойств. Это один из самых легких металлов

в природе: он почти в три раза легче железа, но при этом прочен, чрезвычайно пластичен и не подвержен коррозии, так как его поверхность всегда покрыта тончайшей, но очень прочной оксидной пленкой. Он не магнитится, отлично проводит электрический ток и образует сплавы практически со всеми металлами.
Слайд 25Самый известный пример – термитная смесь, при горении которой выделяется так много

тепла, что полученное железо расплавляется:
8Al + 3Fe3O4 = 4Al2O3 + 9Fe
Слайд 26Вытеснение алюминием из растворов солей менее активных металлов часто затруднено защитной пленкой

на поверхности алюминия. Эта пленка быстро разрушается хлоридом меди, поэтому легко идет реакция
3CuCl2 + 2Al = 2AlCl3 + 3Cu ,
которая сопровождается
сильным разогревом
Слайд 27В крепких растворах щелочей алюминий легко растворяется с выделением водорода:
2Al +

6NaOH + 6Н2О = 2Na3[Al(OH)6] +3H2
(образуются и другие анионные гидроксо-комплексы)
Слайд 28При сплавлении со щелочами образуются безводные алюминаты:
Al2O3 + 2NaOH = 2NaAlO2 + H2O

Слайд 29Галогениды алюминия в водных растворах имеют кислую реакцию из-за гидролиза:
AlCl3 +

H2O Al(OH)Cl2 + HCl
Слайд 30Устойчивый в отсутствие влаги при комнатной температуре гидрид AlH3 получают в растворе безводного

эфира:
AlCl3 + LiH = AlH3 + 3LiCl.
При избытке LiH образуется солеобразный алюмогидрид лития LiAlH4 – очень сильный восстановитель, применяющийся в органических синтезах. Водой он мгновенно разлагается:
LiAlH4 + 4H2O = LiOH + Al(OH)3 + 4H2




























 Кинетика химических и биохимических процессов. Часть 1
Кинетика химических и биохимических процессов. Часть 1 alkany_alkeny_alkiny_
alkany_alkeny_alkiny_ Строение атома. Строение электронных оболочек атомов
Строение атома. Строение электронных оболочек атомов Стехиометрические законы
Стехиометрические законы Химическая реакция в потоке в одномерном случае. Уравнение неразрывности
Химическая реакция в потоке в одномерном случае. Уравнение неразрывности Оксиды. Физические свойства
Оксиды. Физические свойства Предельные и непредельные углеводороды
Предельные и непредельные углеводороды Цинк и его применение (11 класс)
Цинк и его применение (11 класс) Декарбонизаторы. Декарбонизация
Декарбонизаторы. Декарбонизация Взаимодействие атомов элементов-неметаллов между собой
Взаимодействие атомов элементов-неметаллов между собой Витамины и коферменты
Витамины и коферменты Курсовая работа. Синтез адипиновой кислоты
Курсовая работа. Синтез адипиновой кислоты Химическое равновесие. Примеры
Химическое равновесие. Примеры Какую воду мы пьем
Какую воду мы пьем Презентация 1
Презентация 1 Химические реакции в органической химии
Химические реакции в органической химии Тренажер - Валентность. 8 класс
Тренажер - Валентность. 8 класс Вебинар. Задачи из домашек по 27-29 задачам
Вебинар. Задачи из домашек по 27-29 задачам Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Применение каучука
Применение каучука Гидролиз – это обменное взаимодействие веществ с водой, приводящее к их разложению
Гидролиз – это обменное взаимодействие веществ с водой, приводящее к их разложению Эксергетический баланс
Эксергетический баланс Кислород и водород. Сходства и различия
Кислород и водород. Сходства и различия Структура неорганических ионных соединений. Лекция 12
Структура неорганических ионных соединений. Лекция 12 Безопасная пластмасса
Безопасная пластмасса Закон сохранения массы веществ. Типы химических реакций
Закон сохранения массы веществ. Типы химических реакций Создание учебно-методических материалов по химии в современной форме (презентации уроков)
Создание учебно-методических материалов по химии в современной форме (презентации уроков) Окислительновосстановительные реакции в z природе и жизни человека
Окислительновосстановительные реакции в z природе и жизни человека