Слайд 2Алкины – непредельные углеводороды, общей формулы СnH2n-2, где n≥ 2, содержащие в
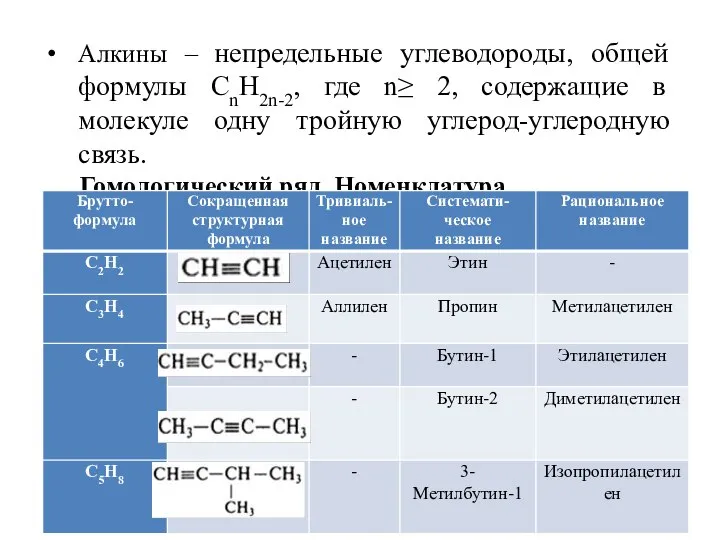
молекуле одну тройную углерод-углеродную связь.
Гомологический ряд. Номенклатура.
Слайд 3 Алкинильные радикалы
Изомерия
- изомерия углеродного скелета;
- изомерия положения кратной связи;
- межклассовая (с циклоалкенами

и алкадиенами);
- конформационная изомерия (вращение фрагментов молекулы возможно только относительно σ-связей);
- оптическая изомерия (при наличии в молекуле хирального центра).
Слайд 4Получение алкинов
Синтез из простых веществ (метод Бертло, XIX в):
Пиролиз алканов:
Карбонилирование водорода
катализатор

- слоистые соединения графита – С9FeCl3, KC10Н8)
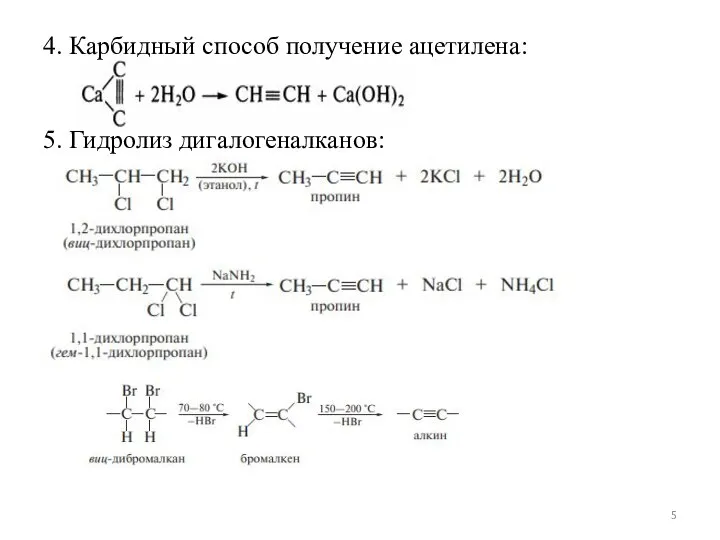
Слайд 54. Карбидный способ получение ацетилена:
5. Гидролиз дигалогеналканов:
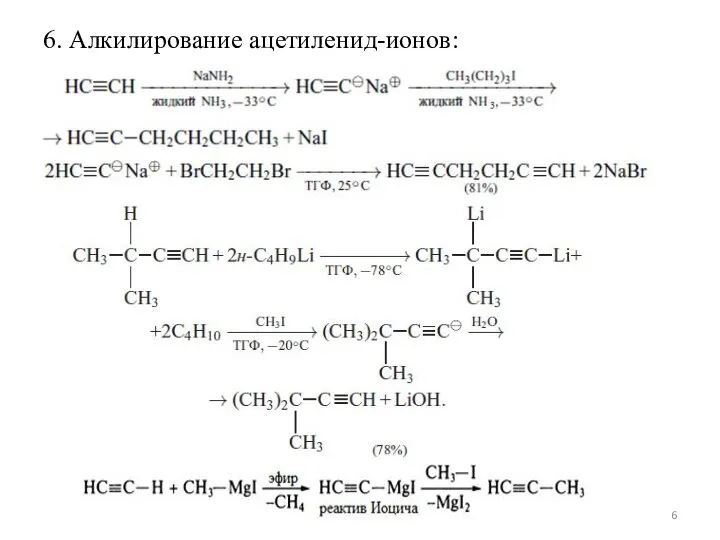
Слайд 66. Алкилирование ацетиленид-ионов:
Слайд 7Физические свойства
Первые представители ряда алкинов – ацетилен, пропин, бутин-1 – бесцветные газы.

Алкины с числом атомов углерода от С5 до С16, а также бутин-2 – жидкости, начиная с С17 – кристаллические вещества. По сравнению с алканами и алкенами температурные характеристики и относительная плотность у алкинов несколько выше. Алкины, подобно алканам и алкенам, нерастворимы в воде, но хорошо растворимы в малополярных органических растворителях – тетрахлорметане, бензоле, эфирах.
Слайд 8Строение алкинов
Атомы углерода при тройной связи в алкинах находятся в sp-гибридизации и
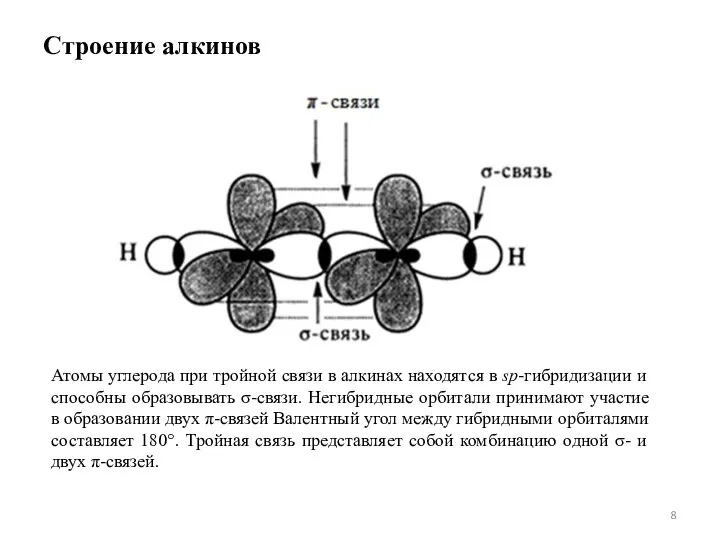
способны образовывать σ-связи. Негибридные орбитали принимают участие в образовании двух π-связей Валентный угол между гибридными орбиталями составляет 180°. Тройная связь представляет собой комбинацию одной σ- и двух π-связей.
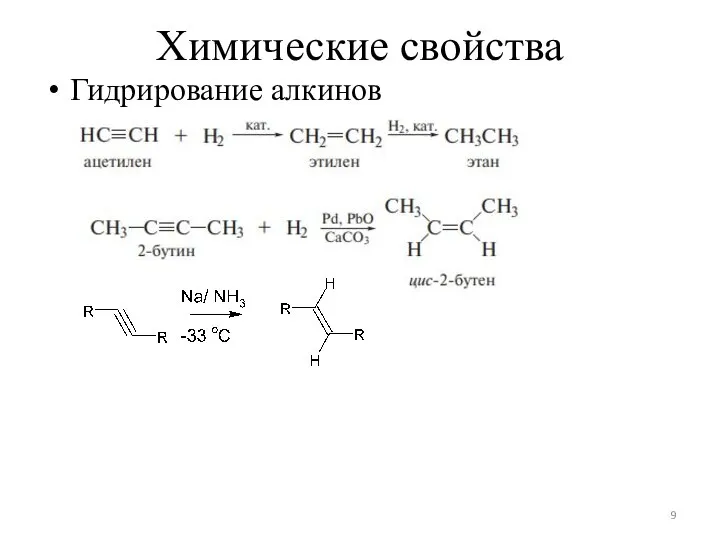
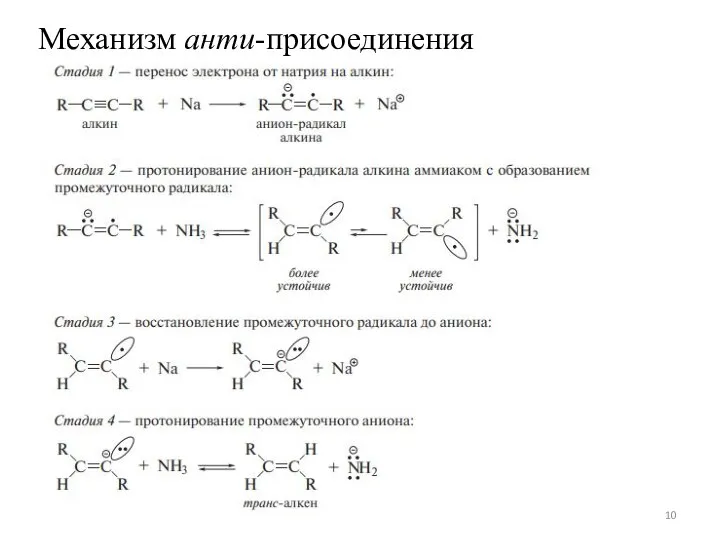
Слайд 9Химические свойства
Гидрирование алкинов
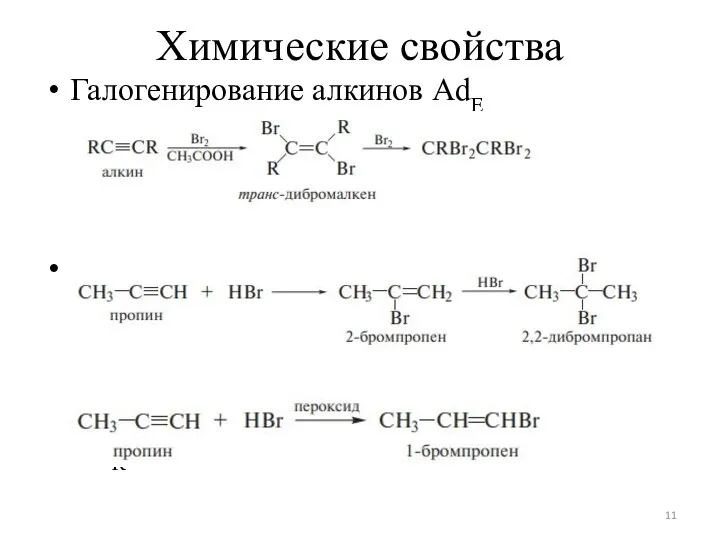
Слайд 11Химические свойства
Галогенирование алкинов AdЕ
Гидрогалогенирование алкинов AdЕ2
AdR
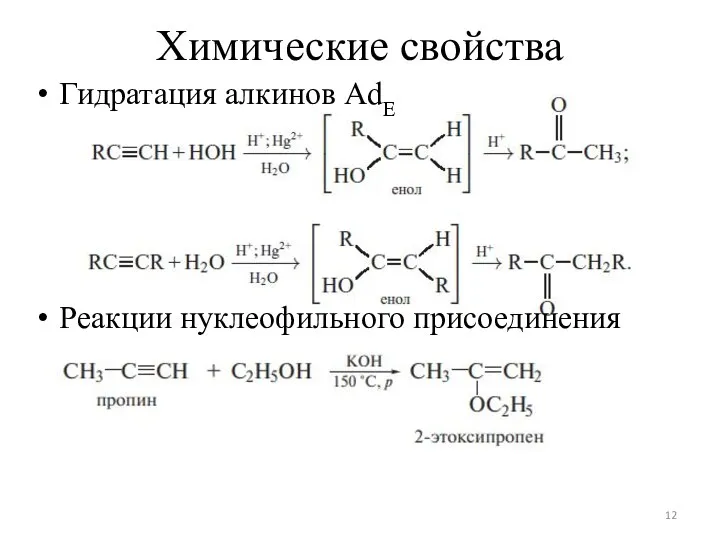
Слайд 12Химические свойства
Гидратация алкинов AdЕ
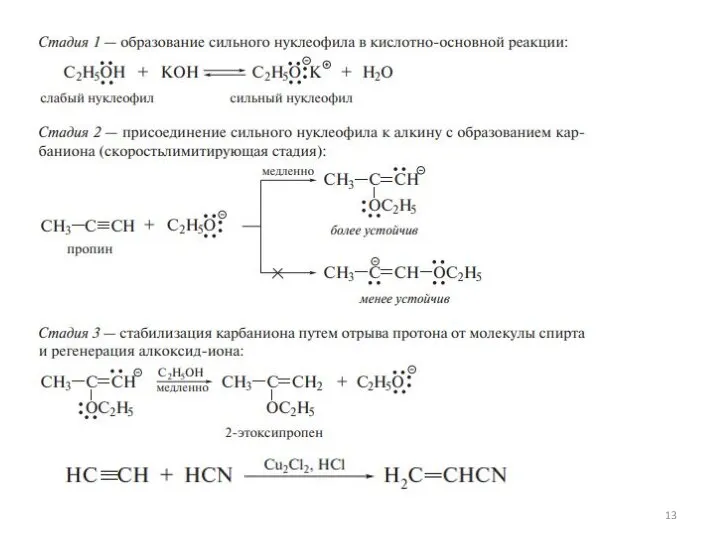
Реакции нуклеофильного присоединения
Слайд 14Химические свойства
Кислотные свойства алкинов

Слайд 15Химические свойства
Окисление алкинов
2С2Н2 + 5О2 4СО2 + 2Н2О + 1309,6 кДж/моль
2С2Н2 +

3О2 2С + 2СО2 + 2Н2О
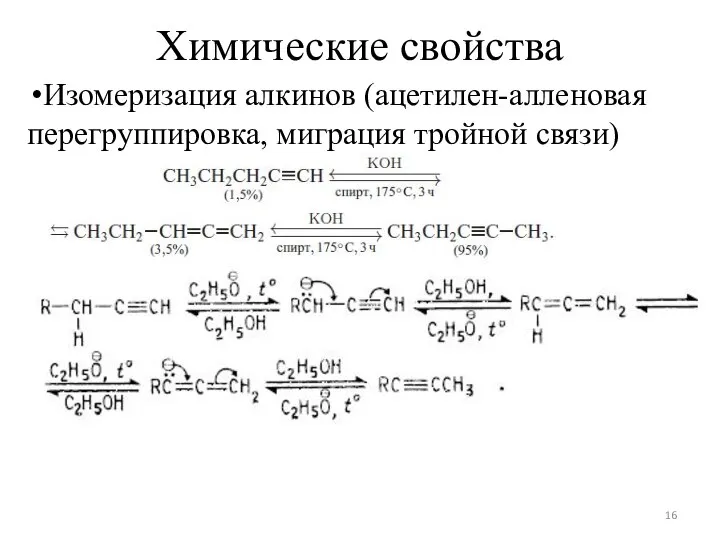
Слайд 16Химические свойства
Изомеризация алкинов (ацетилен-алленовая перегруппировка, миграция тройной связи)













 Вебинар. Гидролиз солей
Вебинар. Гидролиз солей Реакторы периодического действия. (Лекция 4)
Реакторы периодического действия. (Лекция 4) Углеводороды: изомерия
Углеводороды: изомерия Роль Хеуорса, Фишера, Лемье в изучении структуры углеводов
Роль Хеуорса, Фишера, Лемье в изучении структуры углеводов Химия дома
Химия дома Cкорость химических реакций
Cкорость химических реакций Взаимодействие частиц конденсированной фазы, их срастание (коалесценция). Лекция 3
Взаимодействие частиц конденсированной фазы, их срастание (коалесценция). Лекция 3 Галогены
Галогены Типы химических реакций в органической и неорганической химии
Типы химических реакций в органической и неорганической химии Дисперсные системы
Дисперсные системы Кислоты в химии
Кислоты в химии Ковалентная связь. Электроотрицательность
Ковалентная связь. Электроотрицательность Гидролиз солей
Гидролиз солей Строение атома
Строение атома Общие представления об электрохимических технологиях
Общие представления об электрохимических технологиях Текстуры руд
Текстуры руд Гордость земли Большемурашкинской: Владимир Васильевич Марковников
Гордость земли Большемурашкинской: Владимир Васильевич Марковников Алкан бутан (C4H10)
Алкан бутан (C4H10) Углеводы
Углеводы Взаимодействие элементов-неметаллов между собой. 8 класс
Взаимодействие элементов-неметаллов между собой. 8 класс Соединения азота
Соединения азота Сера
Сера Карбонат калия K2CO3
Карбонат калия K2CO3 Характеристика элемента по его положению в периодической системе
Характеристика элемента по его положению в периодической системе Химия – наука о веществах. Вычисления по химическим формулам. Тема 1
Химия – наука о веществах. Вычисления по химическим формулам. Тема 1 Химическое равновесие. Примеры
Химическое равновесие. Примеры Сульфиды
Сульфиды Вычисления по химическим формулам. Массовая доля элемента в соединении
Вычисления по химическим формулам. Массовая доля элемента в соединении