Содержание
- 2. «Строение и свойства алканов» Урок химии 10 класс Учитель химии Зобова О.Ф. МОУ «ОСОШ»
- 3. Творческие группы
- 4. Проблемные вопросы совместного проекта Где геологу найти алканы? Что общего между молекулой метана и пакетом молока
- 5. Вот что мы узнали!!!
- 6. Группа «Геологи» НАХОЖДЕНИЕ АЛКАНОВ В ПРИРОДЕ. МЕТАН образуется в природе в результате разложения без доступа воздуха
- 7. ЭТАН, ПРОПАН И БУТАН входят в состав природного и попутного нефтяного газов. АЛКАНЫ содержатся в нефти.
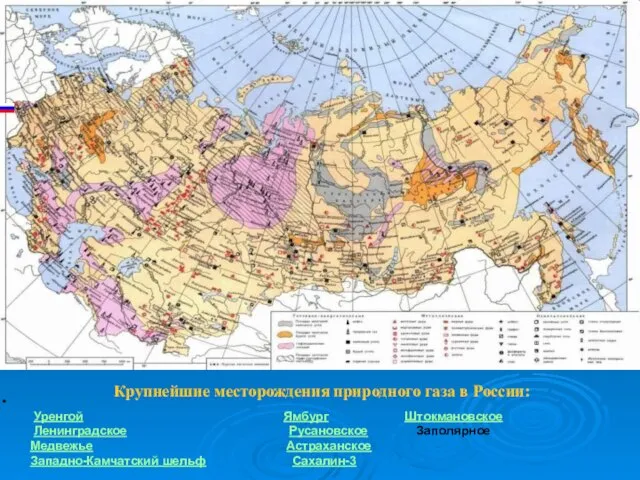
- 8. Крупнейшие месторождения природного газа в России: Уренгой Ямбург Штокмановское Ленинградское Русановское Заполярное Медвежье Астраханское Западно-Камчатский шельф
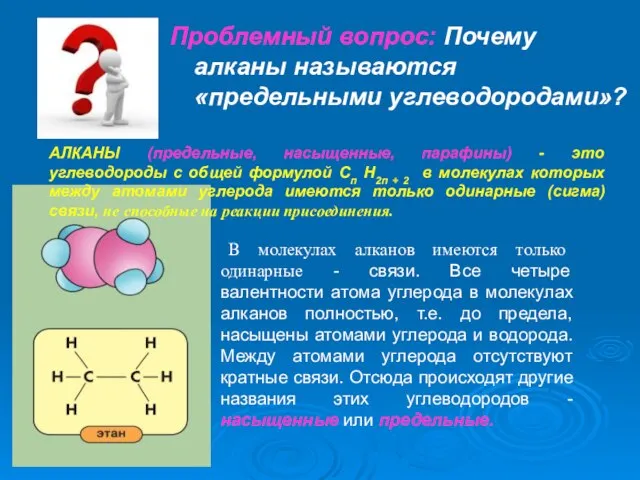
- 9. Проблемный вопрос: Почему алканы называются «предельными углеводородами»? АЛКАНЫ (предельные, насыщенные, парафины) - это углеводороды с общей
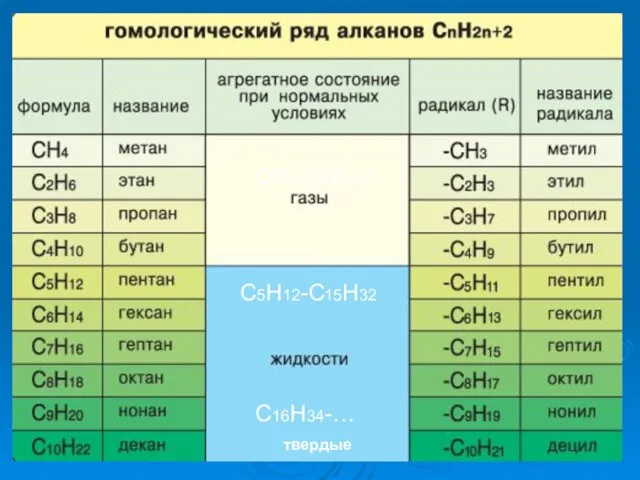
- 10. ГОМОЛОГИЧЕСКИЙ РЯД АЛКАНОВ Вспомните, какие вещества мы называем гомологами? ГОМОЛОГИ – это вещества со схожими строением
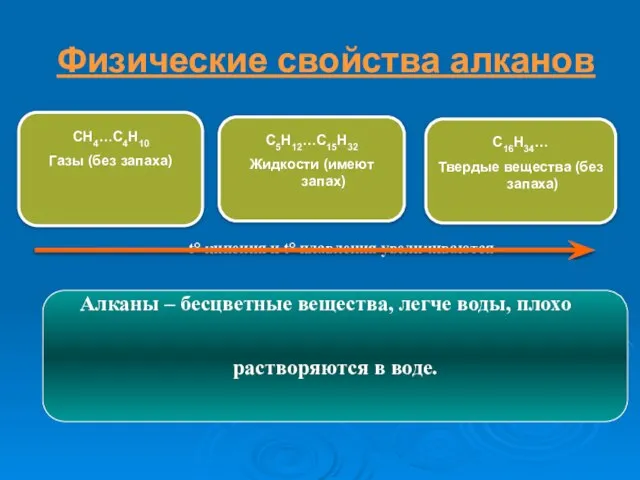
- 11. СН4-С4Н10 С5Н12-С15Н32 С16Н34-… твердые
- 12. Группа «Математики и физики». Проблема исследования: Выяснить, что общего между молекулой метана и пакетом молока?
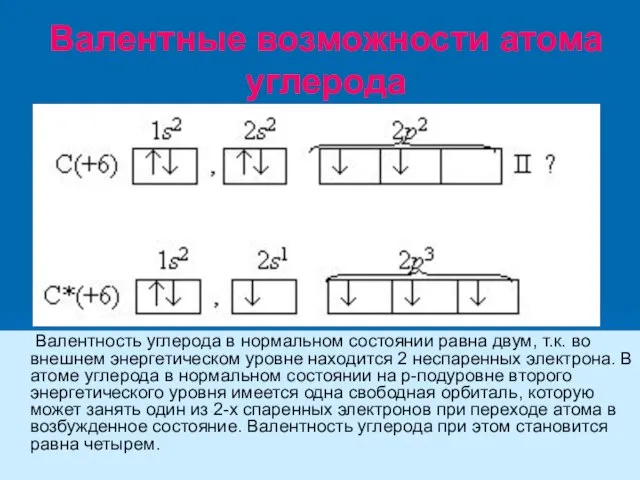
- 13. Валентные возможности атома углерода Валентность углерода в нормальном состоянии равна двум, т.к. во внешнем энергетическом уровне
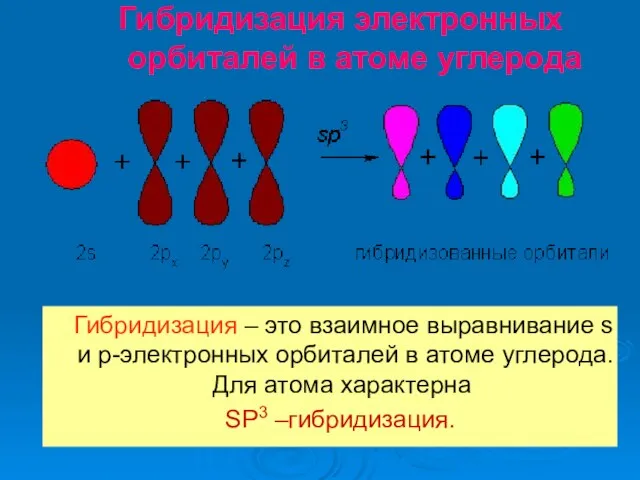
- 14. Гибридизация электронных орбиталей в атоме углерода Гибридизация – это взаимное выравнивание s и р-электронных орбиталей в
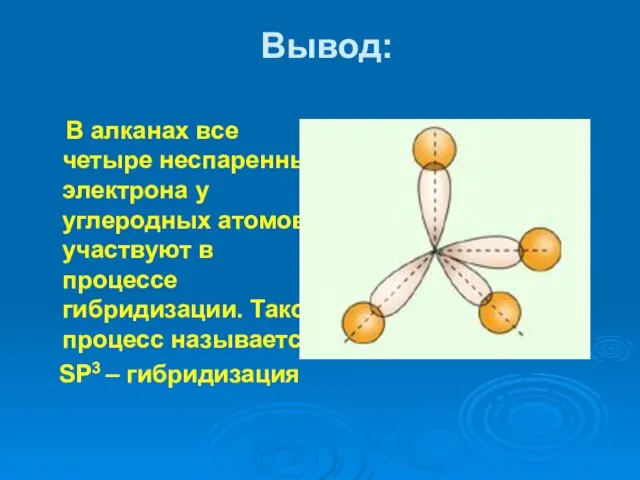
- 15. Вывод: В алканах все четыре неспаренных электрона у углеродных атомов участвуют в процессе гибридизации. Такой процесс
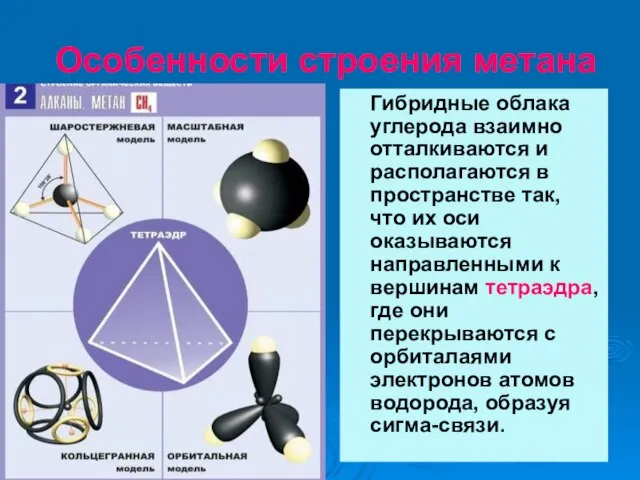
- 16. Особенности строения метана Гибридные облака углерода взаимно отталкиваются и располагаются в пространстве так, что их оси
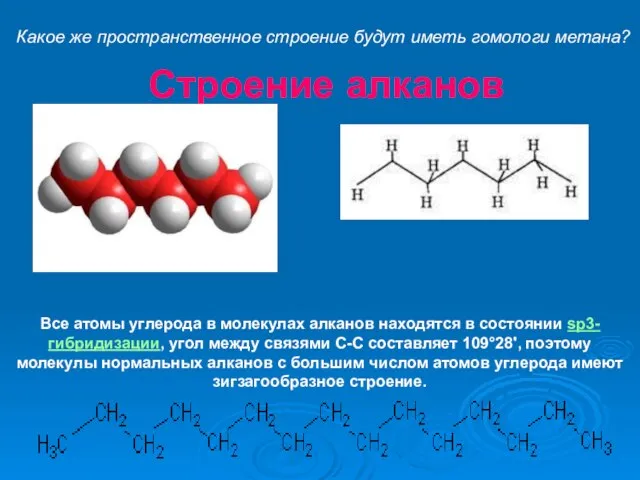
- 17. Строение алканов Все атомы углерода в молекулах алканов находятся в состоянии sр3-гибридизации, угол между связями С-C
- 18. Выводы: Тип гибридизации углерода в алканах определяет направление гибридных электронных облаков в пространстве к вершинам тетраэдра
- 19. Задание для учащихся: Пользуясь набором шаростержневых моделей составьте несколько молекул конформеров алканов. Обсудите результаты работы с
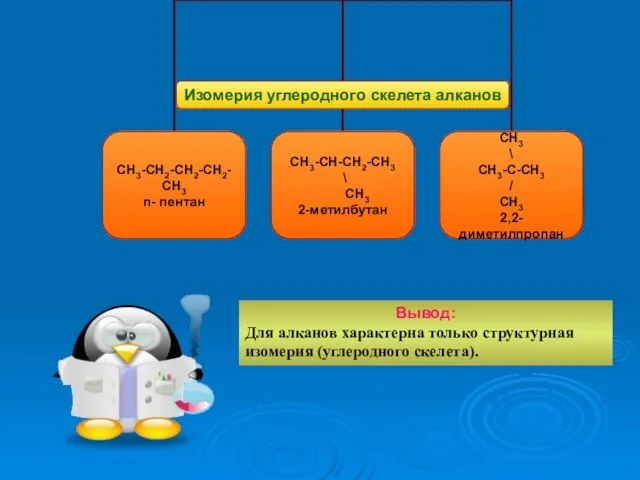
- 20. Вывод: Для алканов характерна только структурная изомерия (углеродного скелета).
- 21. C5H12…C15H32 Жидкости (имеют запах) t° кипения и t° плавления увеличиваются Алканы – бесцветные вещества, легче воды,
- 22. Номенклатура алканов 1. Выбирают наиболее длинную (главную) цепь и нумеруют ее ближе к тому концу, к
- 23. Группа «Химики» Химические свойства алканов Проблемный вопрос: Почему алканы считают химически инертными веществами?
- 24. NO2 CH3 CH CH3 + HNO3 CH3 C CH3 + H2O CH3 CH3 СН3 - СН3
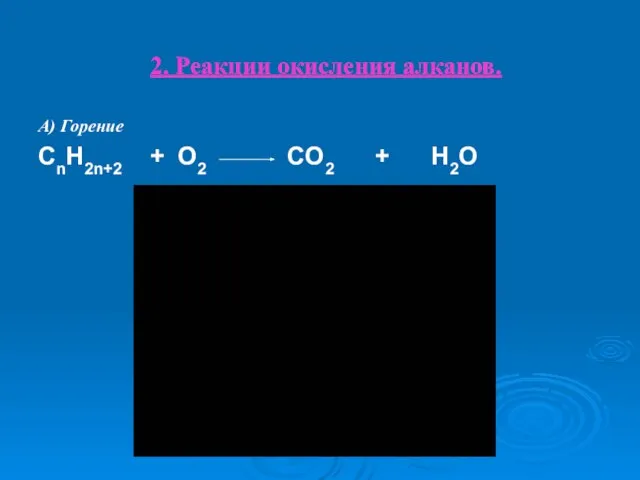
- 25. 2. Реакции окисления алканов. А) Горение CnH2n+2 + O2 CO2 + H2O
- 26. В промышленности широко применяется каталитическое окисление алканов, в результате которого получаются разнообразные кислородосодержащие соединения: спирты, карбоновые
- 27. 3. Реакции разложения алканов При сильном нагревании без доступа воздуха происходит полное разложение алканов на простые
- 28. 4. Отношение алканов к растворам перманганата калия и бромной воды. Чтобы отличить предельные углеводороды от непредельных
- 29. Вывод: Предельные углеводороды не вступают в реакции присоединения. Для них характерны реакции замещения , окисления и
- 30. Получение метана В промышленности: а) из природного газа; б) синтез из оксида углерода (II) и водорода
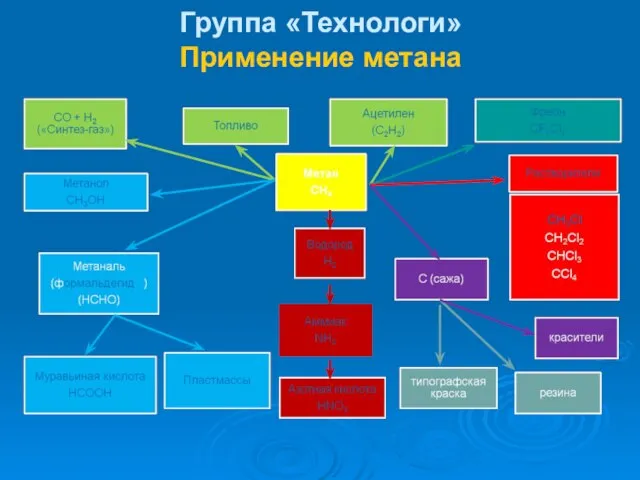
- 31. Группа «Технологи» Применение метана
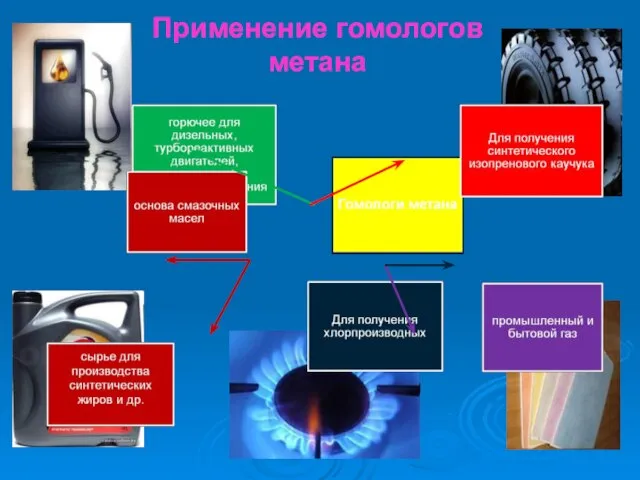
- 32. Применение гомологов метана
- 33. Группа «Экологи». О вреде алканов и их производных. Углеводороды при определенных метеорологических условиях активно способствуют образованию
- 34. Как алканы влияют на климат? Выделяемый из болот метан считается одним из основных парниковых газов и
- 35. Тест по теме «Алканы» Готовимся к ЕГЭ! 1.Гомологический ряд алканов описывается общей формулой а) СnH2n-2 б)
- 36. Взаимопроверка. Правильные ответы:
- 37. 2. Закончить уравнения, назвать получившиеся вещества, указать области их применения. а. C4H10 + O2 = б.
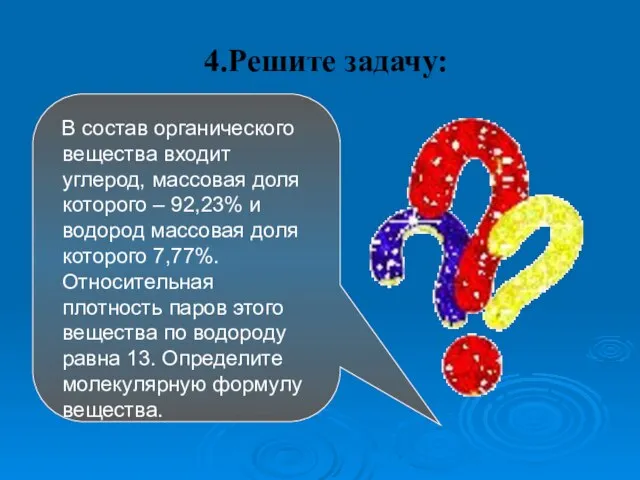
- 38. 4.Решите задачу: В состав органического вещества входит углерод, массовая доля которого – 92,23% и водород массовая
- 39. Рефлексия 5 4 3 Прием «Гора успеха!» Произведи самооценку и определи свое положение на «Горе успеха»
- 40. ДОМАШНЕЕ ЗАДАНИЕ: § 7-8 , упр. 13-17 (с. 28), задачи 1-2, ЕГЭ: 1.4.3. 1.4.4. Спасибо за
- 41. Используемая литература «Репетитор по химии (издание 15-ое)», под редакцией Егорова А. С., Феникс – Ростов-на-Дону, 2006
- 43. Скачать презентацию

























 Окислительно – восстановительные реакции (урок химии в 11 классе)
Окислительно – восстановительные реакции (урок химии в 11 классе) Введение в биохимию. Строение и свойства белков
Введение в биохимию. Строение и свойства белков Наука Химия на Великой Отечественной войне
Наука Химия на Великой Отечественной войне Альдегиды. Строение молекул
Альдегиды. Строение молекул Степень окисления в соединениях
Степень окисления в соединениях Вымораживание воды
Вымораживание воды Химическая связь
Химическая связь Алкены
Алкены Кристаллические решетки, вид связи и свойства веществ
Кристаллические решетки, вид связи и свойства веществ Материаловедение. Легированные стали и сплавы. (Тема 11)
Материаловедение. Легированные стали и сплавы. (Тема 11) Первый закон термодинамики. Термохимия
Первый закон термодинамики. Термохимия Homecredit Bank. Показатели и зоны роста
Homecredit Bank. Показатели и зоны роста Повторение по химии (8 класс)
Повторение по химии (8 класс) teoria_Butlerova
teoria_Butlerova Что такое эксперимент?
Что такое эксперимент? Предельные углеводороды (алканы)
Предельные углеводороды (алканы) Коллоидная химия
Коллоидная химия Ионная химическая связь
Ионная химическая связь Устойчивость коллоидных лиофобных дисперсных систем. Теория ДЛФО. Лекция 14
Устойчивость коллоидных лиофобных дисперсных систем. Теория ДЛФО. Лекция 14 Загрязнение почв пестицидами
Загрязнение почв пестицидами Полиамидное волокно-энант
Полиамидное волокно-энант Презентация на тему Теория электролитической диссоциации 8 класс
Презентация на тему Теория электролитической диссоциации 8 класс  Классификация реакций. Теория-кинетика
Классификация реакций. Теория-кинетика Химический анализ
Химический анализ Алкены. Решение задач и упражнений
Алкены. Решение задач и упражнений Высокомолекулярные соеденения
Высокомолекулярные соеденения Химическая Кинетика
Химическая Кинетика Химический эквивалент. Лекция 2
Химический эквивалент. Лекция 2