Содержание
- 2. Цель урока Изучить: строение молекулы аммиак; водородную связь на примере аммиака и как она повлияла на
- 3. Аммиак Аммиак (в европейских языках его название звучит как «аммониак») своим названием обязан оазису Аммона в
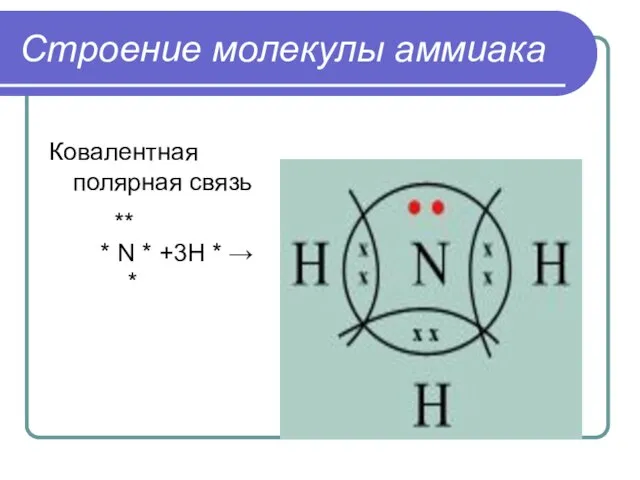
- 4. Строение молекулы аммиака Ковалентная полярная связь ** * N * +3H * → *
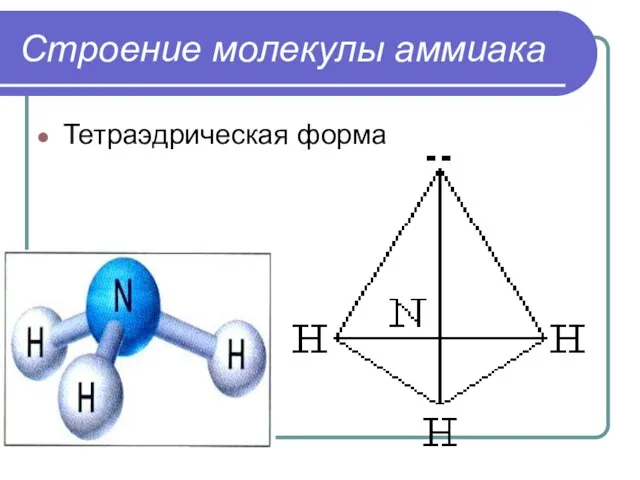
- 5. Строение молекулы аммиака Тетраэдрическая форма
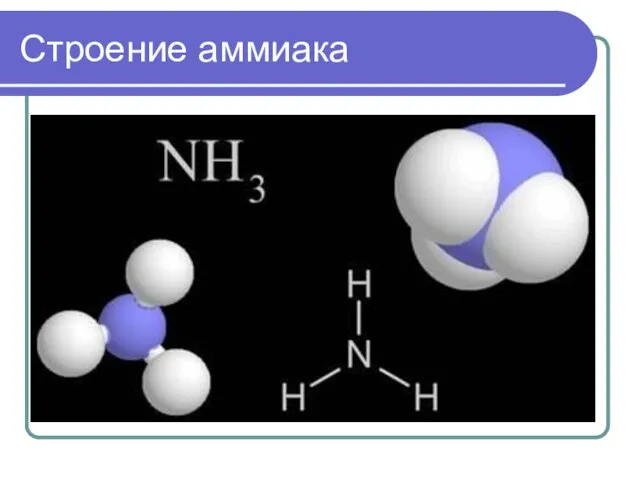
- 6. Строение аммиака
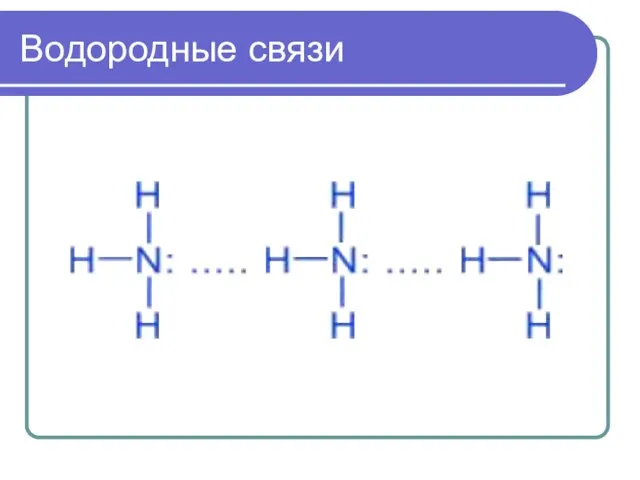
- 7. Водородные связи
- 8. Водородные связи Химическая связь между атомом водорода и атомами очень электроотрицательных элементов (фтора, хлора, азота, кислорода
- 9. Физические свойства -бесцветный газ, запах резкий, удушливый, ядовит, легче воздуха в два раза; t кип.= -33,40C;
- 10. Нельзя прикасаться к разлитому веществу, это может вызвать болезненный ожог кожных покровов. При утечке аммиака важно
- 11. Получение 1. Промышленный способ N2 + 3Н2 → 2NH3 (p=1000 атм; t= 5000C; kat = Fe
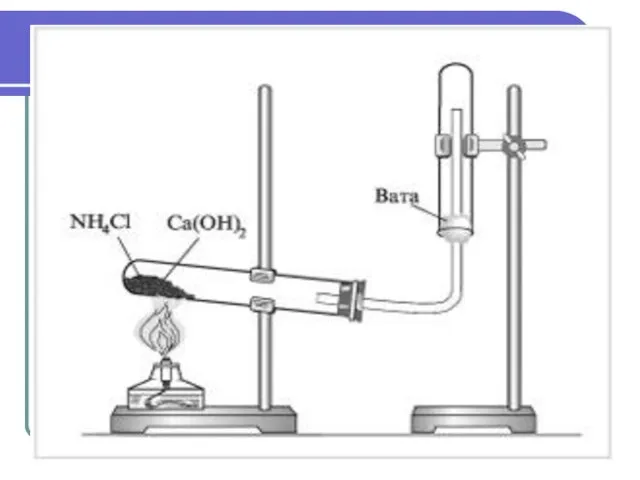
- 12. Получение Лабораторный способ. Нагревание солей аммония со щелочами. 2NH4Cl + Ca(OH)2→ CaCl2 + 2NH3↑+ 2Н2O (NH4)2SO4
- 14. Жидкий аммиак
- 15. Твердый аммиак
- 16. Химические свойства 1.Взаимодействие с водой NH3 + Н2O → NH4OH (гидроксид аммония) NH4OH →NH4+ + OH-
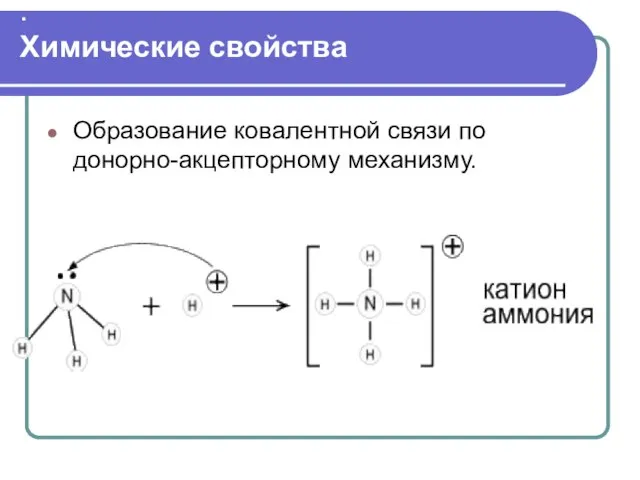
- 17. . Химические свойства Образование ковалентной связи по донорно-акцепторному механизму.
- 18. Химические свойства 2. С кислотами с образованием солей аммония. NH3 + HCl → NH4Cl (хлорид аммония,
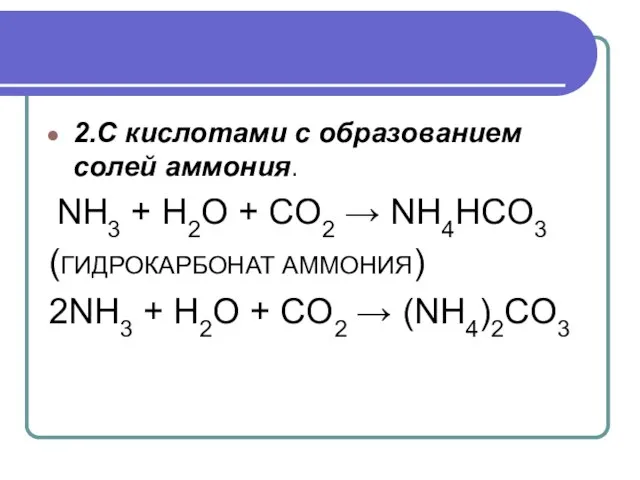
- 19. 2.С кислотами с образованием солей аммония. NH3 + H2O + CO2 → NH4HCO3 (ГИДРОКАРБОНАТ АММОНИЯ) 2NH3
- 20. Химические свойства 3.Разложение при нагревании 2NH3 → N2↑+ 3H2↑ 4.Восстановление оксидов некоторых металлов 3CuO +2NH3 →
- 21. 5. Горение в кислороде a)без катализатора 4NH3 + 3O2 →2 N2 ↑+ 6H2О
- 22. б)каталитическое окисление ( kat = Pt ) 4NH3 + 5O2 →4 NО+ 6H2О
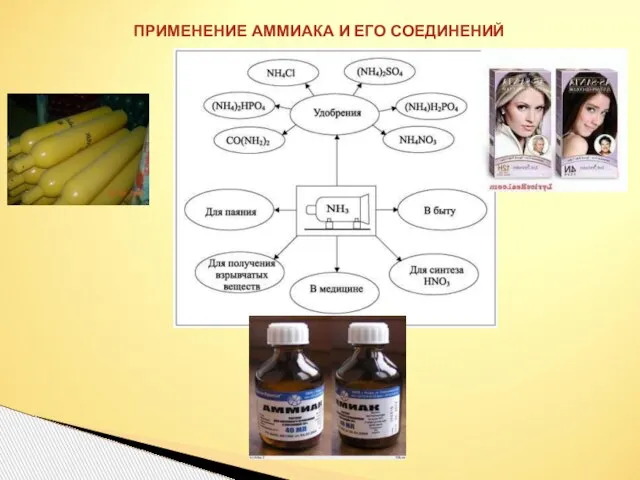
- 24. Применение Свойства
- 25. Чтоб продукты не пропали Вам поможет аммиак, И растениям, конечно, Аммиак совсем не враг. Если обморок
- 26. ПРИМЕНЕНИЕ АММИАКА И ЕГО СОЕДИНЕНИЙ
- 27. вывод Познакомились с водородной связью на примере аммиака; Изучили механизм образования иона аммония; Изучили физические и
- 28. Контроль по теме «Аммиак».Что узнали? 1 уровень 1)Аммиак ____________ растворяется в воде. 2)Раствор аммиака в воде
- 29. 2 уровень 1)Молекула аммиака имеет неподелённую электронную пару: А. Одну Б. Две В. Три Г. Пять
- 31. Скачать презентацию



















 Биологическое окисление
Биологическое окисление Основные диагностические признаки сапфира и его имитаций
Основные диагностические признаки сапфира и его имитаций Проект по химии. Минералы на нашей коже
Проект по химии. Минералы на нашей коже Химия и ее значение
Химия и ее значение Алкены (этиленовые углеводороды)
Алкены (этиленовые углеводороды) Основания
Основания Презентация на тему Углерод
Презентация на тему Углерод  Цинк и его применение (11 класс)
Цинк и его применение (11 класс) Презентация на тему Химия моя профессия
Презентация на тему Химия моя профессия  Водород, его общая характеристика, нахождение в природе и его свойства
Водород, его общая характеристика, нахождение в природе и его свойства Закономерности протеканий химических реакций
Закономерности протеканий химических реакций Вода
Вода Дистилляция (перегонка). 7 класс
Дистилляция (перегонка). 7 класс Инфракрасное электромагнитное излучение
Инфракрасное электромагнитное излучение Классы неорганических соединений
Классы неорганических соединений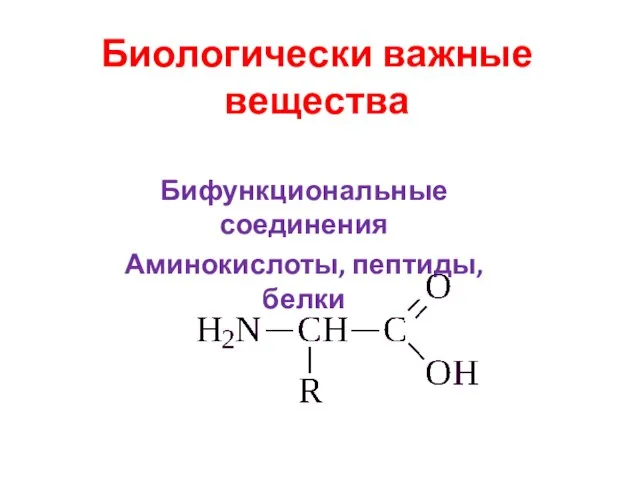 Биологически важные вещества. Бифункциональные соединения. Аминокислоты, пептиды, белки
Биологически важные вещества. Бифункциональные соединения. Аминокислоты, пептиды, белки Алюминий
Алюминий Расчеты по уравнениям химических реакций
Расчеты по уравнениям химических реакций Тест по теме Альдегиды и кетоны
Тест по теме Альдегиды и кетоны Презентация на тему Путешествие в мир химии
Презентация на тему Путешествие в мир химии  Проектная деятельность учащихся по химии
Проектная деятельность учащихся по химии Определение количества этилендиамина в соединении [Gd(en)x][Fe(CN)6]
Определение количества этилендиамина в соединении [Gd(en)x][Fe(CN)6] Очистка рабочих электродов
Очистка рабочих электродов Изменение химмотологических свойств цетанповышающей присадки в процессе хранения
Изменение химмотологических свойств цетанповышающей присадки в процессе хранения Металлы тоже воевали… 8 класс
Металлы тоже воевали… 8 класс Получение и свойства полиэтилена
Получение и свойства полиэтилена Оценка качества пищевой соли, реализуемой в розничной торговле
Оценка качества пищевой соли, реализуемой в розничной торговле Термореактивные пластмассы (реактопласты)
Термореактивные пластмассы (реактопласты)