Содержание
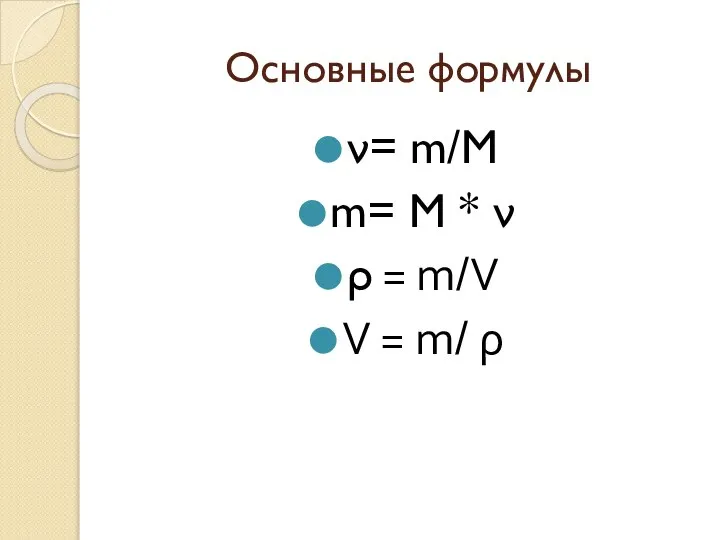
- 2. Основные формулы ν= m/M m= M * ν ρ = m/V V = m/ ρ
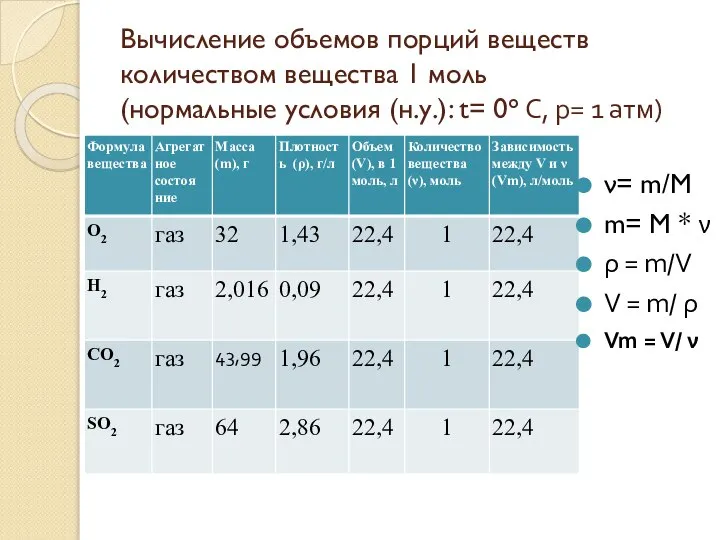
- 3. Вычисление объемов порций веществ количеством вещества 1 моль (нормальные условия (н.у.): t= 0° C, p= 1
- 4. Молярный объем газов Vm = V/ ν Vm= 22,4 л/моль Молярный объем газа – это объем
- 5. Закон Авогадро В равных объемах разных газов при одинаковых условиях содержится одинаковое число молекул.
- 6. Следствия из закона Авогадро: 1 моль любого газа при одинаковых условиях занимает один и тот же
- 8. Скачать презентацию



 Химическая связь
Химическая связь Презентация на тему Типы изомерии
Презентация на тему Типы изомерии  Презентация на тему Кремний
Презентация на тему Кремний  Строение электронных оболочек
Строение электронных оболочек Химические методы. Золь-гель метод
Химические методы. Золь-гель метод Липиды
Липиды Химия, химия, химия!
Химия, химия, химия! 3_Kislorodsoderzhaschie_kisloty_khlora
3_Kislorodsoderzhaschie_kisloty_khlora Минералы
Минералы Химическое расследование. Химические свойства галогенов
Химическое расследование. Химические свойства галогенов Презентация на тему Почему протекают химические реакции
Презентация на тему Почему протекают химические реакции  Введение в органическую химию
Введение в органическую химию Получение алканов
Получение алканов Подготовка учащихся 9 классов к ГИА по химии
Подготовка учащихся 9 классов к ГИА по химии Как уберечь себя от опасности на уроках химии
Как уберечь себя от опасности на уроках химии Презентация на тему Алюминий как химический элемент и как простое вещество
Презентация на тему Алюминий как химический элемент и как простое вещество  Сельскохозяйственная токсикология
Сельскохозяйственная токсикология Строение атома
Строение атома Повторение пройденного
Повторение пройденного Количество вещества
Количество вещества Гидролиз солей. Какие типы гидролиза возможны?
Гидролиз солей. Какие типы гидролиза возможны? Способы получения металлов
Способы получения металлов Органическая химия. Пищевые добавки
Органическая химия. Пищевые добавки Спирты. К кроссворду
Спирты. К кроссворду Галогениды, нитраты и сульфаты лантаноидов
Галогениды, нитраты и сульфаты лантаноидов Типы кристаллических решеток. Тест
Типы кристаллических решеток. Тест Полисульфидные каучуки
Полисульфидные каучуки 01_Osnovnye_ponyatia_i_zakony_khimii
01_Osnovnye_ponyatia_i_zakony_khimii