Содержание
- 2. Вещества Электролиты - вещества, растворы и расплавы которых не проводят электрический ток. Неэлектролиты - вещества, растворы
- 3. Неэлектролиты вещества, которые содержат ковалентные неполярные или малополярные связи. Эти связи не распадаются на ионы. газы,
- 4. Электролиты Вещества, которые содержат ионные и ковалентные полярные связи. Эти связи легко распадаются на ионы. Неорганические
- 5. Электролитическая диссоциация – процесс распада электролита на ионы при растворении его в воде или расплавлении
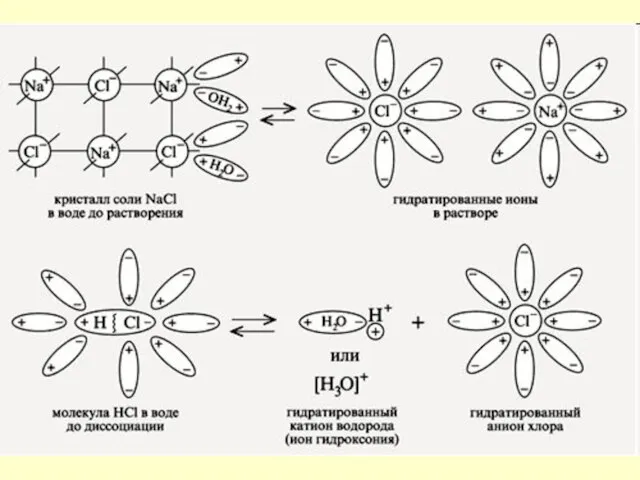
- 6. Вещества с ионной связью Кристаллическая решетка NaCl Кристалл NaCl
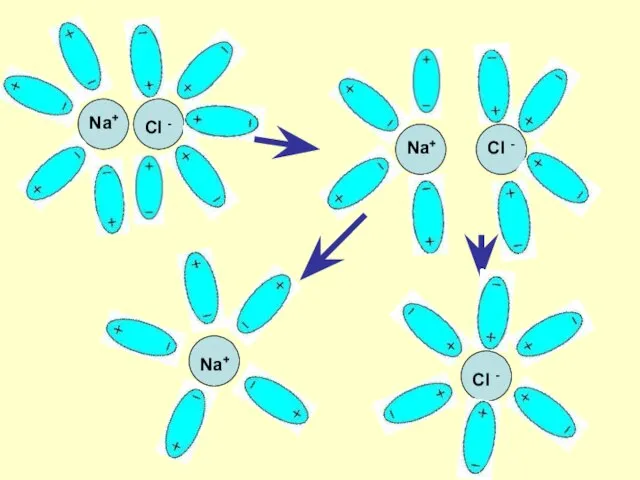
- 7. Механизм ЭД ионных веществ Ориентация диполей воды вокруг кристаллов соли. Образование между молекулами воды и ионами
- 8. Na+ Cl - Na+ Cl - Na+ Cl -
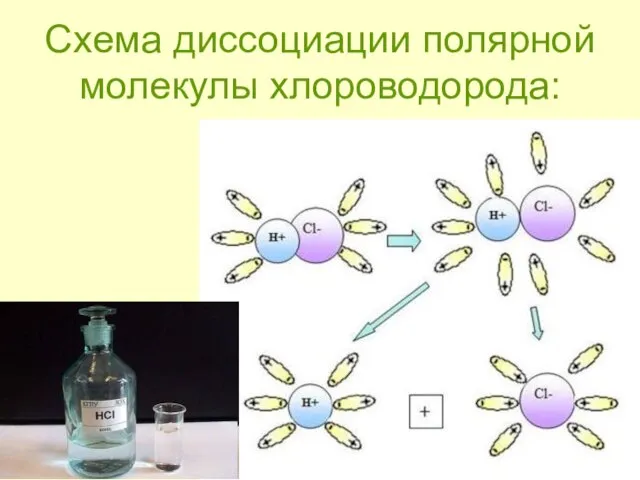
- 9. Механизм ЭД полярных веществ ориентация диполей воды вокруг полярной молекулы. еще большая поляризация полярной молекулы и
- 10. Схема диссоциации полярной молекулы хлороводорода:
- 11. Электролиты Сильные - при растворении в воде практически полностью распадаются на ионы. Слабые частично распадаются на
- 12. Сильные электролиты вещества с ионными или сильно полярными связями. все хорошо растворимые соли, сильные кислоты (HCl,
- 13. Слабые электролиты вещества с неполярными и малополярными связями: 1) почти все органические кислоты (CH3COOH, C2H5COOH и
- 14. Степень диссоциации Степень диссоциации (α) - отношение числа распавшихся на ионы молекул (n) к общему числу
- 15. Электролитическая диссоциация веществ, идущая с образованием свободных ионов объясняет электрическую проводимость растворов. CaCl2 = Ca2+ +
- 16. Диссоциация кислот осуществляется ступенчато. На каждой ступени отщепляется один ион водорода. H Cl = H+ +
- 17. Диссоциация оснований Ba(OH)2 = Ba2+ + 2OH- Сa(OH)2 = Сa2+ + 2OH- Основания - при диссоциации
- 18. Диссоциация солей Средние соли – соли, состоящие из атомов металла и кислотного остатка, диссоциируют в одну
- 19. Диссоциация солей Кислые соли – соли, в состав молекул которых кроме атомов металла входят атомы водорода,
- 20. Шведский ученый Сванте Аррениус(1859-1927) В 1887 году создал теорию ЭД. В 1903году был удостоен Нобелевской премии
- 21. Каблуков И.А. Кистяковский В.А.
- 22. Русские химики И.А.Каблуков и В.А.Кистяковский применили к объяснению электролитической диссоциации химическую теорию растворов Д.И.Менделеева и доказали,
- 23. Основные положения теории ЭД 1. Электролиты в водной среде (и в расплавленном состоянии) распадаются на положительно
- 25. Основные положения теории ЭД 2. Беспорядочное движение ионов в растворе под действием электрического поля становится направленным:
- 26. Основные положения теории ЭД 3. Диссоциация – обратимый процесс: параллельно с распадом молекул на ионы (диссоциацией)
- 27. 4. Степень электролитической диссоциации (a) зависит от природы электролита и растворителя, температуры и концентрации. Она показывает
- 28. Основные положения теории ЭД 5. Свойства ионов резко отличаются от свойств нейтральных атомов составляющих их элементов.
- 29. Источники информации: http://slovari.yandex.ru/ http://www.lyceum8.ru/himiya/4.htm http://900igr.net/fotografii/khimija/Dissotsiatsija/010-Mekhanizm-dissotsiatsii-veschestv.html http://him.1september.ru/2003/34/7.htm http://900igr.net/kartinki/khimija/Povarennaja-sol/059-K-r-i-s-t-a-l-l-y-g-a-l-i-t-a.html
- 31. Скачать презентацию

























 Увлекательный мир науки и практики
Увлекательный мир науки и практики Лакмусовые бумажки из сока краснокочанной капусты
Лакмусовые бумажки из сока краснокочанной капусты Распределение электронов в атомах
Распределение электронов в атомах Презентация на тему Дисперсные системы (11 класс)
Презентация на тему Дисперсные системы (11 класс)  Химическая связь
Химическая связь Аэрозоли и аэродисперсии
Аэрозоли и аэродисперсии К 180-летию со дня рождения Д.И. Менделеева
К 180-летию со дня рождения Д.И. Менделеева Генетическая связь между классами неорганических веществ
Генетическая связь между классами неорганических веществ Альдегиды и кетоны
Альдегиды и кетоны Основы химической кинетики
Основы химической кинетики Альдегиды. Свойства альдегидов
Альдегиды. Свойства альдегидов Создание учебно-методических материалов по химии в современной форме (презентации уроков)
Создание учебно-методических материалов по химии в современной форме (презентации уроков) Презентация на тему Карбонаты
Презентация на тему Карбонаты  Альдегиды. Строение молекул
Альдегиды. Строение молекул Гипертекст как средство развития познавательной активности учащихся на уроках химии Синицына Елена Александровна МОУ «Средняя
Гипертекст как средство развития познавательной активности учащихся на уроках химии Синицына Елена Александровна МОУ «Средняя  Аминобензой қышқылы және оның туындыларының синтезі, өндіру әдісі және физика-химиялық қасиеттері
Аминобензой қышқылы және оның туындыларының синтезі, өндіру әдісі және физика-химиялық қасиеттері Оксиды. Сложные вещества
Оксиды. Сложные вещества Кальций как химический элемент
Кальций как химический элемент Использование культурологического компонента на уроках химии
Использование культурологического компонента на уроках химии Изотопы. Области применения изотопов
Изотопы. Области применения изотопов Фосфор в организме человека
Фосфор в организме человека Зависимость скорости от температуры
Зависимость скорости от температуры Легированные стали
Легированные стали Получение функциональных плёнок на основе TiO2
Получение функциональных плёнок на основе TiO2 Алюминий. 9 класс
Алюминий. 9 класс Алюминийорганические соединения
Алюминийорганические соединения Тест по химии. ГИА
Тест по химии. ГИА Химия и косметика
Химия и косметика