Содержание
- 2. Общие химические свойства металлов
- 3. Цель урока: систематизировать знания об общих химических свойствах металлов и их восстановительных способностях
- 4. Увеличение восстановительных свойств Электрохимический ряд напряжения металлов
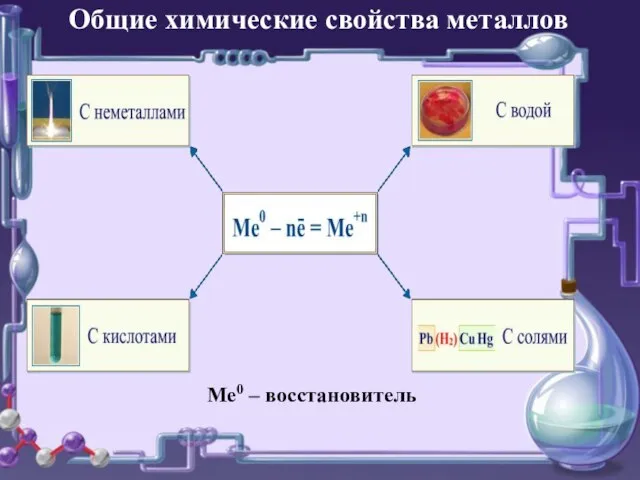
- 5. Ме0 – восстановитель Общие химические свойства металлов
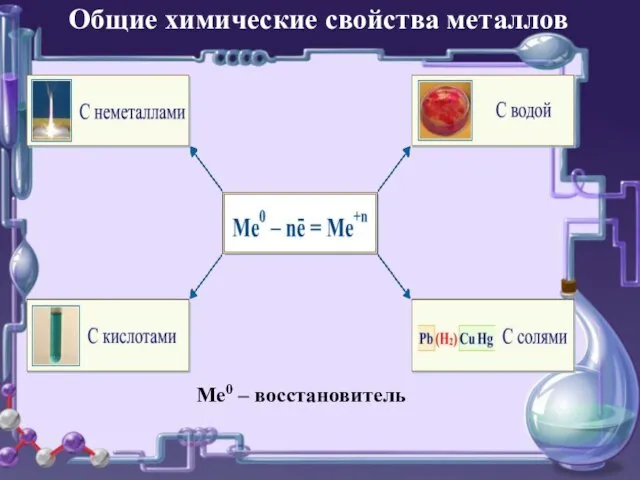
- 6. Взаимодействие металлов с неметаллами
- 7. Взаимодействие металлов с водой
- 8. Взаимодействие металлов с кислотами
- 9. Взаимодействие металлов с солями
- 10. Изучение реакции взаимодействия металлов с водой Группа 1 Na H2O Выделение водорода
- 11. Изучение реакции взаимодействия металлов с кислотами Группа 2 Mg Fe Cu Выделение водорода
- 12. Изучение реакции взаимодействия металлов с солями Группа 3 CuSO4 Fe Изменение цвета
- 13. Изучение реакций алюминия со щелочью и кислотой Группа 4 AL NaOH HCL Выделение водорода
- 14. Какие реакции практически осуществимы?
- 15. Проверка
- 16. Ме0 – восстановитель Общие химические свойства металлов
- 17. Рефлексия Сделай вывод:
- 18. Оценка работы в группе «5» - задания выполнены полностью, в соответствии с маршрутной картой «4» -
- 19. «Химии никоим образом научиться невозможно, не видав самой практики и не принимаясь за химические операции» (М.
- 21. Скачать презентацию
















 Органическая химия: пищевые добавки
Органическая химия: пищевые добавки Сложные эфиры
Сложные эфиры Енергетика хімічних реакцій
Енергетика хімічних реакцій Chimie bioorganique
Chimie bioorganique Неметаллы. Обобщение и систематизация знаний
Неметаллы. Обобщение и систематизация знаний Закон сохранения массы. 11 класс
Закон сохранения массы. 11 класс Металлы
Металлы Электролитическая диссоциация
Электролитическая диссоциация Синтез-газ
Синтез-газ Презентация по Химии "Быль о каучуке"
Презентация по Химии "Быль о каучуке"  Соли: классификация, получение, номенклатура
Соли: классификация, получение, номенклатура Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Структура неорганических ионных соединений. Лекция 12
Структура неорганических ионных соединений. Лекция 12 Алканы. Циклоалканы
Алканы. Циклоалканы Химическая связь. Урок-упражнение
Химическая связь. Урок-упражнение Обобщить и систематизировать знания учащихся о кислотах неорганических и органических, о их составе и свойствах
Обобщить и систематизировать знания учащихся о кислотах неорганических и органических, о их составе и свойствах Аминокислоты
Аминокислоты Изучение основных породообразующих минералов горных пород. Лабораторная работа №1
Изучение основных породообразующих минералов горных пород. Лабораторная работа №1 Кислоты. Домашнее задание
Кислоты. Домашнее задание Водород – первый элемент в периодической таблице
Водород – первый элемент в периодической таблице Оксиды и их свойства
Оксиды и их свойства Органическая химия. Теория строения органических веществ
Органическая химия. Теория строения органических веществ Неорганические основания
Неорганические основания Мастер - класс: Окислительно-восстановительные реакции
Мастер - класс: Окислительно-восстановительные реакции Углерод. Положение в ПС и особенности строения атома
Углерод. Положение в ПС и особенности строения атома Введение в химию. Вещества. Факультатив по химии для учащихся 7 класса
Введение в химию. Вещества. Факультатив по химии для учащихся 7 класса Закон Гесса. Термохимические уравнения
Закон Гесса. Термохимические уравнения Периодическая система Д.И.Менделеева
Периодическая система Д.И.Менделеева