Содержание
- 2. Органическая химия Лекции для студентов, обучающихся по специальности «Биоинженерия и биоинформатика» Профессор кафедры химии Института Фармации
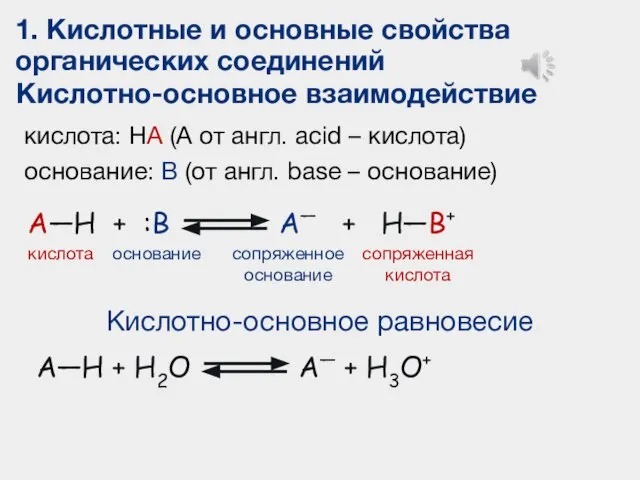
- 3. Кислотность и основность органических соединений
- 4. 1. Кислотные и основные свойства органических соединений ПРОТОЛИТИЧЕСКАЯ ТЕОРИЯ (Теория Брёнстеда-Лоури) По теории Брёнстеда–Лоури кислотой называют
- 5. 1. Кислотные и основные свойства органических соединений Кислотно-основное взаимодействие A—H + :B кислота основание сопряженное основание
- 6. Количественные характеристики Константа равновесия Kp Kp = [A—] [H3O+] [AH] [H2O] Константа кислотности Ka Ka =
- 7. 1. Кислотные и основные свойства органических соединений Количественные характеристики pKa = -lgKa pKВН+ Чем больше значение
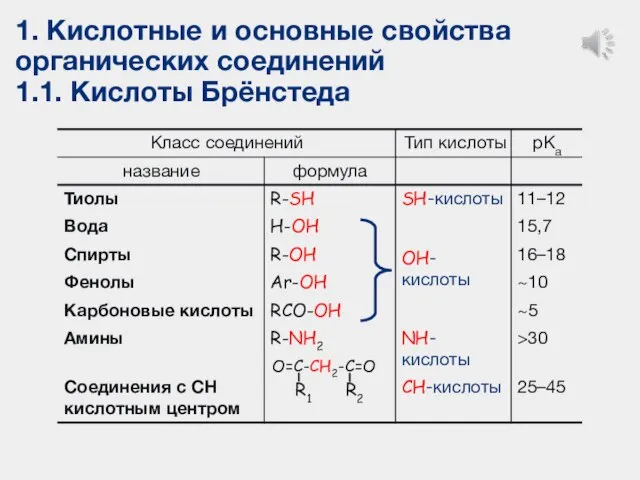
- 9. 1. Кислотные и основные свойства органических соединений 1.1. Кислоты Брёнстеда
- 11. 1. Кислотные и основные свойства органических соединений 1.1. Кислоты Брёнстеда Качественная оценка силы кислот CH3COOH +
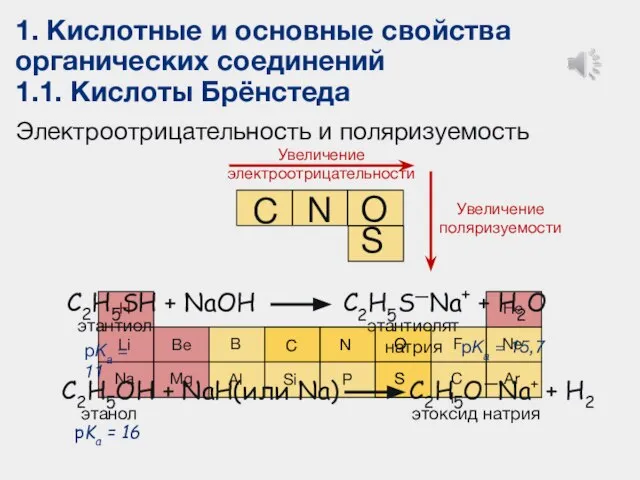
- 12. 1. Кислотные и основные свойства органических соединений 1.1. Кислоты Брёнстеда Электроотрицательность и поляризуемость Увеличение электроотрицательности O
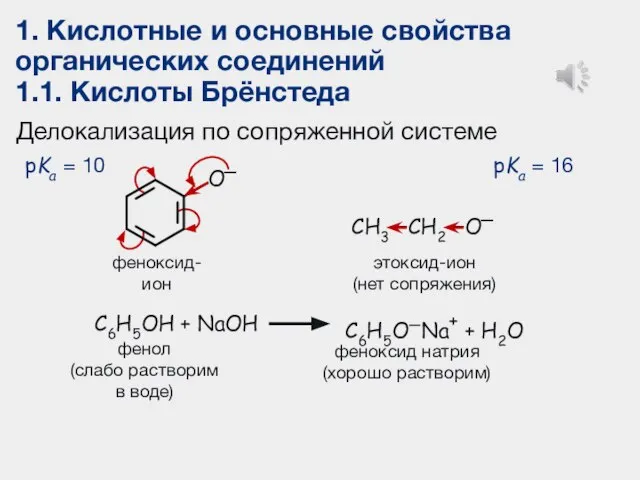
- 13. 1. Кислотные и основные свойства органических соединений 1.1. Кислоты Брёнстеда Делокализация по сопряженной системе феноксид-ион этоксид-ион
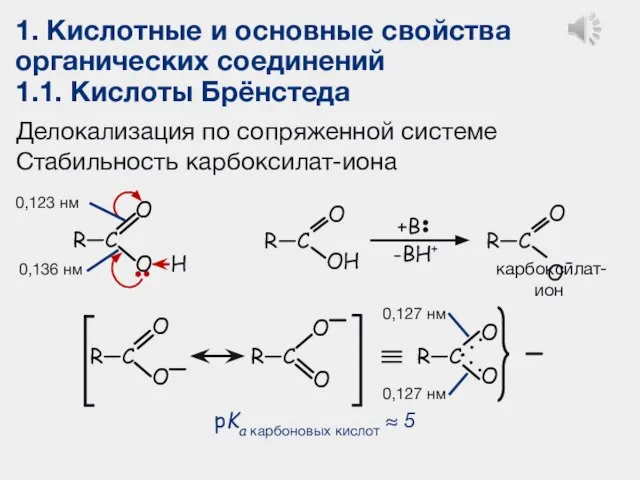
- 14. 1. Кислотные и основные свойства органических соединений 1.1. Кислоты Брёнстеда Делокализация по сопряженной системе Стабильность карбоксилат-иона
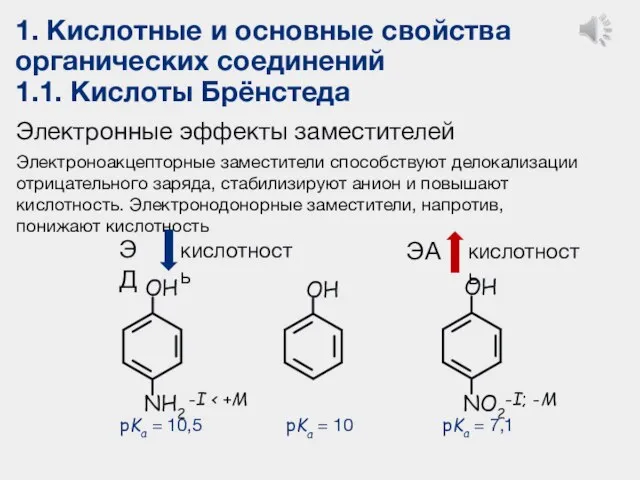
- 15. 1. Кислотные и основные свойства органических соединений 1.1. Кислоты Брёнстеда Электронные эффекты заместителей Электроноакцепторные заместители способствуют
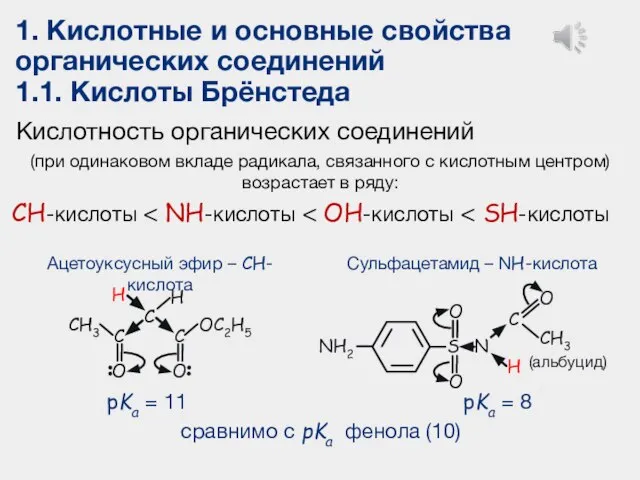
- 16. 1. Кислотные и основные свойства органических соединений 1.1. Кислоты Брёнстеда Кислотность органических соединений (при одинаковом вкладе
- 17. Эффект сольватации При сольватации иона происходит перераспределение заряда с участием окружающих его молекул растворителя. Поскольку всю
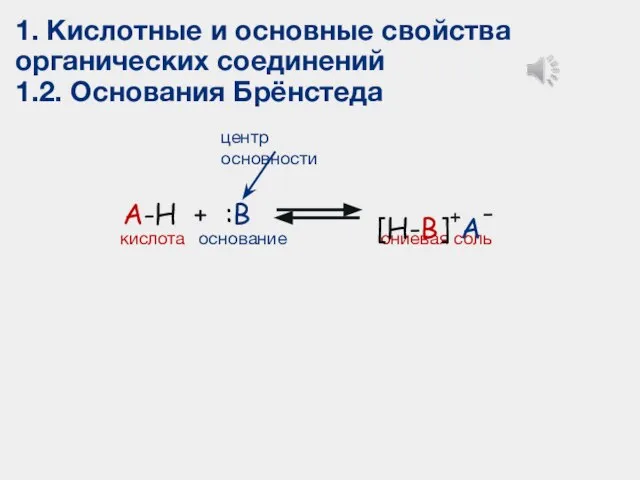
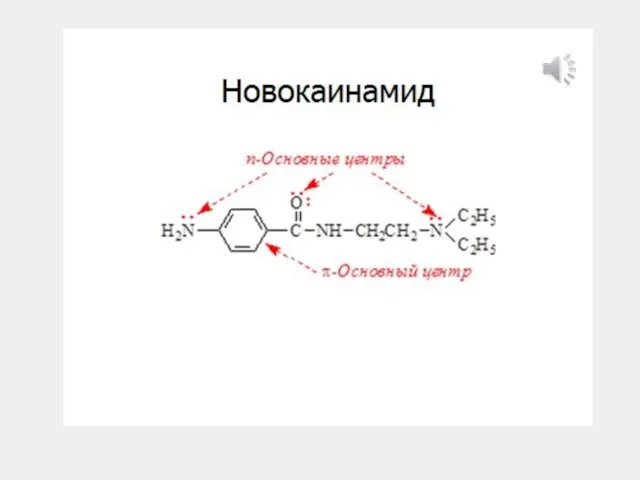
- 19. 1. Кислотные и основные свойства органических соединений 1.2. Основания Брёнстеда A-H + :B кислота основание ониевая
- 20. H 1. Кислотные и основные свойства органических соединений 1.2. Основания Брёнстеда аммониевые ROR + оксониевые сульфониевые
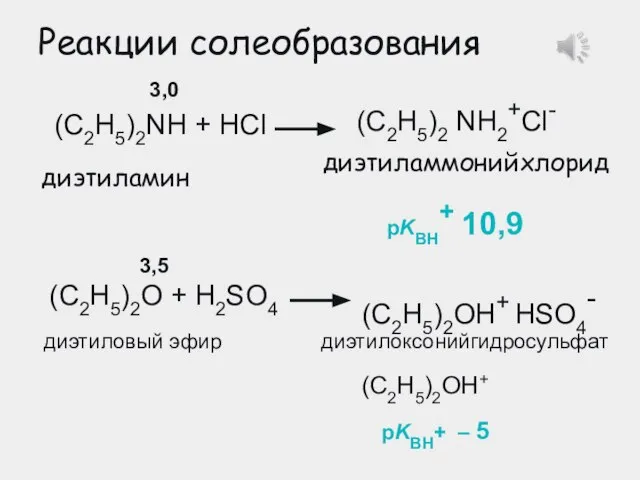
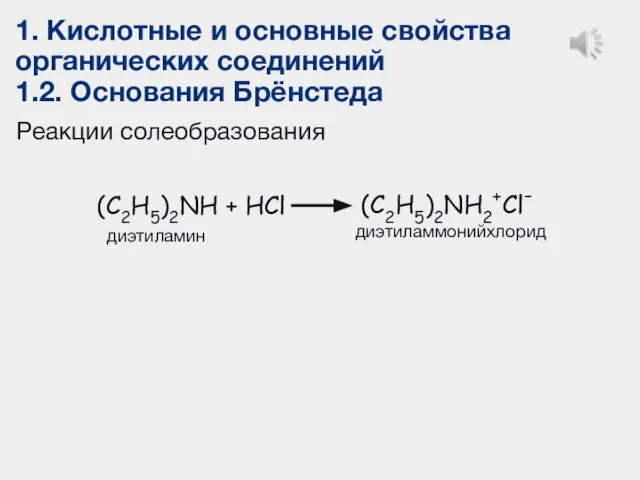
- 22. Реакции солеобразования диэтиламмонийхлорид (C2H5)2NH + HCl (C2H5)2 NH2+Cl- диэтиламин (C2H5)2О + H2SO4 (C2H5)2ОH+ HSO4- диэтиловый эфир
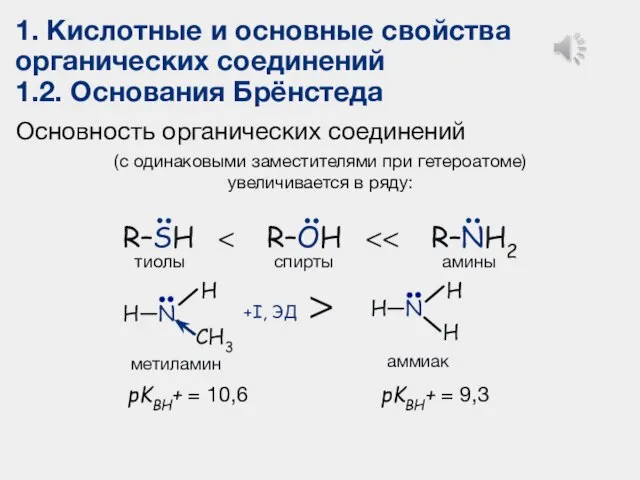
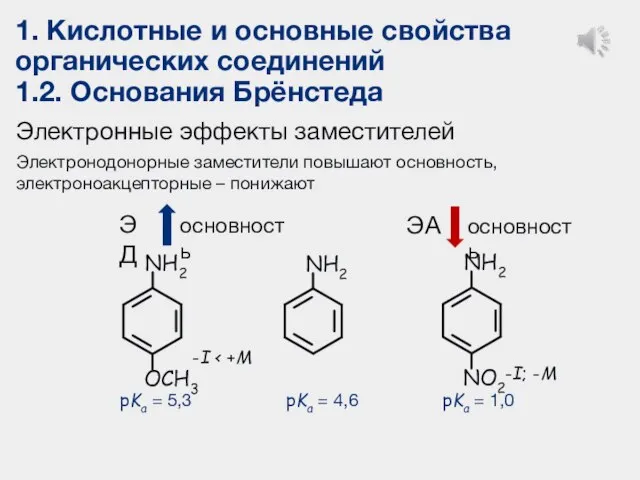
- 23. 1. Кислотные и основные свойства органических соединений 1.2. Основания Брёнстеда Основность органических соединений (с одинаковыми заместителями
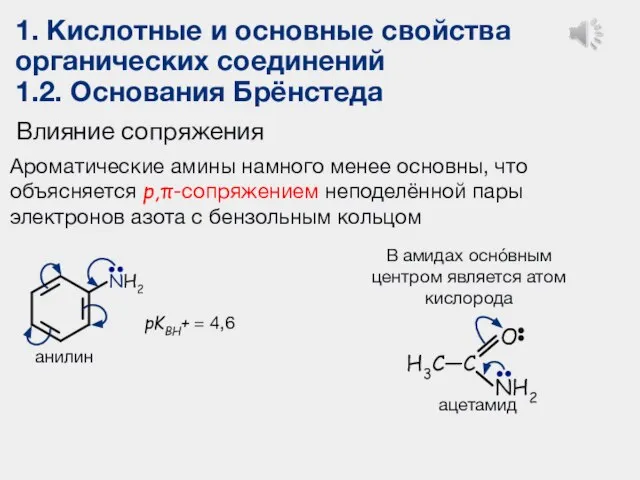
- 24. 1. Кислотные и основные свойства органических соединений 1.2. Основания Брёнстеда Влияние сопряжения Ароматические амины намного менее
- 25. 1. Кислотные и основные свойства органических соединений 1.2. Основания Брёнстеда Реакции солеобразования диэтиламмонийхлорид (C2H5)2NH + HCl
- 26. 1. Кислотные и основные свойства органических соединений 1.2. Основания Брёнстеда Электронные эффекты заместителей Электронодонорные заместители повышают
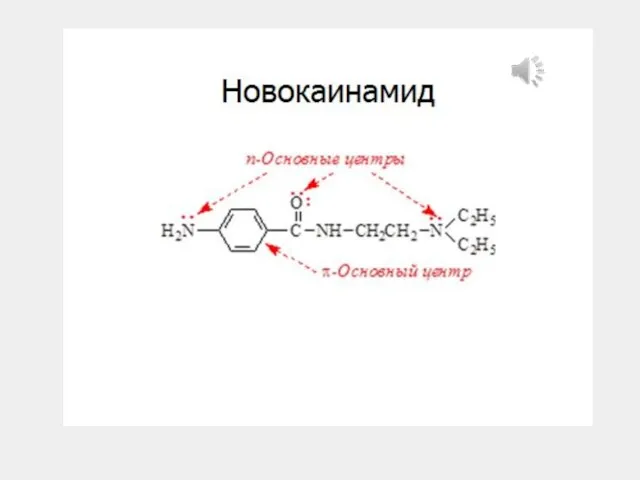
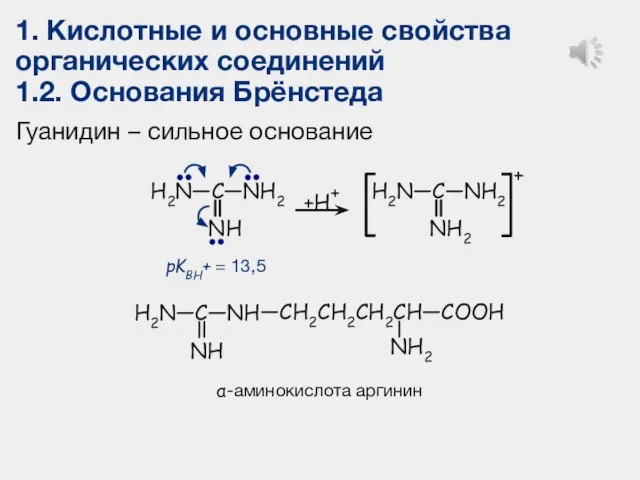
- 28. 1. Кислотные и основные свойства органических соединений 1.2. Основания Брёнстеда Гуанидин – сильное основание + +H+
- 30. Скачать презентацию



![Количественные характеристики Константа равновесия Kp Kp = [A—] [H3O+] [AH] [H2O] Константа](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/891748/slide-5.jpg)







 Температурная зависимость скорости химической реакции
Температурная зависимость скорости химической реакции Cкорость химических реакций
Cкорость химических реакций 8_ANIONY_2_3_angr
8_ANIONY_2_3_angr Энергия Гиббса
Энергия Гиббса Аттестационная работа. Многогранники: от молекулы до кристалла
Аттестационная работа. Многогранники: от молекулы до кристалла Алканы. Получение и применение
Алканы. Получение и применение Аммиак
Аммиак Применение кислорода
Применение кислорода Классификация методов переработки пластмасс
Классификация методов переработки пластмасс Растворы. Лекция №4
Растворы. Лекция №4 Соль. Добыча соли
Соль. Добыча соли Газообразные (газ)
Газообразные (газ) Соединения серы
Соединения серы Презентация на тему Соли аммония
Презентация на тему Соли аммония  Презентация на тему Лекарства 10 класс
Презентация на тему Лекарства 10 класс  Лекарственные растения содержащие флавоноиды
Лекарственные растения содержащие флавоноиды Тепловой эффект химических реакций
Тепловой эффект химических реакций Основания
Основания Викторина Что это?
Викторина Что это? Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Карбоновые кислоты
Карбоновые кислоты Металлы. Общая характеристика, химические свойства. Получение
Металлы. Общая характеристика, химические свойства. Получение Решение задач на определение массовой (объемной) доли выхода продукта реакции от теоретически возможного
Решение задач на определение массовой (объемной) доли выхода продукта реакции от теоретически возможного Prezentatsia1_1
Prezentatsia1_1 Средства ухода за кожей
Средства ухода за кожей Актуализация знаний. Закон Авогадро. Молярный объем газов (8 класс)
Актуализация знаний. Закон Авогадро. Молярный объем газов (8 класс) Селективность (реакторы)
Селективность (реакторы) Сероводород и сульфиды
Сероводород и сульфиды