Содержание
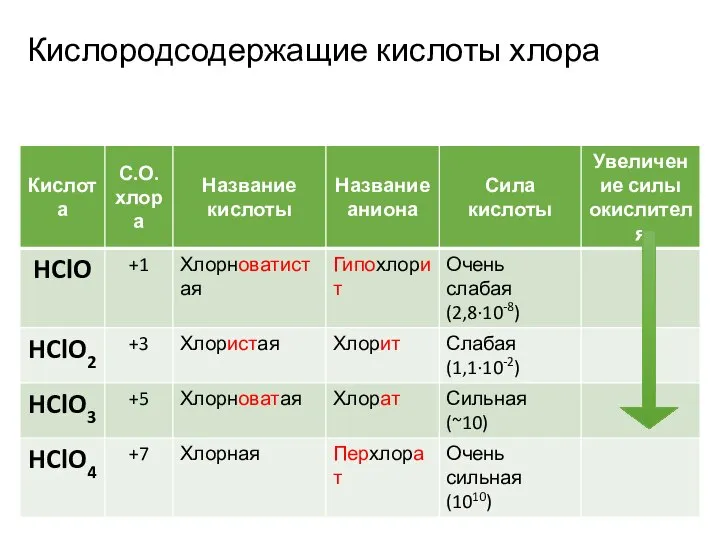
- 2. Кислородсодержащие кислоты хлора
- 3. План: Строение Физические свойства Получение Химические свойства Применение
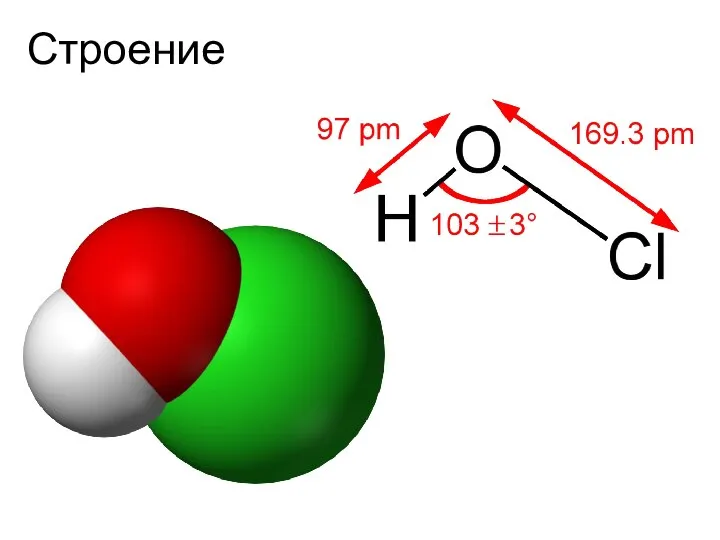
- 4. Хлорноватистая кислота HClO
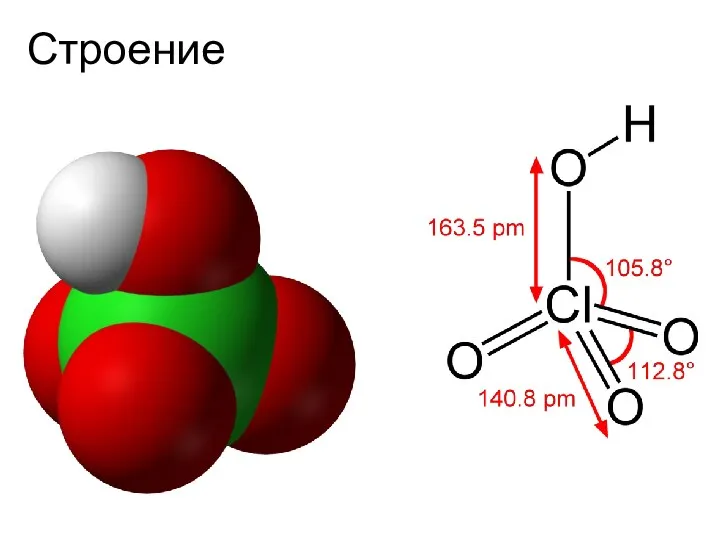
- 5. Строение
- 6. Физические свойства В свободном виде не выделена. Существует в растворе, максимальная массовая доля 20-25% (зеленовато-желтоватый раствор).
- 7. Получение Реакция хлора с влажным оксидом ртути: 2Cl2 + H2O + HgO = HgCl2 + 2HClO
- 8. Химические свойства
- 9. Взаимодействует с основаниями: HClO + NaOH = NaClO + H2O HClO + NH3 ∙ H2O(конц.) =
- 10. Применение Хлорноватистая кислота и гипохлориты легко разлагаются с выделением атомарного кислорода и поэтому широко используются для
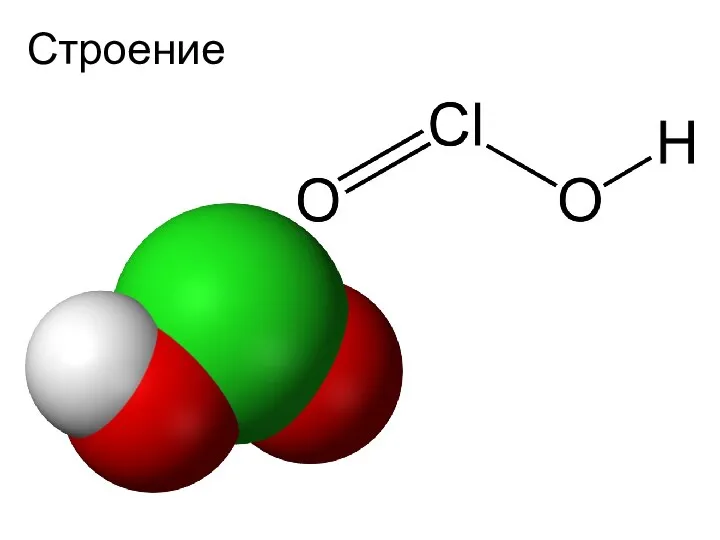
- 11. Хлористая кислота HClO2
- 12. Строение
- 13. Физические свойства В свободном виде не выделена. Существует в разбавленном бесцветном растворе.
- 14. Получение Раствор кислоты получают из её солей - хлоритов (образующихся в результате взаимодействия HClO2 со щелочью):
- 15. Химические свойства Хлористая кислота НClO2 в свободном виде неустойчива, даже в разбавленном водном растворе она быстро
- 16. Применение Широко применяют только соли хлористой кислоты – хлориты. В частности наиболее широко используется хлорит натрия
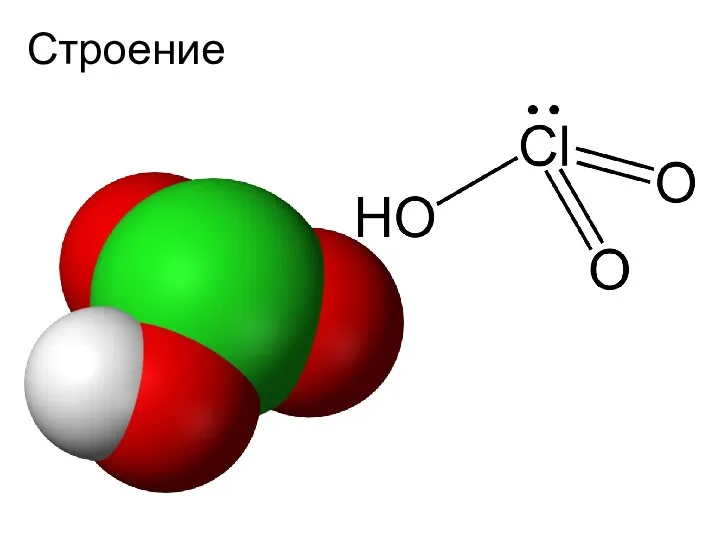
- 17. Хлорноватая кислота HClO3
- 18. Строение
- 19. В свободном виде не выделена. Существует в бесцветном растворе, максимальная массовая доля 40%. Физические свойства
- 20. Получение
- 21. Химические свойства Хлорноватая кислота — сильный окислитель; окислительная способность увеличивается с возрастанием концентрации и температуры. HClO3
- 22. Широко используют только соли хлорноватой кислоты – хлораты. Наибольшее практическое применение имеет хлорат калия KClO3, потребляемый
- 23. Хлорная кислота HClO4
- 24. Строение
- 25. Неустойчивая бесцветная летучая жидкость t°кип. = 110°C, t°пл. = -101°C. На воздухе сильно дымит. Вещество хорошо
- 26. Водные растворы хлорной кислоты получают электрохимическим окислением соляной кислоты Процесс электрохимического синтеза хлорной кислоты на аноде
- 27. Химические свойства
- 28. Хлорная кислота слабый окислитель в разбавленном, сильный окислитель в концентрированном растворе при нагревании. Безводная хлорная кислота
- 29. Концентрированные водные растворы хлорной кислоты широко используются в аналитической химии (например, при количественном определении калия в
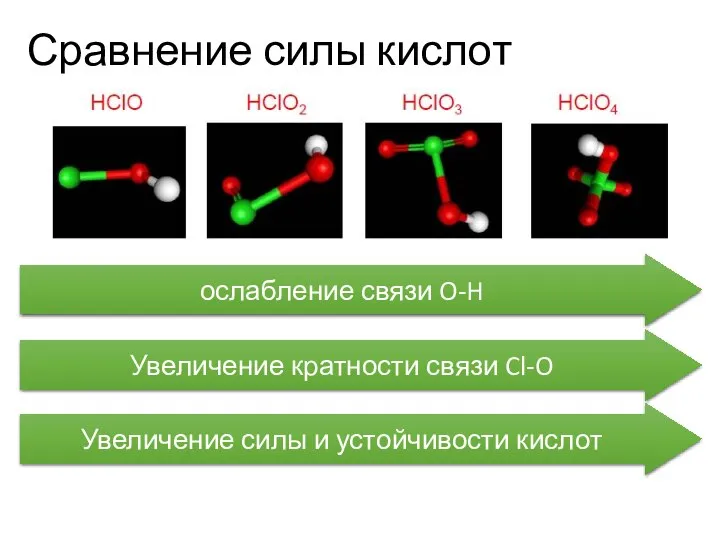
- 30. Сравнение силы кислот ослабление связи O-H Увеличение кратности связи Cl-O Увеличение силы и устойчивости кислот
- 31. Тест HBrO2 Бромоводородная кислота, сильная Бромная кислота, сильная Бромистая кислота, слабая Бромноватистая, слабая HClO4 Хлорная кислота,
- 33. Скачать презентацию
























 Номенклатура органических соединений
Номенклатура органических соединений Бөлу процестерінің тиімділігін бағалау әдістерін таңдау және таңдау принциптері
Бөлу процестерінің тиімділігін бағалау әдістерін таңдау және таңдау принциптері Нанотехнологии в быту
Нанотехнологии в быту Фарфор и фаянс
Фарфор и фаянс Удельная теплота сгорания
Удельная теплота сгорания Презентация на тему Лекарства дома
Презентация на тему Лекарства дома  Оксидтер мен негіздердің реакциялары
Оксидтер мен негіздердің реакциялары Основные понятия химической термодинамики
Основные понятия химической термодинамики Силумины. Виды силуминов
Силумины. Виды силуминов Измеритель концентрации асфальтенов в нефти с погружной решёткой Брэгга
Измеритель концентрации асфальтенов в нефти с погружной решёткой Брэгга Определение содержание фосфатов в воде фотометрическим методом
Определение содержание фосфатов в воде фотометрическим методом Магний (Mg)
Магний (Mg) Турнир Деда Мороза. Викторина по химии
Турнир Деда Мороза. Викторина по химии 3bc28ca0711047a6880d20a6763f17db
3bc28ca0711047a6880d20a6763f17db Чистые вещества и смеси
Чистые вещества и смеси Галогены
Галогены Физические свойства элементов 2 (ІІ) - группы
Физические свойства элементов 2 (ІІ) - группы Комплексонометрическое титрование. Часть 2. Лекция 6
Комплексонометрическое титрование. Часть 2. Лекция 6 Элемент протактиний
Элемент протактиний Органическая химия. Теория строения органических соединений
Органическая химия. Теория строения органических соединений Гидролиз солей
Гидролиз солей Сера, соединения серы
Сера, соединения серы Презентация на тему pH жидкостей, необходимых для человека
Презентация на тему pH жидкостей, необходимых для человека  Общая характеристика неметаллов. 9 класс
Общая характеристика неметаллов. 9 класс Химические и физические явления
Химические и физические явления Синтез и магнитные свойства бис(пиразолил)пиридинового комплекса железа II
Синтез и магнитные свойства бис(пиразолил)пиридинового комплекса железа II Основания. 8 класс
Основания. 8 класс Гибридизация атомных орбиталей
Гибридизация атомных орбиталей