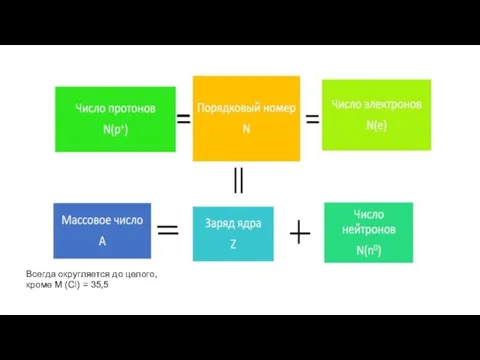
Слайд 2Всегда округляется до целого, кроме M (Cl) = 35,5
Слайд 5химические элементы
атомы с одинаковым зарядом ядра
Изотопы – атомы с одинаковым набором протонов

и электронов, но с другим количество нейтронов → изменяется массовое число
Слайд 6На каждой орбитали максимум 2 электрона
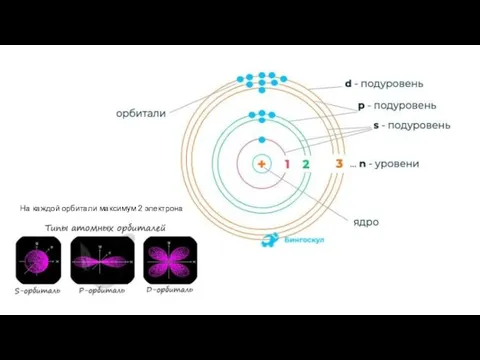
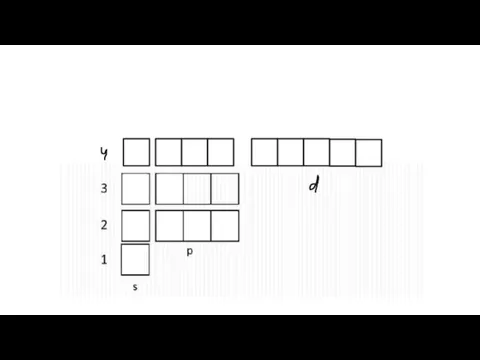
Слайд 7Электронная диаграмма
Электронная формула
Электронная конфигурация

Слайд 8правила заполнения электронных орбиталей
Сперва следует заполнить орбитали с наименьшей энергией, и только

после переходить к энергетически более высоким
На орбитали (в одной "ячейке") не может располагаться более двух электронов
Орбитали заполняются электронами так: сначала в каждую ячейку помещают по одному электрону, после чего орбитали дополняются еще одним электроном с противоположным направлением
Порядок заполнения орбиталей: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s
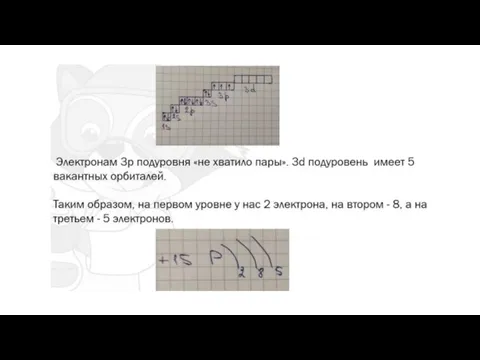
Слайд 9максимальное число электронов на подуровнях
2 - максимальное число электронов на s-подуровне (1

орбиталь)
6 - максимальное число электронов на p-подуровне (3 орбитали)
10 - максимальное число электронов на d-подуровне (5 орбиталей)
14 - максимальное число электронов на f-подуровне (7 орбиталей)
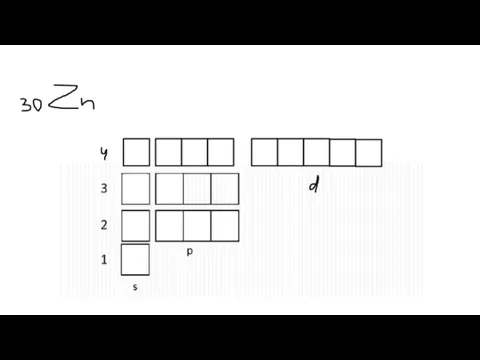
Слайд 10как понять, сколько электронов и как они расположены
По таблице Менделеева
Порядковый номер –

суммарное число электронов в атоме
Номер периода – число уровней
Номер группы – число электронов на последнем (самом внешнем) уровне
Слайд 18валентные электроны
— электроны в атоме, которые могут участвовать в образовании химической

связи («ищут пару»)
Слайд 20Порядок заполнения орбиталей: 1s → 2s → 2p → 3s → 3p
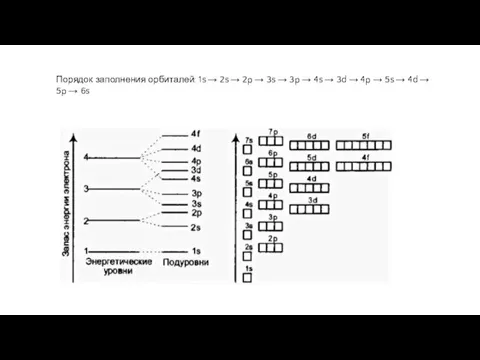
→ 4s → 3d → 4p → 5s → 4d → 5p → 6s
Слайд 23проскок/провал электрона
- переход электрона с внешнего, более высокого энергетического уровня, на предвнешний,

энергетически более низкий. Это связано с большей энергетической устойчивостью получающихся при этом электронных конфигураций (атом «тратит» меньше энергии, чтобы удерживать себя)
медь, хром, серебро, золото, молибден, платина, палладий
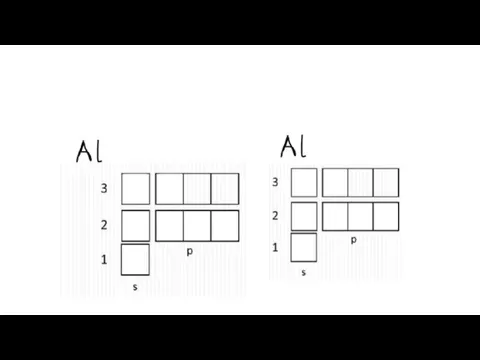
Слайд 24Электронно-графическая формула атома меди Cu

Слайд 26основное и возбужденное состояние атомов
Возбужденное состояние: все электроны на внешнем уровне распариваются

и занимают свободные ячейки (вакантные орбитали) по одному, становясь валентными (могут образовывать связи). Это состояние для атома нестабильно
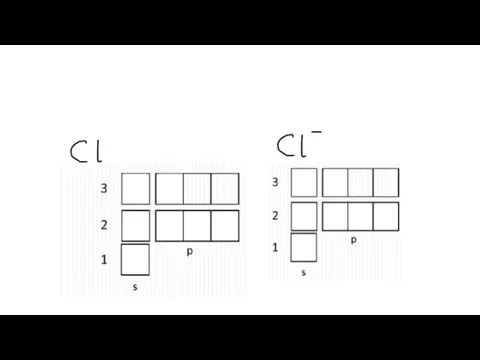
Слайд 27Электронная конфигурация ионов
Ионы – заряженные частицы
Отрицательный ион – анион – когда атом

получает электроны (минус – избыток электронов, недостаток протонов)
Положительный ион – катион – когда атом отдает электроны (плюс – недостаток электронов, избыток протонов)























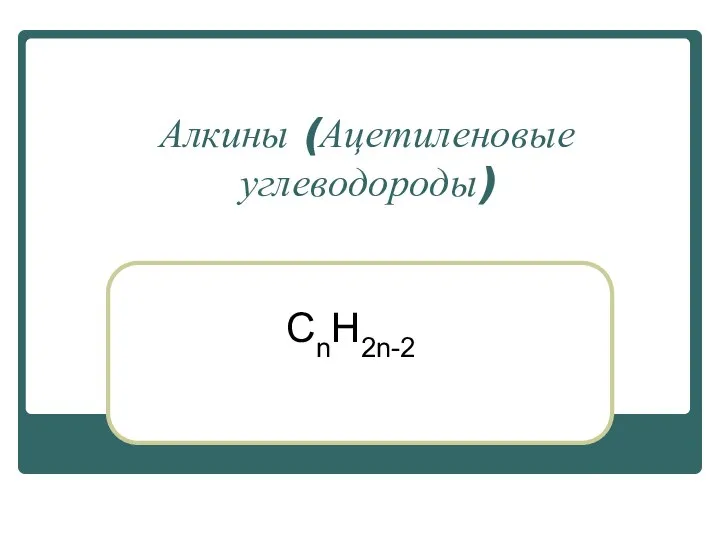 Алкины (Ацетиленовые углеводороды)
Алкины (Ацетиленовые углеводороды) Состав и свойства нефти
Состав и свойства нефти Основные законы и понятия химии. Основные классы неорганических соединений. Химический эквивалент. Закон эквивалентов
Основные законы и понятия химии. Основные классы неорганических соединений. Химический эквивалент. Закон эквивалентов Циклоалканы или цикланы – циклические насыщенные углеводороды
Циклоалканы или цикланы – циклические насыщенные углеводороды Алканы. Строение, номенклатура, изомерия, физические свойства
Алканы. Строение, номенклатура, изомерия, физические свойства Свойства воды
Свойства воды Полимеры
Полимеры Презентация на тему Всё об алюминии
Презентация на тему Всё об алюминии  Фармаколого-фармакогностическое исследование биологически активных добавок, применяемых для похудения
Фармаколого-фармакогностическое исследование биологически активных добавок, применяемых для похудения Инфракрасное электромагнитное излучение
Инфракрасное электромагнитное излучение Амины
Амины Неньютоновская жидкость
Неньютоновская жидкость Здравствуйте, химия! Что изучает химия
Здравствуйте, химия! Что изучает химия Жидкое состояние вещества
Жидкое состояние вещества Золото. Физические свойства золота
Золото. Физические свойства золота Производство аммиака
Производство аммиака 7609f31d31514fe19b6df19a98197139 (1)
7609f31d31514fe19b6df19a98197139 (1) Химическая термодинамика
Химическая термодинамика Презентация на тему Спирты (10 класс)
Презентация на тему Спирты (10 класс)  Атом. Ядро и электронная оболочка. Изотопы. Строение электронных оболочек атома. Понятие об орбиталях
Атом. Ядро и электронная оболочка. Изотопы. Строение электронных оболочек атома. Понятие об орбиталях Примеры реакций в жизни и в быту. Реакции по направлению процесса
Примеры реакций в жизни и в быту. Реакции по направлению процесса Презентация на тему Драгоценные камни
Презентация на тему Драгоценные камни  Основания. Классификация оснований
Основания. Классификация оснований Презентация на тему Процессы в растворах электролитическая диссоциация
Презентация на тему Процессы в растворах электролитическая диссоциация  Исследование снега на общую химическую токсичность методом биотестирования Автор: Милюта Юлия, Тюменская область, Тюменский рай
Исследование снега на общую химическую токсичность методом биотестирования Автор: Милюта Юлия, Тюменская область, Тюменский рай Химия в жизни человека
Химия в жизни человека Комплексы хлорида и иодида цинка (II) с карбамидом: синтез, характеристика и биологическая активность
Комплексы хлорида и иодида цинка (II) с карбамидом: синтез, характеристика и биологическая активность Презентация на тему Лекарства
Презентация на тему Лекарства