Слайд 2СИНТЕЗ НЕНИЦЕСКИ
Синтез Неницески служит исключительно для получения 5-гидроксииндолов, некоторые из которых проявляют

биологическую активность.Реакция представляет собой сопряженное присоединение винилогов первичных или вторичных амидов к бензохинону с последующей циклизацией
Слайд 4ПРОИЗВОДНЫЕ 5-ГИДРОКСИИНДОЛОВ,ПРОЯВЛЯЮЩИЕ БИОЛОГИЧЕСКУЮ АКТИВНОСТЬ
Среди родственных природных индолов можно назвать триптамин (66),серотонин (67)
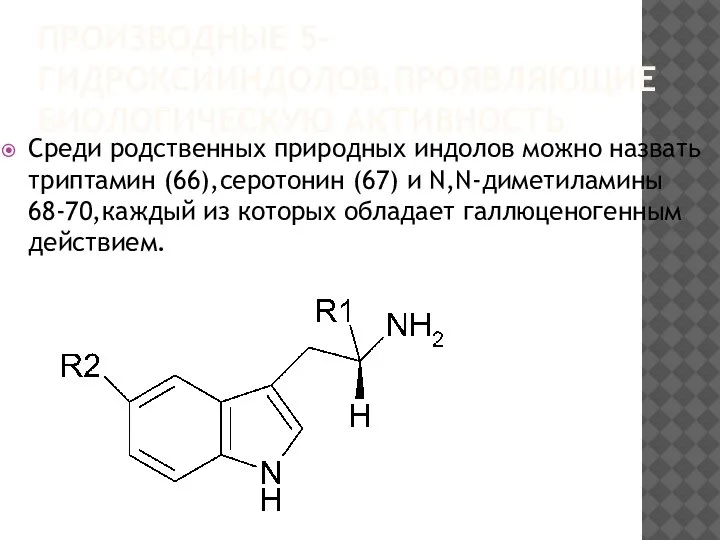
и N,N-диметиламины 68-70,каждый из которых обладает галлюценогенным действием.
Слайд 5ПРОИЗВОДНЫЕ 5-ГИДРОКСИИНДОЛОВ,ПРОЯВЛЯЮЩИЕ БИОЛОГИЧЕСКУЮ АКТИВНОСТЬ
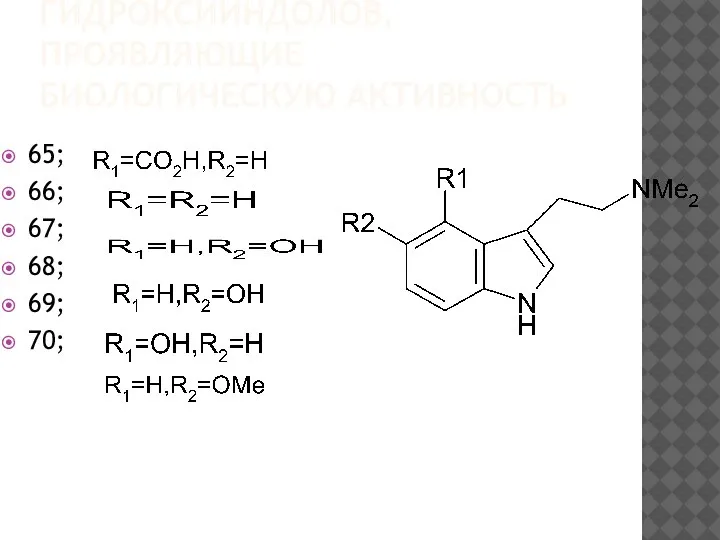
65;
66;
67;
68;
69;
70;
Слайд 6ИСТОРИЯ РЕАКЦИИ ПОЯВЛЕНИЯ НЕНИЦЕСКИ
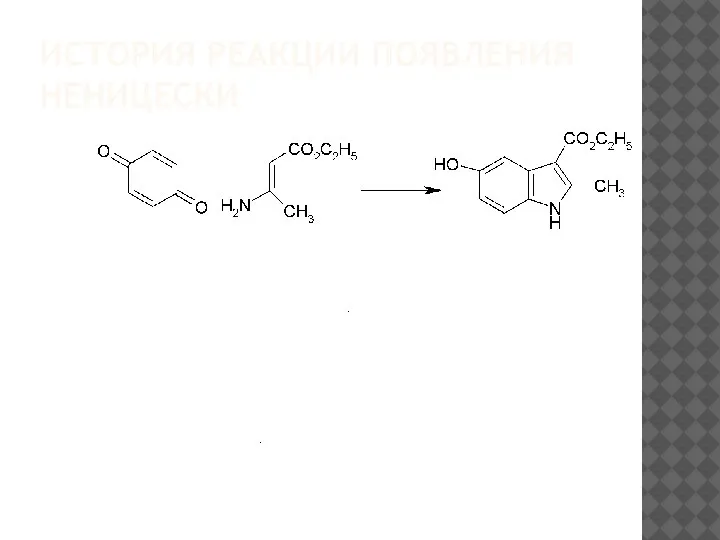
В1929 г. К. Неницески впервые обнаружил, что при взаимодействии

п-бензохинона с этиловым эфиром3-аминокротоновой кислоты в кипящем
ацетоне образуется этиловый эфир5-гидрокси-2-метилиндол-3-карбоновой
кислоты[73].
Слайд 7ИСТОРИЯ РЕАКЦИИ ПОЯВЛЕНИЯ НЕНИЦЕСКИ
Слайд 8ИСТОРИЯ РЕАКЦИИ ПОЯВЛЕНИЯ НЕНИЦЕСКИ
Эта реакция была незаслуженно забыта до1950-х гг., когда интерес
к

химии меланина, серотонина и родственных производных 5-гидрокси-индола стимулировал исследование разнообразных способов синтеза соеди-нений этого класса. Публикация этого подробного обзора[74] хорошо отра-жает возросший интерес исследователей к реакции Неницески.
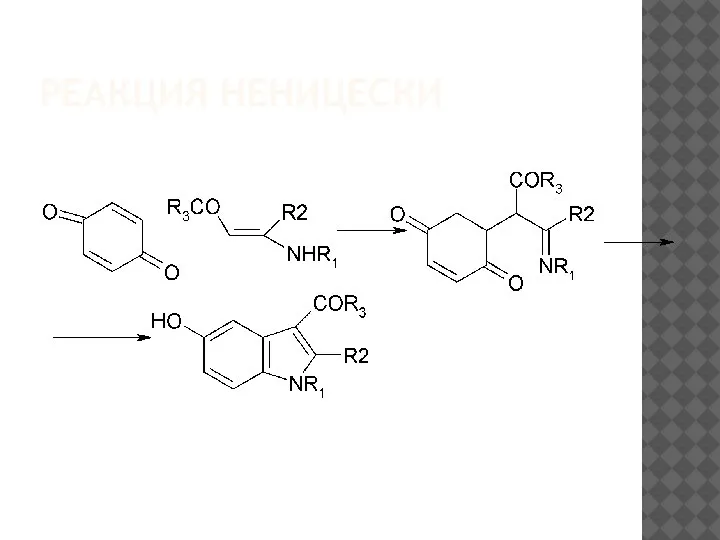
Слайд 9МЕХАНИЗМ РЕАКЦИИ НЕНИЦЕСКИ
Существует два возможных механизма реакции Неницеску[75]
![МЕХАНИЗМ РЕАКЦИИ НЕНИЦЕСКИ Существует два возможных механизма реакции Неницеску[75]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1086830/slide-8.jpg)
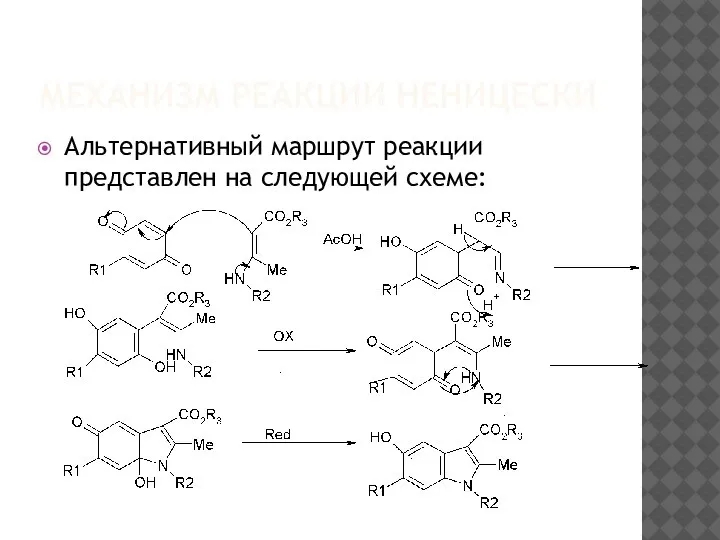
Слайд 10МЕХАНИЗМ РЕАКЦИИ НЕНИЦЕСКИ
Альтернативный маршрут реакции представлен на следующей схеме:
Слайд 11 РЕАКЦИИ НЕНИЦЕСКИ
Где Ox- окислитель, Red- восстановитель
Межмолекулярный процесс окисления–восстановления, по-видимому,
включает в

себя бимолекулярный комплекс с переносом заряда[76].
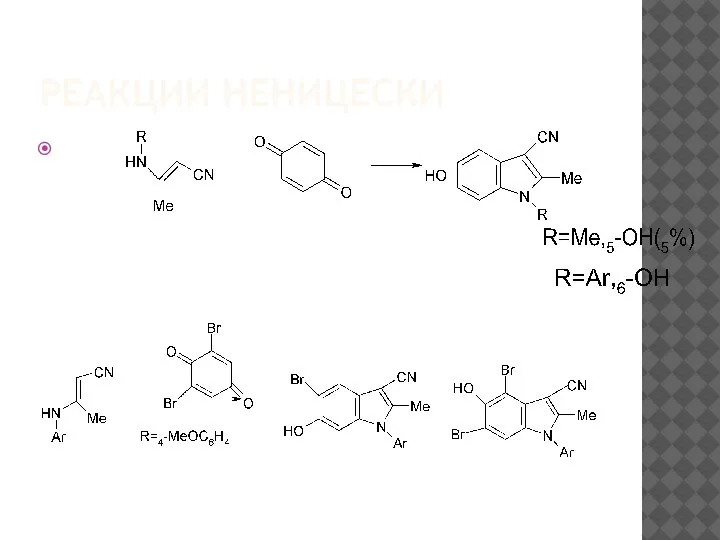
Направление реакции Неницески в значительной степени зависит от
строения енамина и гораздо меньше от структуры кетона[74]. Так, на
примере2,6-дибромхинона было показано[77], что при переходе от N-метил-
к N-арил-β-цианоенаминам направление реакции меняется: в первом случае
преимущественно образуются5-гидроксииндолы, во втором– 6-гидрокси-производные.
Слайд 12РЕАКЦИИ НЕНИЦЕСКИ
По мере роста электроноакцепторности β-заместителя в исход-ном енамине увеличивается склонность

к образованию6-гидроксиизомеров.
В случае β-нитроенаминов это направление становится доминирующим
не только для N-арил-, но и для N-метиленаминов.
Слайд 14РЕАКЦИИ НЕНИЦЕЛИ
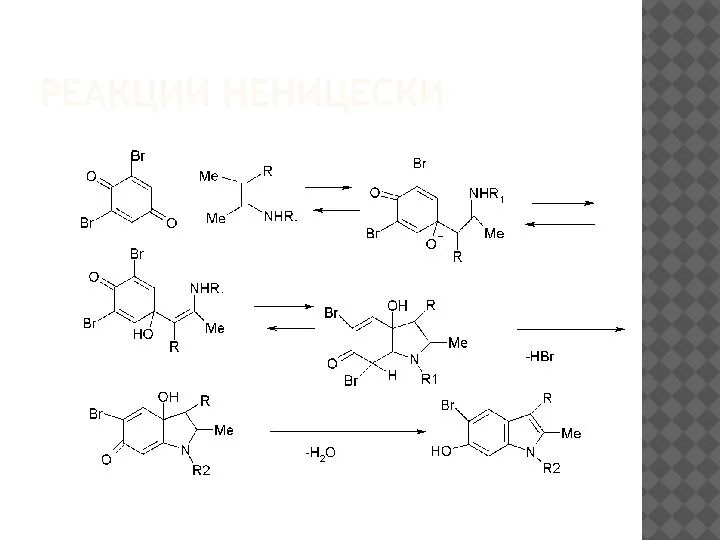
Замена N-метильного заместителя на арильный прежде всего сказывается
на снижении электронной плотности

в β-положении енамина. Это в свою
очередь приводит к уменьшению скорости присоединения енамина к хинону,
причём менее электронодефицитное положение2 более чувствительно
к такому снижению скорости, чем атом углерода карбонильной группы. По-скольку первый тип присоединения ответственен за образование5-гидрокси-индолов, а второй– 6-гидроксииндолов, то доминирующим процессом стано-вится образование последних. Образование6-гидроксииндола можно пред-ставить следующей схемой:
Слайд 16РЕАКЦИИ НЕНИЦЕСКИ
При использовании N,N-дизамещённых енаминов в реакции Неницеску
вместо5-гидроксииндолов образуются соответствующие5-гидроксибензо-фураны[78, 79].
![РЕАКЦИИ НЕНИЦЕСКИ При использовании N,N-дизамещённых енаминов в реакции Неницеску вместо5-гидроксииндолов образуются соответствующие5-гидроксибензо-фураны[78, 79].](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1086830/slide-15.jpg)
Слайд 17РЕАКЦИИ НЕНИЦЕСКИ
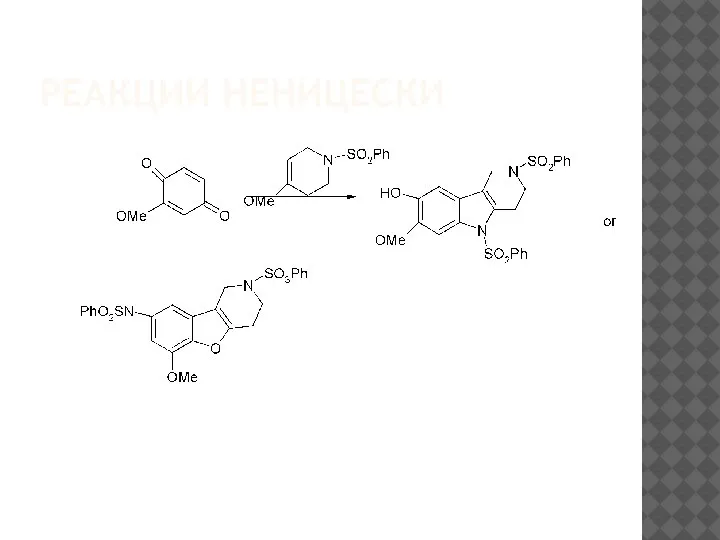
Альтернативой реакции Неницеску можно считать весьма интересный
метод получения1,2,3,4-тетрагидро-γ-карболинов, основанный на катализи-руемой

кислотами Льюиса циклоконденсации еноловых эфиров пиперидона-4
с2-метокси-4-(N-фенилсульфонил)-1,4-бензохинониминами[80]. Моноимины
бензохинона взаимодействуют с еноловым эфиром пиперидона-4 с образова-нием как γ-карболиновых производных 32, так и тетрагидробензо[4,5]фуро-[3,2-c]пиридинов 33 в зависимости от используемой кислоты Льюиса.
Слайд 19РЕАКЦИИ НЕНИЦЕСКИ
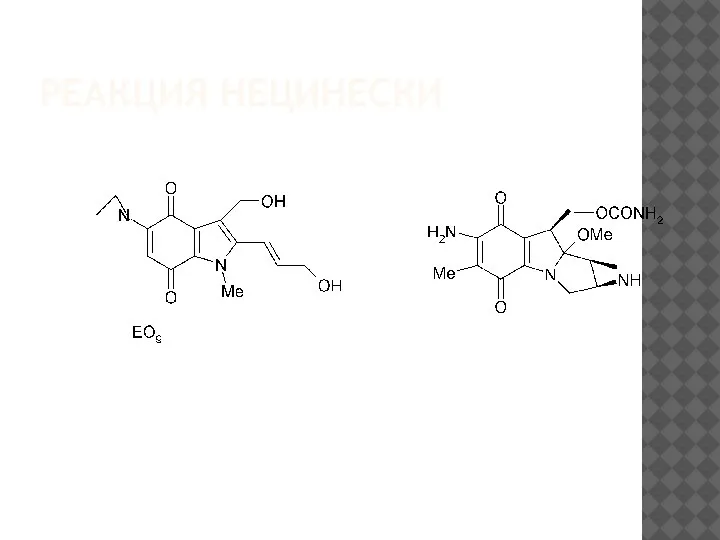
В1995 г. реакция Неницеску была использована для синтеза ключевого
интермедиата при получении

нового синтетического индолохинона ЕО9,
структура и функции которого близки Митомицину С– антибиотику с про-тивоопухолевой активностью, выделенному из культуры гриба Streptomyces
caespitosus[81]






![МЕХАНИЗМ РЕАКЦИИ НЕНИЦЕСКИ Существует два возможных механизма реакции Неницеску[75]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1086830/slide-8.jpg)




![РЕАКЦИИ НЕНИЦЕСКИ При использовании N,N-дизамещённых енаминов в реакции Неницеску вместо5-гидроксииндолов образуются соответствующие5-гидроксибензо-фураны[78, 79].](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1086830/slide-15.jpg)


 Предельные углеводороды
Предельные углеводороды Типичные реакции основных и кислотных оксидов
Типичные реакции основных и кислотных оксидов Физическая химия, термодинамика
Физическая химия, термодинамика Липиды молока и молочных продуктов. Группы липидов
Липиды молока и молочных продуктов. Группы липидов Ароматические углеводороды
Ароматические углеводороды Л-1 основные классы неорганических веществ
Л-1 основные классы неорганических веществ 11 типы связей
11 типы связей Дифференцированный подход в преподавании химии
Дифференцированный подход в преподавании химии Разбор заданий на амины
Разбор заданий на амины Соли. Составление формул и номенклатура
Соли. Составление формул и номенклатура (+)-Plumisclerin A. Плюмисклин А
(+)-Plumisclerin A. Плюмисклин А Природные и искусственные материалы. Естествознание. 6 класс
Природные и искусственные материалы. Естествознание. 6 класс Электроотрицательность химических элементов
Электроотрицательность химических элементов Синтез ацетилена из природного газа в производстве ацетилена
Синтез ацетилена из природного газа в производстве ацетилена Закон сохранения массы веществ
Закон сохранения массы веществ Химические формулы
Химические формулы Карбоновые кислоты. Д.И. Менделеев
Карбоновые кислоты. Д.И. Менделеев Изучение пенопласта
Изучение пенопласта Алюминий и его соединения
Алюминий и его соединения Стелс-материалы
Стелс-материалы Оксиды азота
Оксиды азота Окислительно=восстановительное титрование
Окислительно=восстановительное титрование Алюминий и его свойства
Алюминий и его свойства obschaya_kharakteristika_prostykh_alifaticheskikh_efirov
obschaya_kharakteristika_prostykh_alifaticheskikh_efirov Предмет органической химии
Предмет органической химии Карбоновые кислоты (химические свойства)
Карбоновые кислоты (химические свойства) Использование культурологического компонента на уроках химии
Использование культурологического компонента на уроках химии Алканы
Алканы