Содержание
- 2. Способность вещества участвовать в тех или иных химических реакциях называется химическим свойством данного вещества. Химические реакции
- 3. Характерные признаки химических реакций: 1. Изменение цвета: 2KMnO4 + 5K2SO3 + 3H2SO4 = 2MnSO4 + 6K2SO4
- 4. Химические реакции изображают с помощью химических уравнений. Принято выделять следующие типы химических реакций: 1. Реакции соединения:
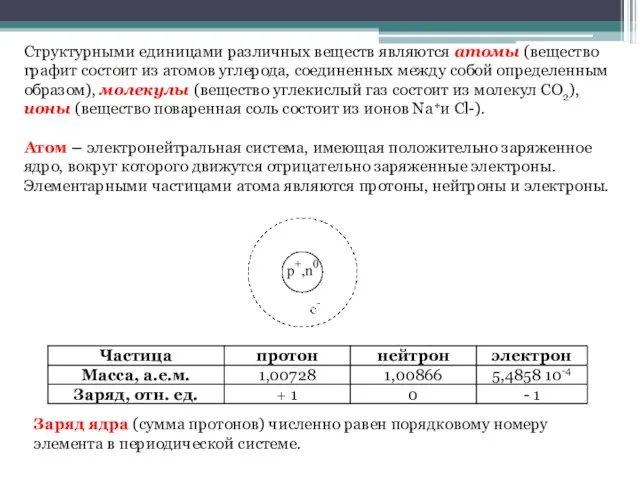
- 5. Структурными единицами различных веществ являются атомы (вещество графит состоит из атомов углерода, соединенных между собой определенным
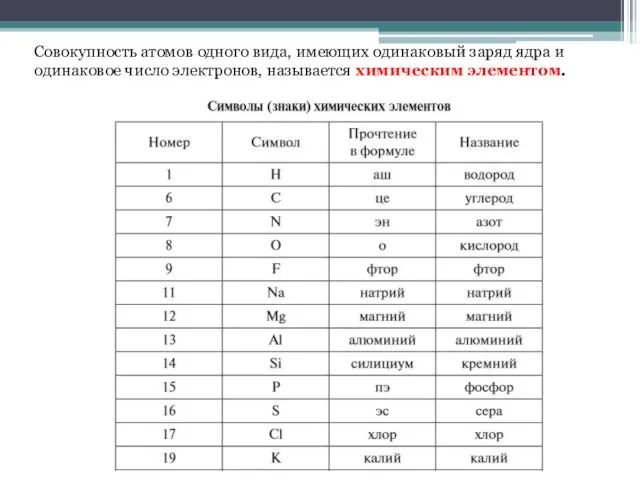
- 6. Совокупность атомов одного вида, имеющих одинаковый заряд ядра и одинаковое число электронов, называется химическим элементом.
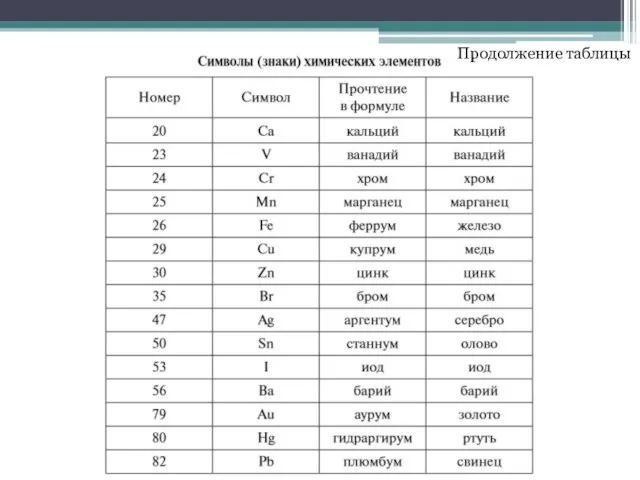
- 7. Продолжение таблицы
- 8. Атомы – очень маленькие частицы, имеющие форму шара. Для выражения атомных размеров используются специальные единицы длины:
- 9. Атомы могут объединяться в молекулы. Молекула – электронейтральная наименьшая частица вещества, обладающая его химическими свойствами. Например,
- 10. Валентность – способность атомов элемента соединяться с другими атомами в определенных соотношениях. Валентность элемента зависит от
- 11. Для большинства бинарных соединений, т.е., соединений, молекулы которых состоят из атомов двух элементов AmBn, существует правило
- 12. Ионы (от греч. ion – идущий), одноатомные или многоатомные частицы, несущие электрический заряд. Положительные ионы называют
- 13. Основные законы химии 1. Закон сохранения массы веществ (М.В. Ломоносов, 1748 г.; А. Лавуазье, 1789 г.):
- 14. 2. Закон постоянства состава (Впервые сформулировал Ж. Пруст (1808 г): Состав и свойства веществ постоянны и
- 15. Эквивалент элемента (Э) – это такое его количество, которое способно соединяться с 1 моль атомов водорода
- 16. 3. Закон эквивалентов – массы (объемы) реагирующих друг с другом веществ пропорциональны их эквивалентным массам: m1Э2=m2Э1.
- 17. 4. Закон Авогадро (1811 г.): в равных объемах различных газов при одинаковых условиях находится одинаковое количество
- 19. Скачать презентацию













 Природные смолы: канифоль, янтарь, сандарак (2)
Природные смолы: канифоль, янтарь, сандарак (2) Окислительно-восстановительные реакции
Окислительно-восстановительные реакции 1666603286718__4v20ts
1666603286718__4v20ts Введение в органическую химию
Введение в органическую химию Вещество и тело. Атом и молекула. Свойства веществ. Простые и сложные вещества. Химический элемент
Вещество и тело. Атом и молекула. Свойства веществ. Простые и сложные вещества. Химический элемент Этиленовые углеводороды
Этиленовые углеводороды Введение в биохимию
Введение в биохимию Классы неорганических соединений
Классы неорганических соединений Окислительные свойства концентрированной серной кислоты
Окислительные свойства концентрированной серной кислоты Классы неорганических веществ. Оксиды
Классы неорганических веществ. Оксиды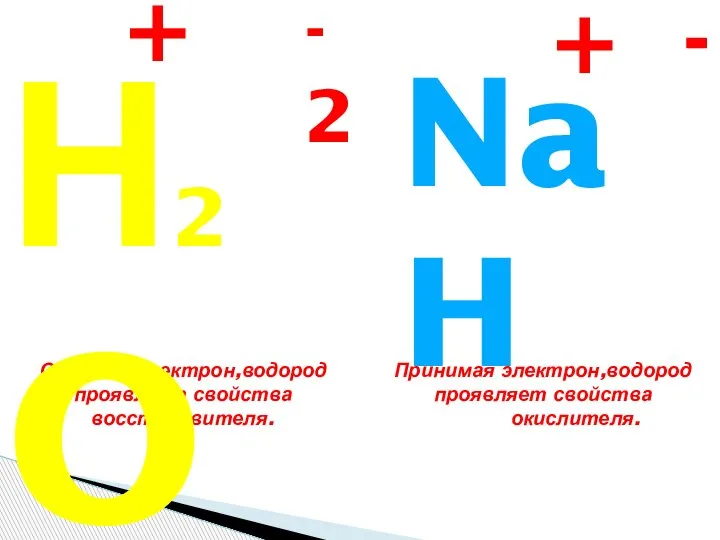 Кислород и водород
Кислород и водород Степень окисления веществ
Степень окисления веществ Альдегиды. Свойства альдегидов
Альдегиды. Свойства альдегидов Углеводороды
Углеводороды Алканы. Химические свойства. Применение
Алканы. Химические свойства. Применение Важнейшие классы неорганических соединений
Важнейшие классы неорганических соединений Основания. Получение оснований
Основания. Получение оснований Высшие жирные кислоты липиды биомембраны. Лекция 3
Высшие жирные кислоты липиды биомембраны. Лекция 3 Свойства нефти
Свойства нефти Масс-спектрометрия – аналитический метод определения молекулярной массы свободных ионов в высоком вакууме
Масс-спектрометрия – аналитический метод определения молекулярной массы свободных ионов в высоком вакууме Уравнение состояния идеального газа. Газовые законы. Изопроцессы
Уравнение состояния идеального газа. Газовые законы. Изопроцессы Гідроліз солей
Гідроліз солей Соединения щелочных металлов
Соединения щелочных металлов Презентация на тему Азотная кислота (9 класс)
Презентация на тему Азотная кислота (9 класс)  Первоначальные химические понятия. 2 раунд
Первоначальные химические понятия. 2 раунд Реакции ионного обмена
Реакции ионного обмена Нитраты в продуктах
Нитраты в продуктах Основные классы неорганических соединений
Основные классы неорганических соединений