Содержание
- 2. Цель урока: Изучение закона сохранения массы вещества Задачи: Обучение учащихся составлению уравнений химических реакций Усвоение учащимися
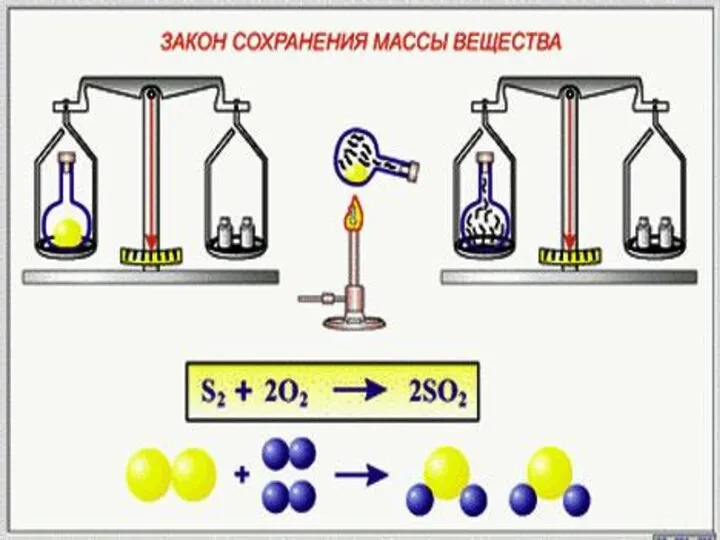
- 3. М.В.Ломоносов в 1748 г. впервые сформулировал, а в 1756 г. экспериментально доказал закон сохранения массы веществ
- 5. Формулировка закона Масса веществ, вступивших в химическую реакцию, равна массе образовавшихся веществ
- 6. Сосуд Ландольта
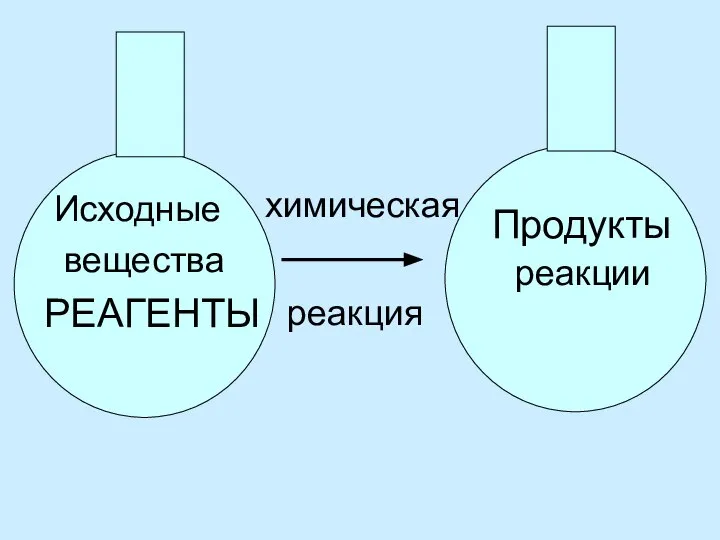
- 7. Исходные вещества РЕАГЕНТЫ химическая реакция Продукты реакции
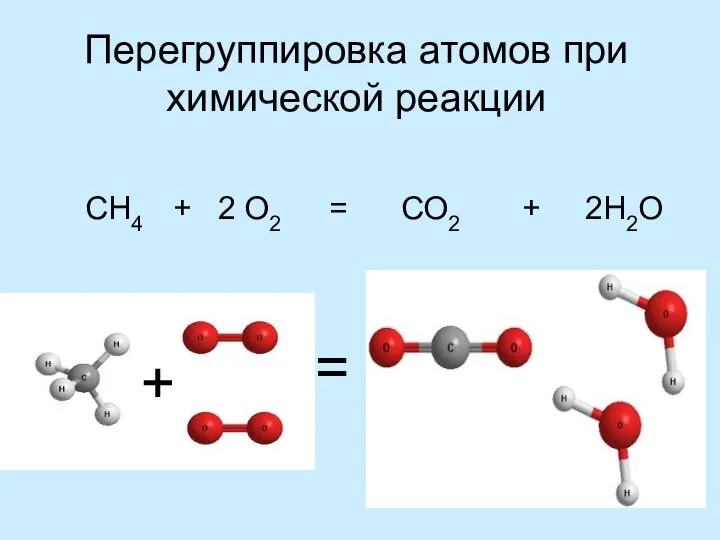
- 8. Атомы не появляются и не исчезают при химической реакции
- 9. Перегруппировка атомов при химической реакции СН4 + 2 О2 = СО2 + 2Н2О + =
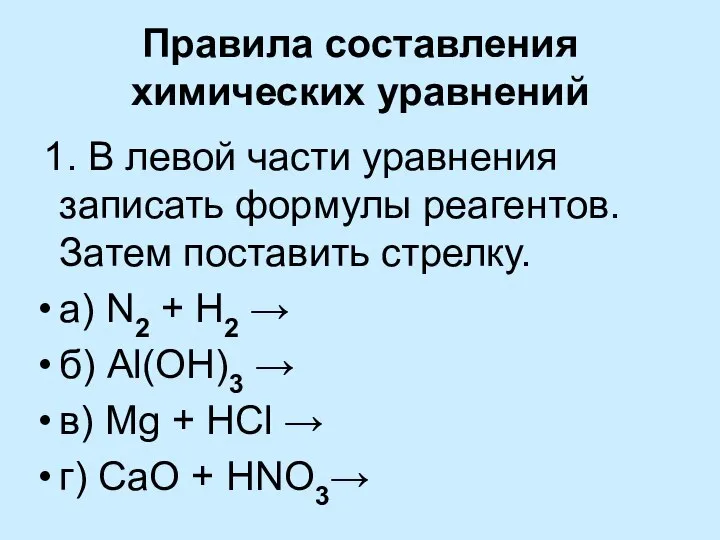
- 10. Правила составления химических уравнений 1. В левой части уравнения записать формулы реагентов. Затем поставить стрелку. а)
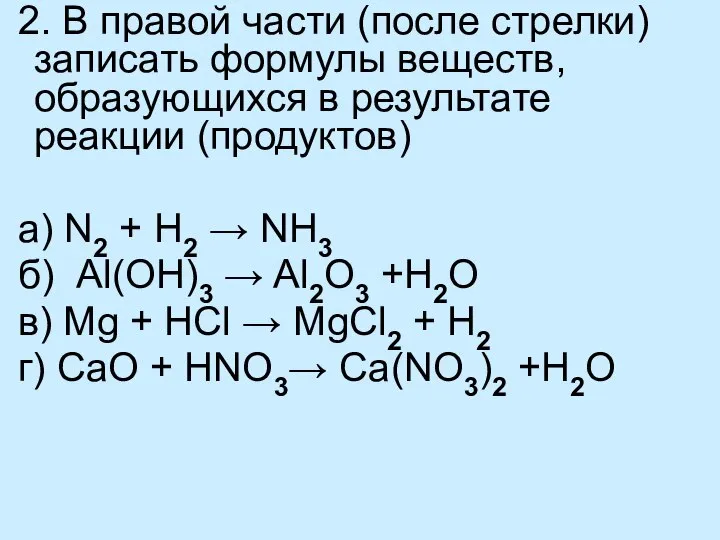
- 11. 2. В правой части (после стрелки) записать формулы веществ, образующихся в результате реакции (продуктов) а) N2
- 12. 3. Уравнение реакции составляется на основе закона сохранения массы веществ, т. е. слева и справа должно
- 13. Алгоритм расстановки коэффициентов в уравнении химической реакции. 1. Подсчитать количество атомов каждого элемента в правой и
- 14. 4. Пересчитать количество атомов, при необходимости действия повторить. 5. Начинать лучше с атомов О или любого
- 15. а) N2 + 3H2 → 2NH3 б) 2Al(OH)3 → Al2O3 + 3H2O в) Mg + 2HCl
- 17. Скачать презентацию








 Фосфорні добрива. Технології збагачення фосфоровмісної сировини
Фосфорні добрива. Технології збагачення фосфоровмісної сировини ПЕРІОДИЧНИЙ ЗАКОН
ПЕРІОДИЧНИЙ ЗАКОН Химический элемент. Изотопы. Ионы
Химический элемент. Изотопы. Ионы Презентация на тему Химическая промышленность мира
Презентация на тему Химическая промышленность мира  Презентация на тему Фосфор. Соединения фосфора
Презентация на тему Фосфор. Соединения фосфора  Презентация на тему Соли
Презентация на тему Соли  Химические системы. Химическая термодинамика. Химическое равновесие
Химические системы. Химическая термодинамика. Химическое равновесие Презентация на тему Алкены. Строение. Изомерия. Химические свойства
Презентация на тему Алкены. Строение. Изомерия. Химические свойства  Полимеры и пластмассы
Полимеры и пластмассы Приминение серной кислоты в хозяйстве
Приминение серной кислоты в хозяйстве Металлы. Своя игра
Металлы. Своя игра Серная кислота и её соли. Качественная реакция на сульфат-ион
Серная кислота и её соли. Качественная реакция на сульфат-ион Кислоты
Кислоты Решение расчетных задач по химии
Решение расчетных задач по химии Кислота. Карбоновые кислоты
Кислота. Карбоновые кислоты Изучение свойств пластичных масс для лепки
Изучение свойств пластичных масс для лепки Объёмный анализ
Объёмный анализ Галогены – химические элементы
Галогены – химические элементы Коррозия металлов. Экзаменационные вопросы
Коррозия металлов. Экзаменационные вопросы Решение экспериментальных задач по теме Металлы
Решение экспериментальных задач по теме Металлы Природные и синтетические красители
Природные и синтетические красители Происхождения названий химических элементов
Происхождения названий химических элементов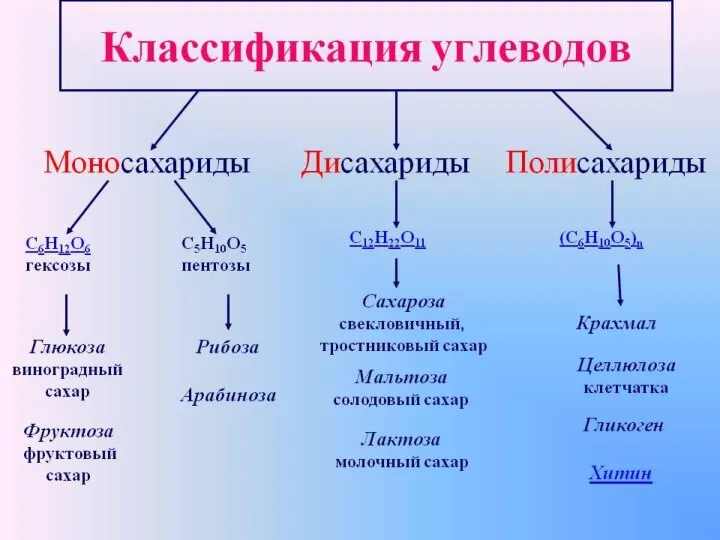 Классификация углеродов
Классификация углеродов Химическая кинетика и равновесие
Химическая кинетика и равновесие Презентация на тему Строение и свойства циклоалканов
Презентация на тему Строение и свойства циклоалканов  Строение атома. Ядро и электронная оболочка
Строение атома. Ядро и электронная оболочка Периодическая система
Периодическая система Перициклические реакции
Перициклические реакции