Содержание
- 2. Положение галогенов в ПСХЭ Галогены – элементы VIIА – группы. Галогены – типичные неметаллы. Общее название
- 3. Галогены: фтор F, хлор Cl, бром Br, йод I, астат At (редко встречающийся в природе) –
- 4. Общая характеристика +9 ) ) 2 7 +17 ) ) ) 2 8 7 +35 )
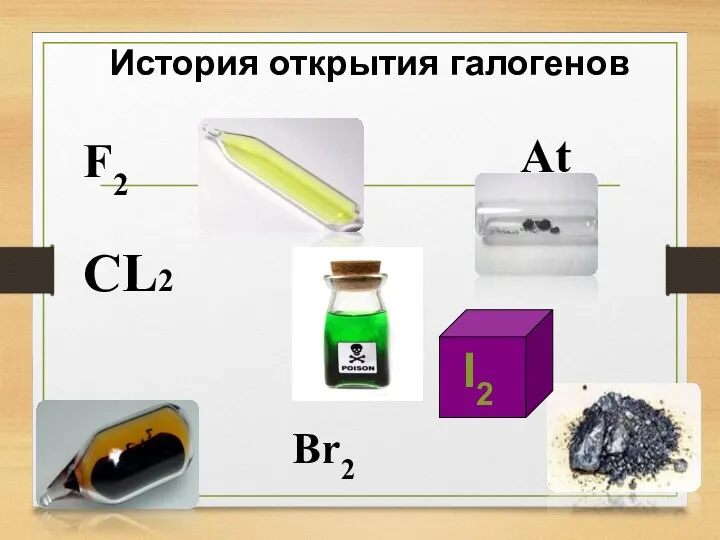
- 5. История открытия галогенов F2 Br2 At CL2
- 6. История открытия фтора В 1886 году французский химик А. Муассан, используя электролиз жидкого фтороводорода, охлажденного до
- 7. История открытия хлора В 1774 году шведский аптекарь К. Шееле открыл хлор. «Я поместил смесь черной
- 8. История открытия брома В 1825 году французский химик А.Ж.Балар при изучении маточных рассолов выделил темно-бурую жидкость,
- 9. История открытия йода В 1811 году французский химик Бернар Куртуа открыл йод путём перегонки маточных растворов
- 10. История открытия астата В 1869 г Д.И.Мендеелеев предсказал его существование и возможность открытия в будущем (как
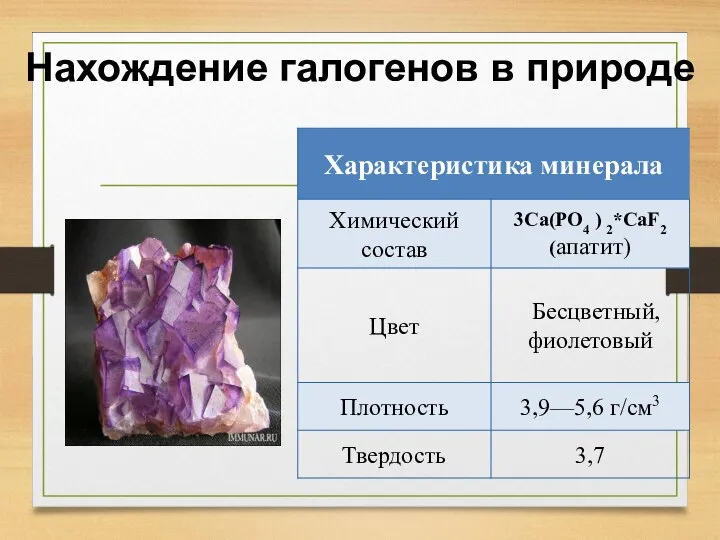
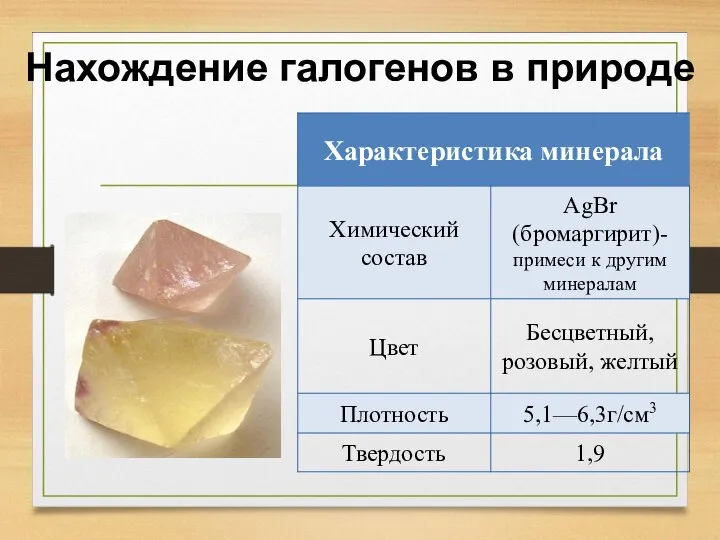
- 11. Нахождение галогенов в природе
- 12. Нахождение галогенов в природе
- 13. Нахождение галогенов в природе
- 14. Нахождение галогенов в природе
- 15. Нахождение галогенов в природе
- 16. Нахождение галогенов в природе
- 17. Галогены в живых организмах
- 18. Физические свойства
- 19. Физические свойства
- 20. Физические свойства
- 21. Физические свойства
- 22. Физические свойства
- 23. Химические свойства фтора F2 –САМЫЙ РЕАКЦИОНОСПОСОБНЫЙ, реакции идут на холоде, при нагревании – даже с участием
- 24. С простыми веществами: С Металлами С Неметаллами 2Fe + 3Cl2 → 2FeCl3 H2 + Cl2 →
- 25. С простыми веществами: С Металлами С Неметаллами 2Fe + 3Br2 → 2FeBr3 H2 + Br2 →
- 26. I2 - мало реакционоспособен. С простыми веществами: С металлами(кроме благородных при T) С неметаллами Hg +
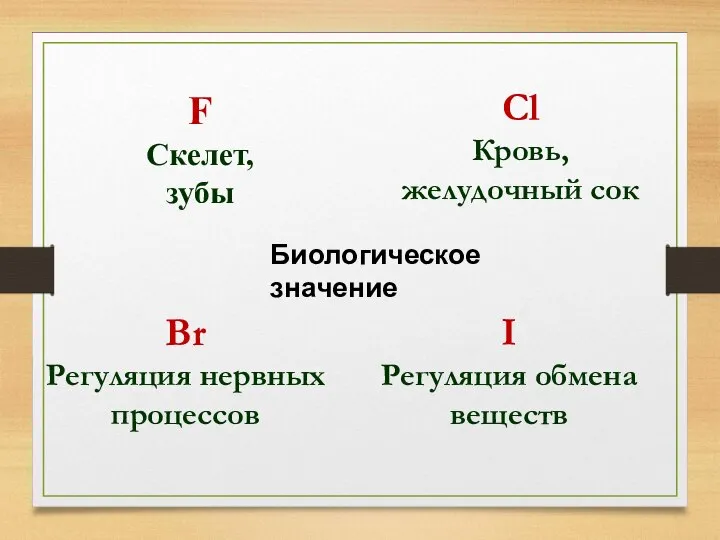
- 27. F Скелет, зубы Сl Кровь, желудочный сок Br Регуляция нервных процессов I Регуляция обмена веществ Биологическое
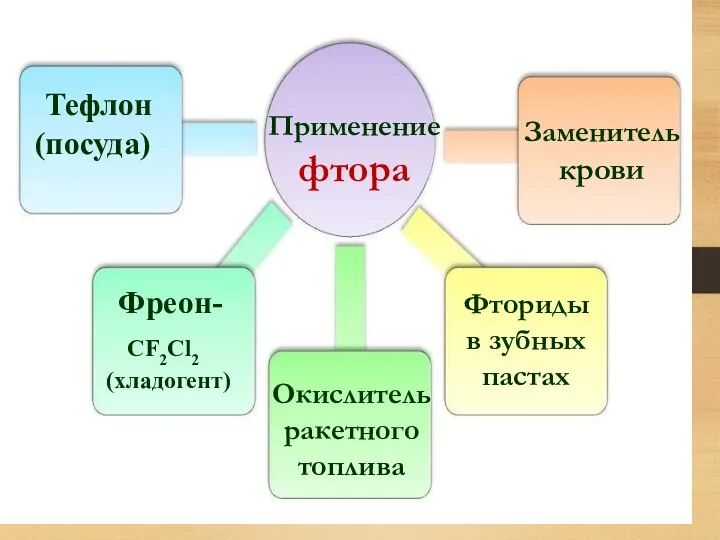
- 28. Применение фтора Тефлон (посуда) Фреон- CF2Cl2 (хладогент) Окислитель ракетного топлива Заменитель крови Фториды в зубных пастах
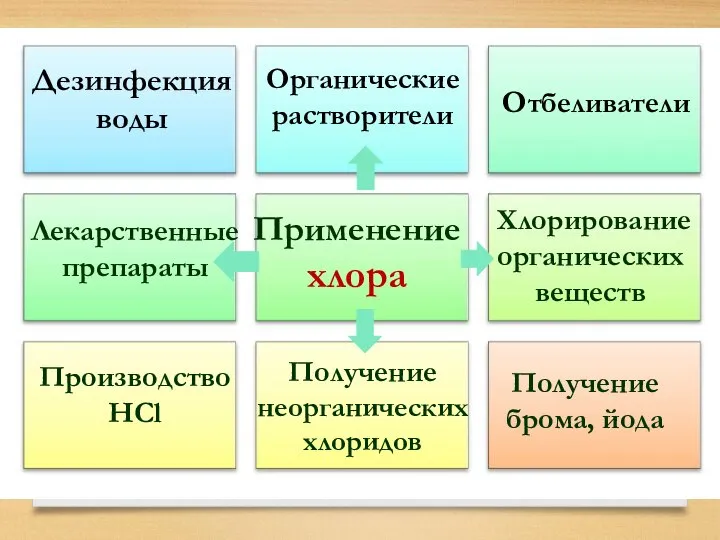
- 29. Применение хлора Отбеливатели Производство HCl Получение брома, йода Дезинфекция воды Органические растворители Лекарственные препараты Хлорирование органических
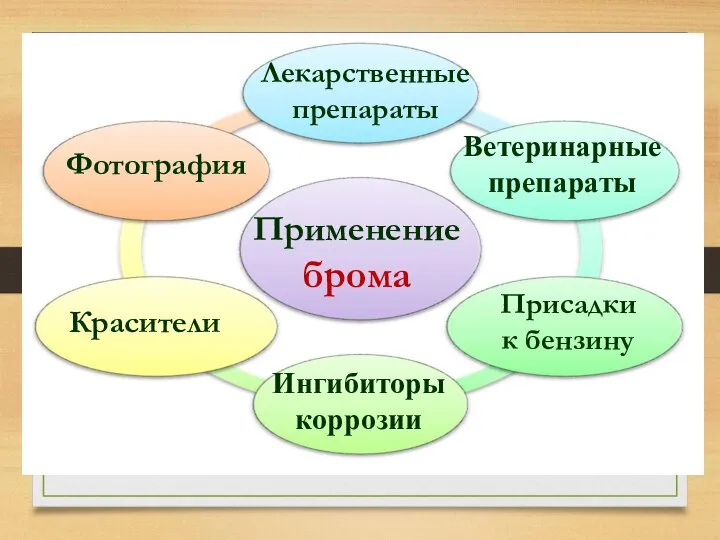
- 30. Применение брома Лекарственные препараты Красители Фотография Ветеринарные препараты Ингибиторы коррозии Присадки к бензину
- 32. Скачать презентацию






















 Презентация на тему Фосфор. Соединения фосфора
Презентация на тему Фосфор. Соединения фосфора  Ртуть
Ртуть Знаки химических элементов. 8 класс
Знаки химических элементов. 8 класс Спирты и фенолы
Спирты и фенолы Образование химических соединений с учетом валентности элементов
Образование химических соединений с учетом валентности элементов 5кл 20.10практична робота
5кл 20.10практична робота Презентация на тему Неорганические кислоты
Презентация на тему Неорганические кислоты  Классификация, номенклатуры, изомерия
Классификация, номенклатуры, изомерия Сталь 12Х18Н10Т
Сталь 12Х18Н10Т Электромагнитное облучение. Радиоактивное загрязнение
Электромагнитное облучение. Радиоактивное загрязнение Продукты и процессы переработки нефти
Продукты и процессы переработки нефти Презентация на тему Неорганічні речовини живих організмів
Презентация на тему Неорганічні речовини живих організмів  Химия. Спирты
Химия. Спирты Управления реакций
Управления реакций 03. Основы номенклатуры
03. Основы номенклатуры Из опыта использования интерактивной доски на уроках химии
Из опыта использования интерактивной доски на уроках химии Скорость химических реакций
Скорость химических реакций Ресурс Лови оксиды для систематизации знаний, умений, навыков по теме Оксиды
Ресурс Лови оксиды для систематизации знаний, умений, навыков по теме Оксиды Состав атома
Состав атома Метод высокоэффективной жидкостной хроматографии и тандемной масс-спектрометрии
Метод высокоэффективной жидкостной хроматографии и тандемной масс-спектрометрии Презентация на тему Комплексные соединения
Презентация на тему Комплексные соединения  Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Цезий сверхактивный 1860 г
Цезий сверхактивный 1860 г Основные понятия и законы химии
Основные понятия и законы химии Презентация на тему Галогены и здоровье человека
Презентация на тему Галогены и здоровье человека  Получение и химические свойства оксидов
Получение и химические свойства оксидов Оксиды. Классификация оксидов
Оксиды. Классификация оксидов Химия һәм сәламәт яшәү рәвеше
Химия һәм сәламәт яшәү рәвеше