Содержание
- 2. Структура силикатов с группами из тетраэдров [SiO4]4- конечных размеров Структуры с одномерными (бесконечными в одном измерении)
- 3. ЧАСТЬ 2 СИЛИКАТЫ И ДРУГИЕ ТУГОПЛАВКИЕ СОЕДИНЕНИЯ В РАЗЛИЧНЫХ СОСТОЯНИЯХ ХИМИЧЕСКАЯ СВЯЗЬ В СИЛИКАТАХ И ДРУГИХ
- 4. Связь Si – 0 – Si (силоксановая) угол связи Si—О—Si изменяется в от 120 до 180°
- 6. Полиморфизмом называется способность вещества одного и того же состава существовать в зависимости от внешних условий в
- 7. Структурная классификация типов полиморфизма
- 8. Энантиотропные и монотропные полиморфные превращения Энантиотропные превращения одной модификации вещества в другую имеют место, если обе
- 9. Факторы, влияющие на скорость и последовательность полиморфных превращений: 1 Температура правило ступенчатых переходов Оствальда, согласно которому
- 10. ДЕФЕКТЫ КРИСТАЛЛИЧЕСКОЙ РЕШЕТКИ Классификация дефектов тонкой структуры кристалла (микродефекты)
- 11. Дефекты грубой структуры (макродефекты). К ним относятся двухмерные и поверхностные дефекты (границы зерен, межфазные границы, поверхность
- 12. Твердые растворы Твердыми растворами (или смешанными кристталлами) называют однородные кристаллические фазы переменного состава Типы твердых растворов:
- 13. Твердые растворы замещения твердыми растворами замещения называются такие растворы, которые образуются в результате статистического замещения атомов
- 14. Твердые растворы внедрения - такие растворы, которые образуются в результате внедрения атомов или ионов одного вещества
- 15. Дефекты по Шоттки и Френкелю Атом или ион может переместиться из узла решетки, оставляя там вакансию,
- 16. Дислокации относятся к линейным дефектам решетки. По характеру искажений решетки дислокации делятся в чистом виде на
- 17. Вектор Бюргерса Построение вектора Бюргерса при краевой дислокации: а — идеальная решетка; б — решетка с
- 18. СТРОЕНИЕ РАСПЛАВОВ СИЛИКАТОВ Распределение интенсивности рассеяния рентгеновского излучения различными средами: 1 — газом; 2 — жидкостью:
- 19. СВОЙСТВА РАСПЛАВОВ СИЛИКАТОВ И ОКСИДОВ Вязкость расплавов. Вязкость характеризует силу внутреннего трения жидкости и определяется уравнением
- 20. Поверхностное натяжение и смачивающая способность силикатных расплавов Полная поверхностная энергия Es представляет собой сумму свободной поверхностной
- 21. Силикаты и другие соединения в стеклообразном состоянии ОСОБЕННОСТИ СТЕКЛООБРАЗНОГО СОСТОЯНИЯ 1) изотропность стеклообразных веществ, что означает
- 22. Теория аморфной непрерывной структуры стекла, или структурно-координационная гипотеза Захариассена—Уоррена Схема структурных решеток: а — кристаллического кремнезема;
- 23. Кристаллитная гипотеза А. А. Лебедева
- 24. Условия стеклообразования (В. Захариассен) В стеклах, как и в кристаллах, атомы должны быть увязаны в единую
- 25. Взаимосвязь некоторых кристаллохимических характеристик оксидов с их способностью к стеклообразованию
- 26. СВОЙСТВА СТЕКЛА Температурная зависимость вязкости Влияние химического состава на вязкость: влияние однозарядных катионов на вязкость силикатных
- 27. Силикаты в высокодисперсном состоянии Схема строения мицеллы кремниевой кислоты: (—) - потенциалопределяющне ионы SiO32- (+) -
- 28. Структуры, образующиеся в высокодисперсных системах (П. А. Ребиндер) коагуляционные (тиксотролно-обратимые) образуются при сцеплении частиц ван-дер-ваальсовыми силами
- 29. КРЕМНЕЗЕМ В ВЫСОКОДИСПЕРСНОМ СОСТОЯНИИ В химии кремнезема принята следующая терминология: растворимый кремнезем (или монокремниевая кислота) Si(OH)4;
- 30. ЧАСТЬ 3 УЧЕНИЕ О ФАЗОВЫХ РАВНОВЕСИЯХ И ФАЗОВЫЕ ДИАГРАММЫ СОСТОЯНИЯ СИЛИКАТНЫХ СИСТЕМ Общие понятия о диаграммах
- 31. Простые или сложные вещества, наименьшее число которых необходимо и достаточно для образования всех возможных фаз данной
- 32. ПРАВИЛО ФАЗ ГИББСА f=K+m–P , т. е. число степеней свободы (f) равновесной системы равно числу независимых
- 33. СИСТЕМА SiO2 характерные для системы SiO2 отклонения: 1. фазовые превращения между главными модификациями происходят очень медленно,
- 34. СИСТЕМА А12O3 разновидности глинозема, например δ-, η-, θ-, χ-, ρ Al2O3, были обнаружены при изучении процесса
- 35. СИСТЕМА MgO Оксид магния MgO — единственное кислородное соединение магния. Это соединение не обнаруживает полиморфных превращений
- 36. ДВУХКОМПОНЕНТНЫЕ ДИАГРАММЫ СОСТОЯНИЯ правило фаз Гиббса f=K+1—Р=2+1-P=3-P Координатные оси. Двухкомпонентные диаграммы состояния строятся в координатах температура
- 37. Диаграмма состояния двухкомпонентной системы с эвтектикой без химических соединений и твердых растворов Кривые tAE и tBE,
- 38. Ветви кривых ликвидуса пересекаются в точках, называемых точками эвтектики, а составы, соответствующие этим точкам, называются эвтектическими.
- 39. ПРАВИЛО РЫЧАГА И ЕГО ПРИМЕНЕНИЕ ДЛЯ КОЛИЧЕСТВЕННЫХ РАСЧЕТОВ В МНОГОКОМПОНЕНТНЫХ СИСТЕМАХ ФОРМУЛИРОВКА ПРАВИЛА РЫЧАГА если одна
- 40. Диаграмма состояния двухкомпонентной системы с химическим соединением, плавящимся без разложения (конгруэнтно) Для определения конечных фаз кристаллизации
- 41. Диаграмма состояния двухкомпонентной системы с химическим соединением, плавящимся с разложения (инконгруэнтно) Признаком инконгруентно плавящегося соединения является
- 42. Диаграмма состояния двухкомпонентной системы с ликвацией, полиморфными превращениями и химическими соединениями, разлагающимися или образующимися при изменении
- 43. Диаграмма состояния двухкомпонентной системы с непрерывным рядом твердых растворов Точки на кривой солидуса показывают состав твердой
- 44. Диаграмма состояния двухкомпонентной системы с ограниченным рядом твердых растворов точка E в системах с ограниченным рядом
- 45. СИСТЕМА Na2O-SiO2
- 46. СИСТЕМА CaO- SiO2 Метасиликат кальция CaO·SiO2 имеет две полиморфные модификации: низкотемпературную форму β- CaO·SiO2 (волластонит), устойчивую
- 47. Двухкальциевый силикат 2CaO·SiO2 — конгруэнтно плавящееся при 2130°С соединение, обладающее сложным и до конца не изученным
- 48. Трехкальциевый силикат 3CaO·SiO2. Это соединение имеет область стабильного существования от 1250 до 2070°С. Ниже температуры 1250°С
- 49. СИСТЕМА А12O3— SiO2 по Н. Боуэну и Дж. Грейгу по Н.А. Торопову и Ф.Я. Галахову муллит,
- 50. СИСТЕМА MgO—SiO2 Ортосиликат магния 2MgO·SiO2 (форстерит) — соединение, не имеющее полиморфных разновид-ностей, плавится конгруэнтно при 1890°С.
- 51. ТРЕХКОМПОНЕНТНЫЕ ДИАГРАММЫ СОСТОЯНИЯ f=K+m-p=3+1-p=4-p Для построения плоскостной проекционной диаграммы все элементы строения объемной фигуры прямо проецируются
- 52. ЭЛЕМЕНТЫ СТРОЕНИЯ ТРЕХКОМПОНЕНТНЫХ ДИАГРАММ 1. Все поле треугольника концентраций разделяется пограничными кривыми на отдель-ные области -
- 53. Треугольник концентраций. На его сторонах откладывается содержание компо-нентов, выражаемое обычно в % (мас). Вершины треугольника (А,
- 54. Трехкомпонентная диаграмма состояния системы с эвтектикой без химических соединений и твердых растворов Признаком эвтектики является то,
- 55. Правило №1 Определение направления падения температуры на пограничных кривых (правило температурного максимума): Температура на пограничной кривой
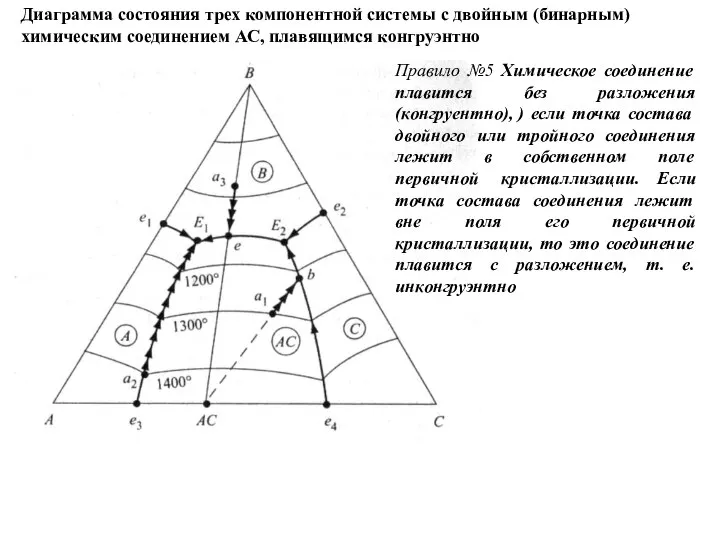
- 56. Диаграмма состояния трех компонентной системы с двойным (бинарным) химическим соединением АС, плавящимся конгруэнтно Правило №5 Химическое
- 57. Правило №6 Определение состава конечных кристаллических фаз после завершения кристаллизации трехкомпонентного расплава определяется по правилу элементарного
- 58. ПРИМЕНЕНИЕ ПРАВИЛА РЫЧАГА В ТРЕХКОМПОНЕНТНЫХ СИСТЕМАХ 1.Определение количественного содержания фаз образовавшихся за весь путь кристаллизации, при
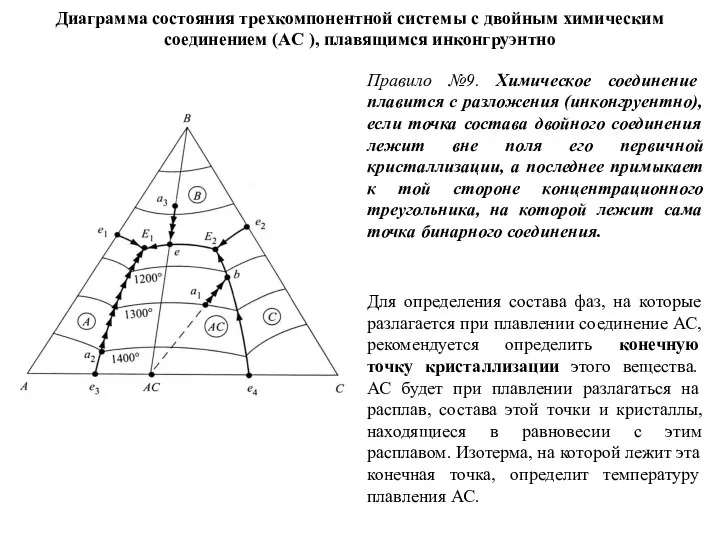
- 59. Диаграмма состояния трехкомпонентной системы с двойным химическим соединением (AC ), плавящимся инконгруэнтно Правило №9. Химическое соединение
- 60. конгруэнтные и инконгруэнтные пограничные линии: На конгруэнтных пограничных кривых происходит физический процесс кристаллизации (при понижении температуры)
- 61. Правило №11. Определение характера процесса вдоль инконгруентной пограничной линии. На инконгруэнтных пограничных кривых при охлаждении расплава
- 62. ТОЧКА ДВОЙНОГО ПОДЪЕМА Тройная инвариантная точка G отличается от тройной эвтектики Е, тем, что по двум
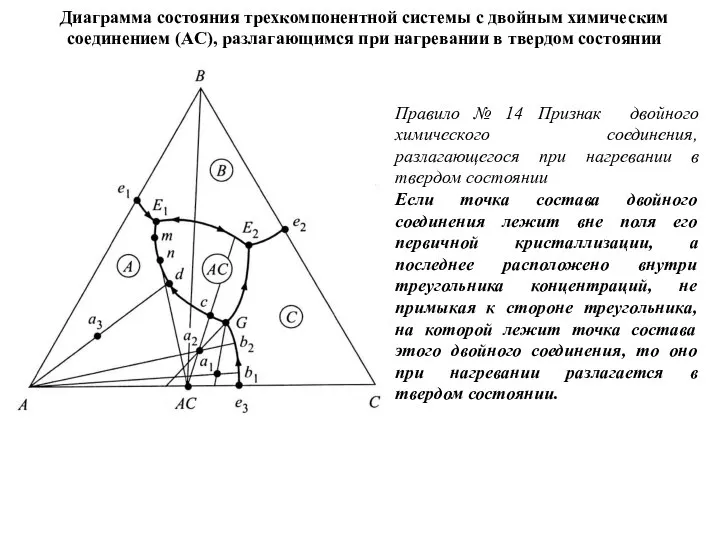
- 63. Диаграмма состояния трехкомпонентной системы с двойным химическим соединением (AC), разлагающимся при нагревании в твердом состоянии Правило
- 64. инвариантная тройная точка двойного опускания G, для которой по одной пограничной линии температура падает к точке,
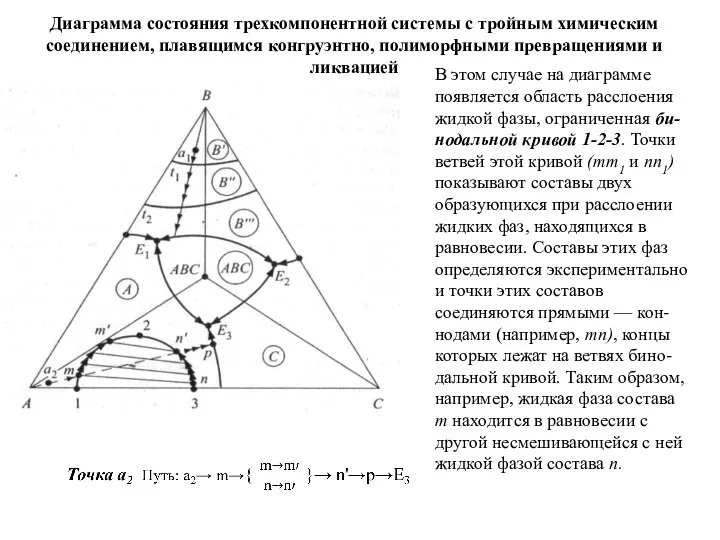
- 65. Диаграмма состояния трехкомпонентной системы с тройным химическим соединением, плавящимся конгруэнтно, полиморфными превращениями и ликвацией В этом
- 66. Диаграмма состояния трехкомпонентной системы с тройным химическим соединением, плавящимся инконгруэнтно Признаком тройного соединения, плавящегося инконгруентно, согласно
- 67. Последовательность операций для определения пути кристаллизации Определить химический состав исходного расплава, соответствующей данной точке на диаграмме.
- 68. СИСТЕМА Na2O-CaO-SiO2 Богатое кремнеземом тройное соединение девитрит Na2O·3CaO·6SiO2 плавится инконгруэтно при 1047°С, разлагаясь на кристаллы β-CaO·SiO2
- 69. СИСТЕМА CaO-Al2O3-SiO2 Тройные соединения в этой системе представлены анортитом (известковым полевым шпатом) СаО·Al2O3·2 SiO2 и геленитом
- 70. СИСТЕМА MgO- Al2O3- SiO2 Кордиерит 2MgO·2Al2O3·5SiO2 плавится инконгруэнтно при 1540°С, разлагаясь на жидкость и кристаллы муллита.
- 71. СИСТЕМА СаО—MgO — SiO2 Монтичеллит CaO·-MgO·SiO2 является соединением, плавящимся инконгруэнтно при 1485°С с разложением на жидкость
- 72. МЕТОДЫ ПОСТРОЕНИЯ ДИАГРАММ СОСТОЯНИЯ ДИНАМИЧЕСКИЙ МЕТОД ПОСТРОЕНИЯ ДИАГРАММ СОСТОЯНИЯ СТАТИЧЕСКИЙ МЕТОД ПОСТРОЕНИЯ ДИАГРАММ СОСТОЯНИЯ Принцип этого
- 73. ЧАСТЬ 4 ПРОЦЕССЫ ПРИ СИНТЕЗЕ СИЛИКАТНЫХ И ДРУГИХ ТУГОПЛАВКИХ СОЕДИНЕНИЙ ДИССОЦИАЦИЯ Диссоциация –химический процесс распада молекул,
- 74. Температура диссоциации зависит от природы вещества, например для карбонатов щелочноземельных металлов повышается в ряду: MgCO3(640°C)˂CaCO3(900°C)˂SrCO3(1100°C)˂BaCO3(1400°C) Реальная
- 75. ДЕГИДРАТАЦИЯ В зависимости от вида и роли воды в структуре ее можно разделить на Конституционную, Кристаллизационную,
- 76. Дегидратация – процесс удаления из минералов связанной воды, который происходит под воздействием внешних факторов Дегидратацию может
- 77. РЕАКЦИИ ВЕЩЕСТВ В ТВЕРДОМ СОСТОЯНИИ (ТВЕРДОФАЗОВЫЕ РЕАКЦИИ) Под твердофазовьши реакциями понимают реакции, протекающие за счет непосредственного
- 78. Диффузионные процессы при твердофазовых реакциях В зависимости от пути перемещения диффундирующих частиц различают объемную диффузию (в
- 79. Механизм диффузии в твердых телах Механизм диффузии катиона в кристаллической решетке (0 — анион, ©— катион):
- 80. Особенности реакций в твердом состоянии 1. Направление химической реакции в смесях твердых веществ может не совпадать
- 81. Кинетика твердофазовых реакций Видоизмененная формула Яндера для изотермических условий имеет вид: (3), Где y -степень превращения
- 82. A.M. Гинстлинг и Б.И. Броунштейн рассмотрели кинетическую модель процесса твердофазового взаимодействия, учитывающую сферичность реагирующих зерен в
- 83. Факторы, влияющие на скорость твердофазовых реакций 1. Температура. где А - коэффициент, формально равный коэффициенту диффузии
- 84. СПЕКАНИЕ Сущность, движущая сила и виды спекания В общем случае под спеканием понимается происходящий при высоких
- 85. Твердофазовое спекание Величину этого всестороннего давления сжатия (р) можно оценить из соотношения р =σ/r·П(1-П0), где σ-
- 86. Механизм твердофазового спекания По Френкелю, твердофазовое спекание осуществляется за счет диффузионной ползучести твердого тела при высокой
- 87. Механизм твердофазового спекания Б.Я. Пинес дал механизму твердофазового спекания атомистическое объяснение, исходя из чисто диффузионной трактовки
- 88. Кинетика твердофазового спекания Я.И. Френкель описал кинетику спекания на стадии, характеризующейся исчезновением открытых и образованием замкнутых
- 89. Жидкостное спекание Спекание с участием жидкой фазы (расплава), образующегося в твердом зернистом теле за счет плавления
- 90. Спекание за счет процесса “испарние — конденсация” Механизм подобного переноса вещества с одной поверхности на другую
- 91. Факторы, влияющие на процесс спекания 1. Температура и время спекания 2. Гранулометрический состав порошков Скорость и
- 92. РЕКРИСТАЛЛИЗАЦИЯ Рекристаллизация — происходящий в твердой фазе процесс роста одних кристаллов твердого тела при его термической
- 93. Вторичная рекристаллизация Вторичная рекристаллизация представляет собой происходящий при нагревании твердого тела процесс роста небольшого числа крупных
- 94. Механизм роста зерен при вторичной рекристаллизации, обусловленного перемещением межзеренных границ, заключается в переносе вещества через границу
- 95. ПЛАВЛЕНИЕ Плавление — происходящий при нагревании фазовый переход вещества из твердого состояния в жидкое. Изменение энергии
- 96. Температура плавления, определяющая их тугоплавкость. Условием высокой темпе-ратуры плавления (Tпл) является соотношение Tпл = НПЛ/SПЛ, где
- 97. КРИСТАЛЛИЗАЦИЯ Кристаллизация представляет собой фазовое превращение, в результате которого из структурно неупорядоченной фазы — газа, раствора,
- 98. Гомогенное образование центров кристаллизации Образование любой новой поверхности требует затрат энергии, что для сферического зародыша сопровождается
- 99. Гетерогенное образование центров кристаллизации По Фольмеру, энергию активации ΔG''mах процесса гетерогенного зародышеобразования можно выразить в виде:
- 100. Рост кристаллов Дислокационный механизм роста кристаллов: 1 — атомная ступенька на грани кристалла (выход винтовой дислокации);
- 101. Кинетика процесса зародышеобразования и роста кристаллов Скорость гомогенного образования центров кристаллизации, пропорциональная вероятности появления устойчивого зародыша,
- 102. Уравнение Р. Беккера, для скорости гомогенного зародышеобразования в конденсированных системах имеет вид: Кинетика процесса зародышеобразования и
- 104. Скачать презентацию
Слайд 2Структура силикатов с группами из тетраэдров [SiO4]4- конечных размеров
Структуры с одномерными
Структура силикатов с группами из тетраэдров [SiO4]4- конечных размеров
Структуры с одномерными
![Структура силикатов с группами из тетраэдров [SiO4]4- конечных размеров Структуры с одномерными](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1035518/slide-1.jpg)
Структуры с двухмерными слоями из тетраэдров [SiO4]4- —слоистые структуры
Структуры с трехмерным непрерывным каркасом из тетраэдров [SiO4]4-—каркасные структуры – кварц, альбит, микроклин, ортоклаз, анортит
Слайд 3ЧАСТЬ 2 СИЛИКАТЫ И ДРУГИЕ ТУГОПЛАВКИЕ СОЕДИНЕНИЯ
В РАЗЛИЧНЫХ СОСТОЯНИЯХ
ХИМИЧЕСКАЯ СВЯЗЬ В
ЧАСТЬ 2 СИЛИКАТЫ И ДРУГИЕ ТУГОПЛАВКИЕ СОЕДИНЕНИЯ
В РАЗЛИЧНЫХ СОСТОЯНИЯХ
ХИМИЧЕСКАЯ СВЯЗЬ В
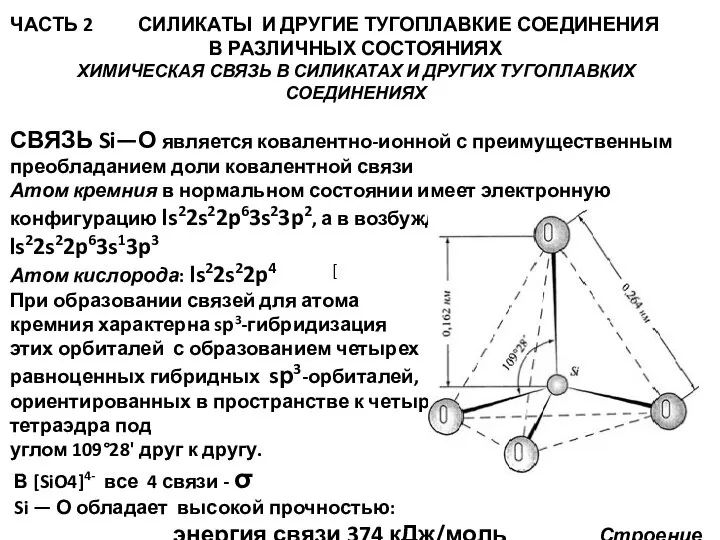
СВЯЗЬ Si—О является ковалентно-ионной с преимущественным преобладанием доли ковалентной связи
Атом кремния в нормальном состоянии имеет электронную конфигурацию ls22s22p63s23p2, а в возбужденном состоянии — ls22s22p63s13p3
Атом кислорода: ls22s22p4
При образовании связей для атома
кремния характерна sр3-гибридизация
этих орбиталей с образованием четырех
равноценных гибридных sр3-орбиталей,
ориентированных в пространстве к четырем вершинам правильного тетраэдра под
углом 109°28' друг к другу.
В [SiO4]4- все 4 связи - σ
Si — О обладает высокой прочностью:
энергия связи 374 кДж/моль Строение кремнекислородного тетраэдра [SiO4]4-
[
Слайд 4Связь Si – 0 – Si (силоксановая) угол связи Si—О—Si изменяется в
Связь Si – 0 – Si (силоксановая) угол связи Si—О—Si изменяется в

При sр3-гибридизации орбиталей атома кислорода смешиваются одна 2s- и три 2р-орбитали с образованием четырех гибридных sр3-орбиталей, направленных тетраэдрически под углом 109 28' по отношению друг к другу. Эти орбитали образуют две σ-связи с двумя атомами кремния
При sр2-гибридизации орбиталей атома кислорода смешиваются 2s- и две 2р-орбитали с неспаренными электронами с образованием трех гибридных орбиталей, лежащих в одной плоскости и направленных к вершинам правильного треугольника под углом 120°. Две из этих гибридных орбиталей с неспаренными электронами образуют по одной σ-связи с каждым атомом кремния за счет перекрывания с его sр3-орбиталями (угол связи 120°). Третья гибридная орбиталь атома кислорода со спаренными электронами в связи не участвует. Негибридизированная 2р-орбиталь атома кислорода со спаренными электронами участвует в образовании донорно-акцепторной. Таким образом, sp2- гибридизация орбиталей атома кислорода обеспечивает образование двух σ-связей и одной π-связи с двумя атомами кремния πР—πd связи за счет перекрывания со свободными d-орбиталями атомов кремния.
При sp-гибридизации атома кислорода образуются две гибридные орбитали под углом 180°, на каждой из которых находится по одному неспаренному электрону. Эти орбитали за счет перекрывания с spЗ-орбиталями атома кремния образуют две σ-связи с двумя атомами кремния. Две оставшихся негибридизированных р-орбиталей кислорода с d-орбиталями атомов кремния образуются еще две π-связи.
Слайд 6Полиморфизмом называется способность вещества одного и того же состава существовать в зависимости
Полиморфизмом называется способность вещества одного и того же состава существовать в зависимости
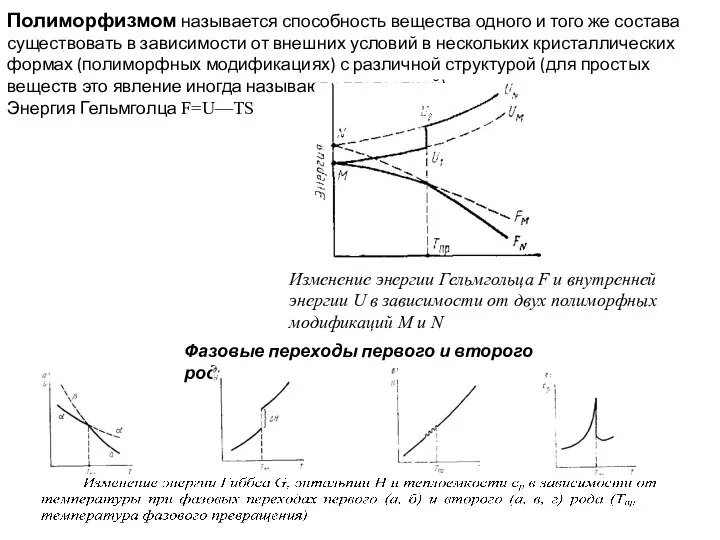
Энергия Гельмголца F=U—TS
Изменение энергии Гельмгольца F и внутренней энергии U в зависимости от двух полиморфных модификаций М и N
Фазовые переходы первого и второго рода
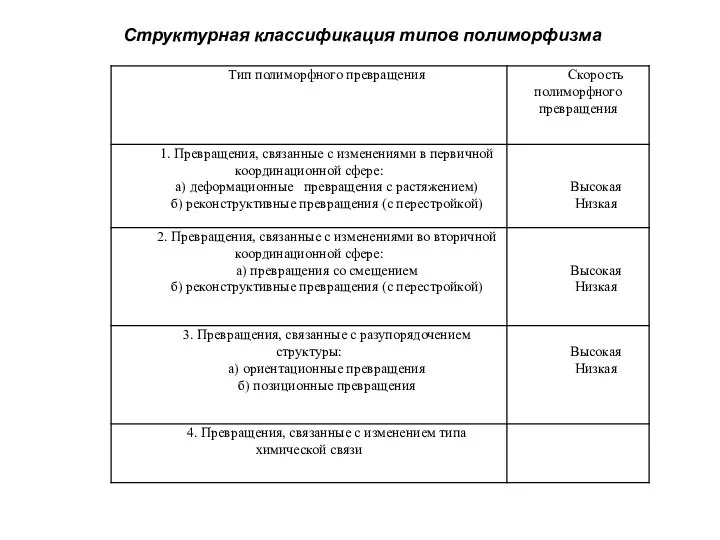
Слайд 7Структурная классификация типов полиморфизма
Структурная классификация типов полиморфизма
Слайд 8Энантиотропные и монотропные полиморфные превращения
Энантиотропные превращения одной модификации вещества в другую имеют
Энантиотропные и монотропные полиморфные превращения
Энантиотропные превращения одной модификации вещества в другую имеют
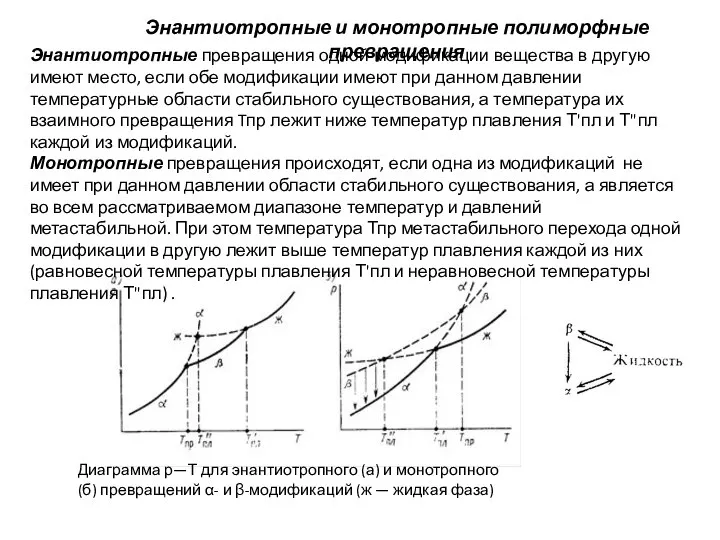
Монотропные превращения происходят, если одна из модификаций не имеет при данном давлении области стабильного существования, а является во всем рассматриваемом диапазоне температур и давлений метастабильной. При этом температура Тпр метастабильного перехода одной модификации в другую лежит выше температур плавления каждой из них (равновесной температуры плавления Т'пл и неравновесной температуры плавления Т"пл) .
Диаграмма р—Т для энантиотропного (а) и монотропного (б) превращений α- и β-модификаций (ж — жидкая фаза)
Слайд 9Факторы, влияющие на скорость и последовательность полиморфных превращений:
1 Температура
правило ступенчатых переходов
Факторы, влияющие на скорость и последовательность полиморфных превращений:
1 Температура
правило ступенчатых переходов

2 Давление. С термодинамической точки зрения влияние давления на полиморфные превращения регулируется уравнением Клаузиуса — Клапейрона:
dP/dT=Q/T∆V Если при полиморфном превращении, например, низкотемпературной модификации А1 с удельным объемом V1 в высокотемпературную модификацию А2 с удельным объемом V2 теплота фазового перехода Q положительна (теплота поглощается), то знак величины dp/dT будет зависеть от знака ∆V=V2—V1. При ∆V>0 (высокотемпературная форма имеет больший удельный объем) величина dP/dT>0, т. е. увеличение давления будет смещать температуру полиморфного превращения в сторону повышения, при ∆V<0 (высокотемпературная форма имеет меньший удельный объем) величина dP/dT <0, т. е. увеличение давления будет облегчать полиморфный переход, приводя к снижению температуры полиморфного превращения.
3. Влияние нетепловых форм энергии
4. Влияние примесных веществ
Политипизм: вещество может кристаллизоваться в нескольких модификациях, отличающихся типом упаковки атомов. Политипизм можно назвать условно полиморфизмом в одном направлении, поскольку политипные модификации имеют одинаковые параметры элементарной ячейки по двум кристаллографическим направлениям и разные по третьему направлению, что объясняется различием в способе упаковки атомных слоев в этом направлении
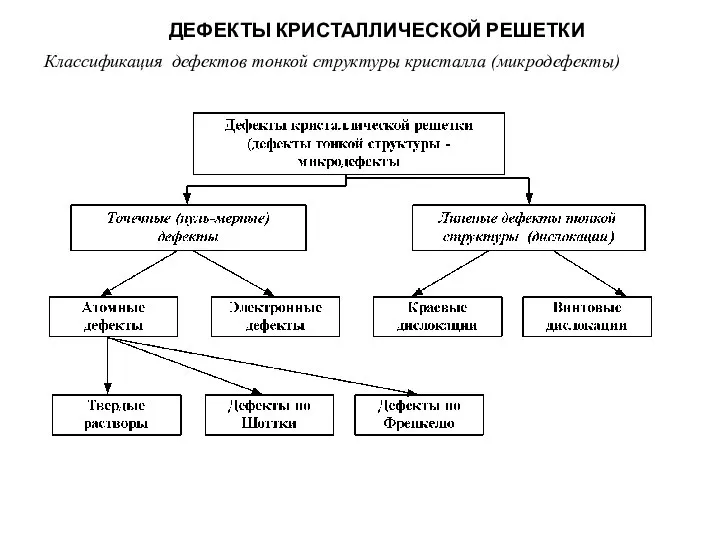
Слайд 10ДЕФЕКТЫ КРИСТАЛЛИЧЕСКОЙ РЕШЕТКИ
Классификация дефектов тонкой структуры кристалла (микродефекты)
ДЕФЕКТЫ КРИСТАЛЛИЧЕСКОЙ РЕШЕТКИ
Классификация дефектов тонкой структуры кристалла (микродефекты)
Слайд 11Дефекты грубой структуры (макродефекты). К ним относятся двухмерные и поверхностные дефекты (границы
Дефекты грубой структуры (макродефекты). К ним относятся двухмерные и поверхностные дефекты (границы

К электронным нульмерным дефектам принадлежат избыточные электроны, дырки и экситоны.
К атомным нульмерным дефектам относятся вакансии (незанятые узлы решетки), примесные атомы, замещающие собственные атомы вещества в их регулярном положении (в узлах решетки), и собственные или примесные атомы, находящиеся (дислоцированные) в иррегулярном положении в междоузлиях решетки (частицы, находящиеся в междоузлиях, иногда называют междоузельными.
1— вакансия; 2 — примесный атом в узле решетки; 3 —примесный атом в междоузлии
Слайд 12Твердые растворы
Твердыми растворами (или смешанными кристталлами) называют однородные кристаллические фазы переменного
Твердые растворы
Твердыми растворами (или смешанными кристталлами) называют однородные кристаллические фазы переменного
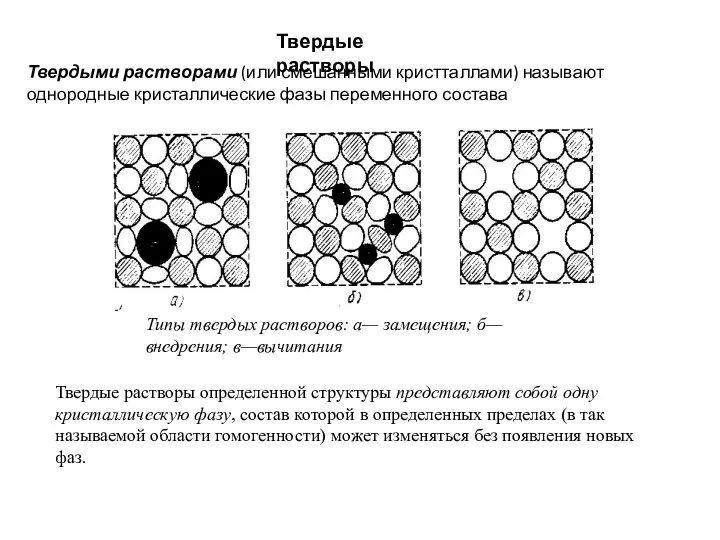
Типы твердых растворов: а— замещения; б— внедрения; в—вычитания
Твердые растворы определенной структуры представляют собой одну кристаллическую фазу, состав которой в определенных пределах (в так называемой области гомогенности) может изменяться без появления новых фаз.
Слайд 13Твердые растворы замещения
твердыми растворами замещения называются такие растворы, которые образуются в результате
Твердые растворы замещения
твердыми растворами замещения называются такие растворы, которые образуются в результате

оливины — тв. раствор между форстеритом 2MgO-SiO2 и фаялитом 2FeO-SiO2— происходит взаимное замещение катионов Mg2+ и Fe2+ (замещение типа Mg2+↔Fe2+), а при образовании твердых растворов между КCl и КВг имеет место замещение типа С1-↔Вг-.
условия, определяющие возможность образования твердых растворов замещения
1. размеры замещаемого и замещающего атомов или ионов не сильно отличались друг от друга
2. сходство электронного строения взаимодействующих атомов или ионов, определяющее близость типа химической связи и поляризационных свойств замещающих друг друга атомов или ионов
3.необходимость при изоморфных замещениях сохранения электронейтральности решетки, поскольку последняя в целом не может быть заряжена.
Слайд 14Твердые растворы внедрения - такие растворы, которые образуются в результате внедрения атомов
Твердые растворы внедрения - такие растворы, которые образуются в результате внедрения атомов

Условия образования твердых растворов внедрения во многом противоположны условиям образования твердых растворов замещения
1. размер внедряющихся атомов должен соответствовать объему пустот в междоузлиях вещества-растворителя
2. атомы внедряющегося вещества могут заведомо отличаться от атомов основного вещества электронным строением, поляризационными свойствами и типом химической связи
3. условия сохранения электронейтральности решетки обычно достигается за счет образования вакансий, одновременного возникновения твердых растворов замещения или изменения в электронной структуре атомов
4. твердые растворы внедрения в отличие от твердых растворов замещения могут быть только ограниченными
Дефекты нестехиометрии (растворы вычитания).
Область составов, лежащих внутри граничных значений нарушения стехиометрического состава, называется областью гомогенности или областью нестехиометрии. Постоянный и неизменный химический состав, соответствующий стехиометрической формуле, могут иметь только соединения с молекулярными решетками
Слайд 15Дефекты по Шоттки и Френкелю
Атом или ион может переместиться из узла решетки,
Дефекты по Шоттки и Френкелю
Атом или ион может переместиться из узла решетки,

Схематическое изображение дефектов по Френкелю (а) и по Шоттки (б) (в —идеальная решетка)
Энергия образования дефектов по Шоттки при прочих равных условиях меньше, чем дефектов по Френкелю, поскольку размещение атома в междоузлии требует обычно значительных энергетич-еских затрат. В связи с этим дефекты по Шоттки образуются легче, чем дефекты по Френкелю.
Слайд 16Дислокации относятся к линейным дефектам решетки. По характеру искажений решетки дислокации делятся
Дислокации относятся к линейным дефектам решетки. По характеру искажений решетки дислокации делятся
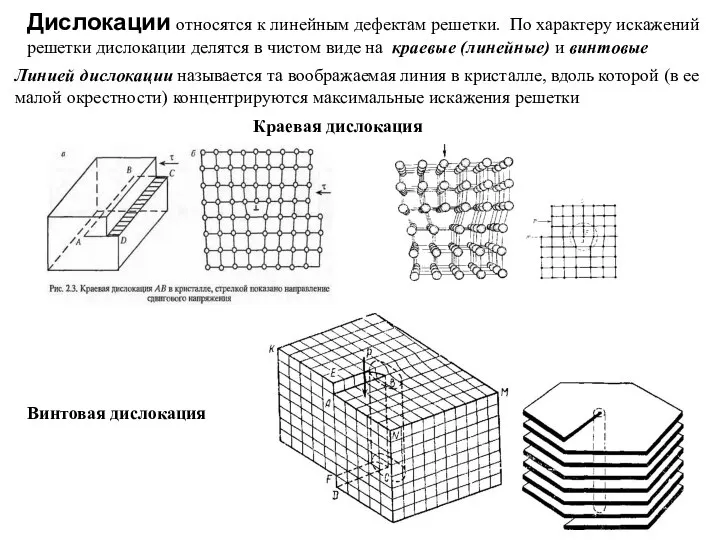
Линией дислокации называется та воображаемая линия в кристалле, вдоль которой (в ее малой окрестности) концентрируются максимальные искажения решетки
Краевая дислокация
Винтовая дислокация
Слайд 17Вектор Бюргерса
Построение вектора Бюргерса при краевой дислокации: а — идеальная решетка; б
Вектор Бюргерса
Построение вектора Бюргерса при краевой дислокации: а — идеальная решетка; б
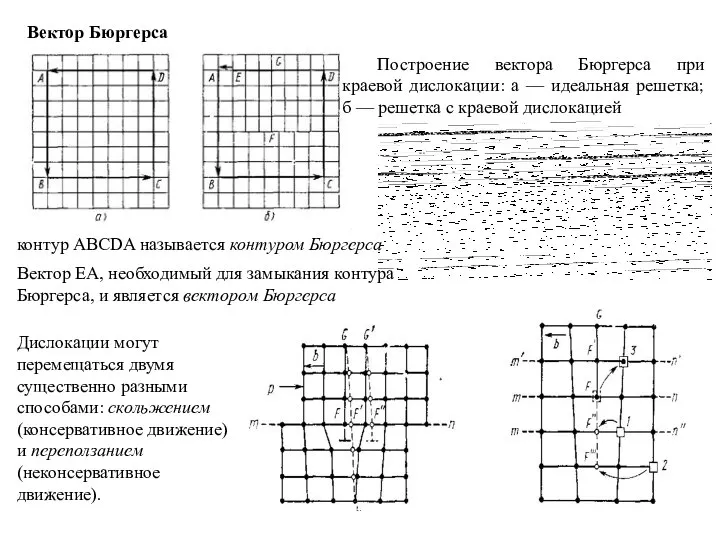
контур ABCDA называется контуром Бюргерса
Вектор ЕА, необходимый для замыкания контура Бюргерса, и является вектором Бюргерса
Дислокации могут перемещаться двумя существенно разными способами: скольжением (консервативное движение) и переползанием (неконсервативное движение).
Слайд 18СТРОЕНИЕ РАСПЛАВОВ СИЛИКАТОВ
Распределение интенсивности рассеяния рентгеновского излучения различными средами: 1 — газом;
СТРОЕНИЕ РАСПЛАВОВ СИЛИКАТОВ
Распределение интенсивности рассеяния рентгеновского излучения различными средами: 1 — газом;

В жидкостях при отсутствии дальнего порядка может существовать ближний порядок, выражающийся в правильности расположения около каждой частицы частиц ближайшего ее окружения
Гипотеза бездефектной жидкости (Д. Бернал): жидкость имеет структуру, мало отличающуюся от геометрии кристалла, из которого она получена. Квазикристаллич-еская гипотеза (И. Френкель): жидкость, особенно вблизи температуры кристалли-зации, рассматривается как искаженный кристалл, в котором утрачен дальний поря-док, но сохранен ближний и отличающаяся от кристаллов значительно большим чис-ом дефектов. Гипотеза «роев или сиботаксисов»(Г. Стюарт), в жидкости суще-ствуют агрегаты, называемые сиботаксическими группами, представляющими собой псевдокристаллические образования, строение которых приближается к строению соответствующих кристаллов, выделяющихся из жидкости при кристаллизации. Структуру сиботаксических групп - искаженная структура кристаллов. Они подвижны и разрушаются при движении и создаются вновь. Эти группы разделены областями беспорядочного расположения частиц, однако резких переходов между областями с частично упорядоченным и неупорядоченным расположением частиц не существует.
Слайд 19СВОЙСТВА РАСПЛАВОВ СИЛИКАТОВ И ОКСИДОВ
Вязкость расплавов.
Вязкость характеризует силу внутреннего трения жидкости и
СВОЙСТВА РАСПЛАВОВ СИЛИКАТОВ И ОКСИДОВ
Вязкость расплавов.
Вязкость характеризует силу внутреннего трения жидкости и

F=η ( υ1- υ2)/x∙S,
где F — приложенная сила;
η — коэффициент пропорциональности (вязкость);
υ1 — скорость движения первого слоя;
υ2—скорость движения второго слоя;
х- расстояние между слоями;
S — поверхность соприкосновения слоев.
Коэффициент вязкости равен η=(F/S)/(dυ/dx),
где dυ/dx — градиент скорости движения. Р
азмерность Па·с (СИ).
η - это динамическая вязкость, (η /ρ)- кинематичес-кая вязкость, (1/ η) - текучесть,
Слайд 20Поверхностное натяжение и смачивающая способность силикатных расплавов
Полная поверхностная энергия Es представляет собой
Поверхностное натяжение и смачивающая способность силикатных расплавов
Полная поверхностная энергия Es представляет собой

Поверхностным натяжением σ называется сила, действующая на единицу длины тангенциально к поверхности (Дж/м2 или Н/м)
Основными параметрами, определяющими поверхностное натяжение расплавов, так же, как и вязкость, являются состав и температура
Способность к смачиванию характеризуют значением краевого угла смачивания или косинуса этого угла
Схема действия сил на границе раздела трех фаз —твердой (т), жидкой (ж) и газообразной (г): а —расплав смачивает поверхность твердой фазы; б — расплав не смачивает поверхность твердой фазы
σтг = σтж + σжг cos Ѳ
Слайд 21Силикаты и другие соединения в стеклообразном состоянии
ОСОБЕННОСТИ СТЕКЛООБРАЗНОГО СОСТОЯНИЯ
1) изотропность стеклообразных веществ,
Силикаты и другие соединения в стеклообразном состоянии
ОСОБЕННОСТИ СТЕКЛООБРАЗНОГО СОСТОЯНИЯ
1) изотропность стеклообразных веществ,
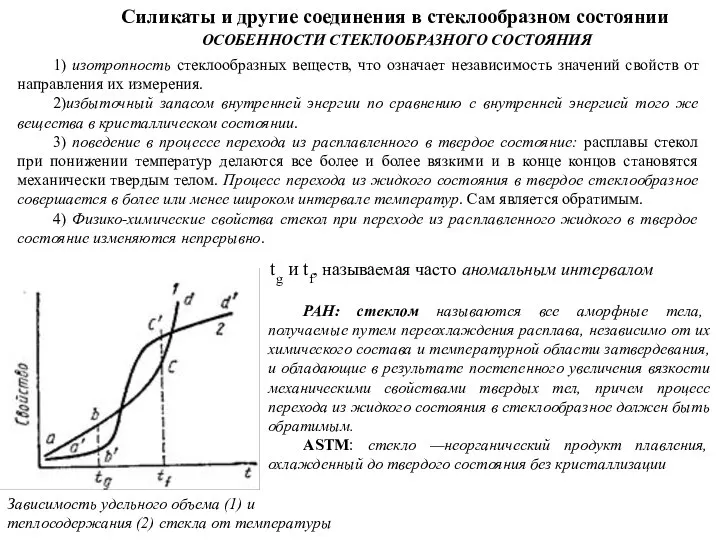
2)избыточный запасом внутренней энергии по сравнению с внутренней энергией того же вещества в кристаллическом состоянии.
3) поведение в процессе перехода из расплавленного в твердое состояние: расплавы стекол при понижении температур делаются все более и более вязкими и в конце концов становятся механически твердым телом. Процесс перехода из жидкого состояния в твердое стеклообразное совершается в более или менее широком интервале температур. Сам является обратимым.
4) Физико-химические свойства стекол при переходе из расплавленного жидкого в твердое состояние изменяются непрерывно.
Зависимость удельного объема (1) и теплосодержания (2) стекла от температуры
tg и tf, называемая часто аномальным интервалом
РАН: стеклом называются все аморфные тела, получаемые путем переохлаждения расплава, независимо от их химического состава и температурной области затвердевания, и обладающие в результате постепенного увеличения вязкости механическими свойствами твердых тел, причем процесс перехода из жидкого состояния в стеклообразное должен быть обратимым.
ASTM: стекло —неорганический продукт плавления, охлажденный до твердого состояния без кристаллизации
Слайд 22Теория аморфной непрерывной структуры стекла, или структурно-координационная гипотеза Захариассена—Уоррена
Схема структурных решеток: а
Теория аморфной непрерывной структуры стекла, или структурно-координационная гипотеза Захариассена—Уоррена
Схема структурных решеток: а
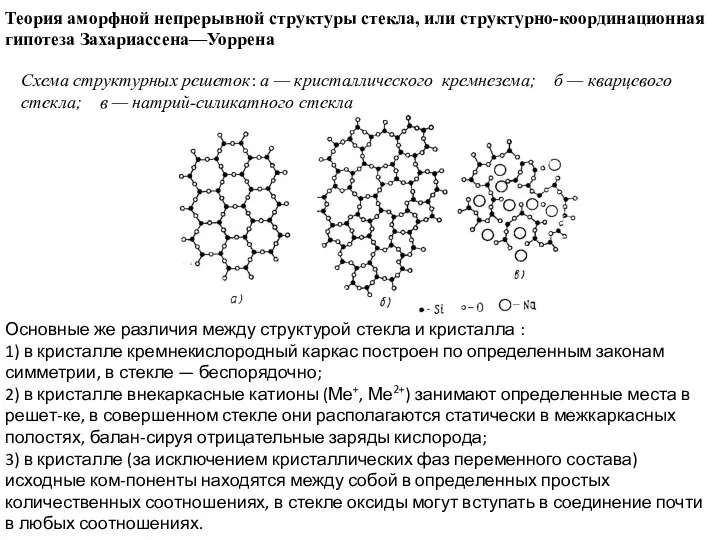
Основные же различия между структурой стекла и кристалла :
1) в кристалле кремнекислородный каркас построен по определенным законам симметрии, в стекле — беспорядочно;
2) в кристалле внекаркасные катионы (Ме+, Ме2+) занимают определенные места в решет-ке, в совершенном стекле они располагаются статически в межкаркасных полостях, балан-сируя отрицательные заряды кислорода;
3) в кристалле (за исключением кристаллических фаз переменного состава) исходные ком-поненты находятся между собой в определенных простых количественных соотношениях, в стекле оксиды могут вступать в соединение почти в любых соотношениях.
Слайд 23Кристаллитная гипотеза А. А. Лебедева
Кристаллитная гипотеза А. А. Лебедева

Слайд 24Условия стеклообразования (В. Захариассен)
В стеклах, как и в кристаллах, атомы должны
Условия стеклообразования (В. Захариассен)
В стеклах, как и в кристаллах, атомы должны

Для создания такой структуры необходимо. чтобы
1) каждый ион кислорода должен быть связан не более чем с двумя катионами;
2) координационное число окруженных ионами кислорода центральных катионов должно быть небольшим, не более 4;
3) кислородные многогранники могут связываться друг с другом через общие углы таким образом, что образуются трехмерные пространственные решетки;
4) каждый многогранник должен быть связан с другими, по крайней мере, тремя общими углами.
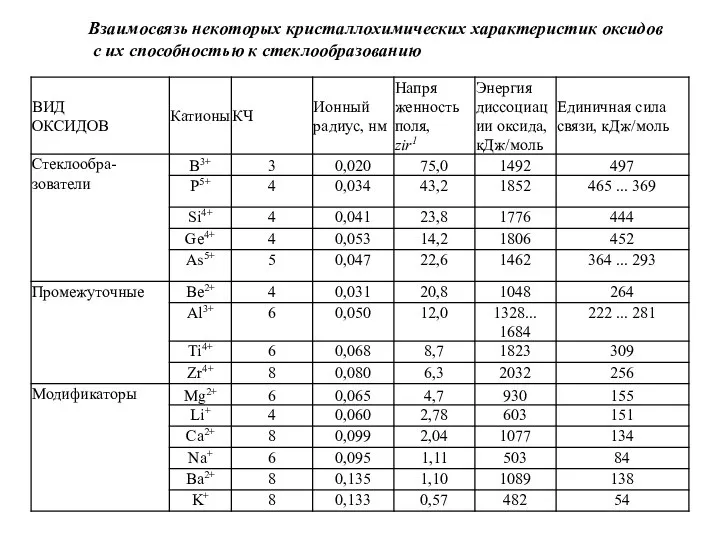
Слайд 25Взаимосвязь некоторых кристаллохимических характеристик оксидов
с их способностью к стеклообразованию
Взаимосвязь некоторых кристаллохимических характеристик оксидов
с их способностью к стеклообразованию
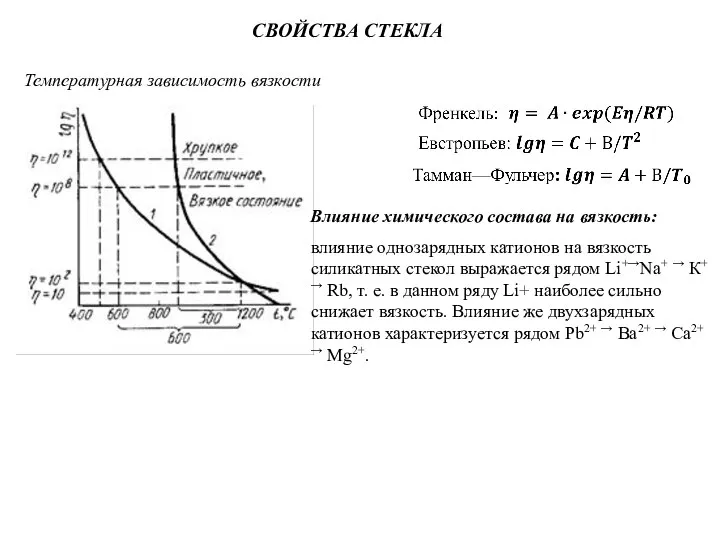
Слайд 26СВОЙСТВА СТЕКЛА
Температурная зависимость вязкости
Влияние химического состава на вязкость:
влияние однозарядных катионов на вязкость
СВОЙСТВА СТЕКЛА
Температурная зависимость вязкости
Влияние химического состава на вязкость:
влияние однозарядных катионов на вязкость
Слайд 27Силикаты в высокодисперсном состоянии
Схема строения мицеллы кремниевой кислоты: (—) - потенциалопределяющне ионы
Силикаты в высокодисперсном состоянии
Схема строения мицеллы кремниевой кислоты: (—) - потенциалопределяющне ионы

электрокинетический потенциал(ξ-потенциал). — потенциал границы скольжения фаз, определяемый как разность потенциалов между адсорбционным слоем жид-кости, неподвижно связанным с поверхностью твердой фазы, и всей остальной (подвижной) массой жидкости
Электроосмосом называется перенос жидкости под действием внешнего электрического поля, наблюдаемый как в капиллярно-пористых телах, так и в одиночных капиллярах.
При этом частицы переносятся в электрическом поле с постоянной скоростью, которая тем больше, чем выше разность потенциалов и диэлектрическая проницаемость среды.
Электрофорезом называется перемещение частиц дисперсной фазы в электрическом поле.
Потенциал течения — явление, обратное электроосмосу, представляет собой разность потенциалов между концами одиночного капилляра при протекании через него воды или разбавленного раствора под действием внешего давления.
Слайд 28Структуры, образующиеся в высокодисперсных системах (П. А. Ребиндер)
коагуляционные (тиксотролно-обратимые) образуются при
Структуры, образующиеся в высокодисперсных системах (П. А. Ребиндер)
коагуляционные (тиксотролно-обратимые) образуются при

конденсационно-кристаллизационные (необратимо-разрушающиеся) структуры возникают в результате срастания частиц химическими силами с формированием жесткой структуры. При срастании аморфных частиц образуется структура, называемая конденсационной, кристаллических частиц — кристаллизационной.
Коагуляционные структуры. Достигнув определенного размера, агрегированные частицы образуют коагуля.). При вовлечении дисперсионной среды в пространственную сетку агрегирующихся частиц имеет место гелеобразование, т. е. переход коллоидного раствора из свободнодисперсного состояния (золя) в связнодисперсное (гель). В зависимости от природы вещества различают хрупкие (неэластичные) гели и эластичные гели (студни).
Конденсационно-кристаллизационные структуры. Эти структуры, формирующиеся в результате образования прочных химических связей между частицами (конденсационные структуры) либо вследствие сращивания кристаллов в 'процессе возникновения новой фазы (кристаллизационные структуры), не проявляют тиксотропии, пластичности и эластичности, а обладают упруго-хрупкими свойствами.
Слайд 29КРЕМНЕЗЕМ В ВЫСОКОДИСПЕРСНОМ СОСТОЯНИИ
В химии кремнезема принята следующая терминология:
растворимый кремнезем (или монокремниевая
КРЕМНЕЗЕМ В ВЫСОКОДИСПЕРСНОМ СОСТОЯНИИ
В химии кремнезема принята следующая терминология:
растворимый кремнезем (или монокремниевая

поликремниевая кислота (олигомеры), представляющая собой полимер с относительной молекулярной массой (по SiO2) до 1000;
коллоидный кремнезем, имеющий более высокую молекулярную массу, чем поликремниевая кислота, с диаметром частиц более 5 нм;
золь кремнезема — термин, относимый как к поликремниевым кислотам, так и к коллоидному кремнезему.
Разновидности кремнезема :
безводный кристаллический кремнезем SiO2 ;
гидратированный кристаллический кремнезем SiO2·xH2O;
безводный аморфный кремнезем, имеющий микропористое анизотропное строение (волокнистого или пластинчатого строения);
безводный и содержащий воду кремнезем, имеющий изотропное строение (золи, гели, тонкодисперсные порошки);
аморфное кварцевое стекло.
Растворение и осаждение кремнезема в воде, катализируемое ионами ОН-, протекает по схеме (SiO2)x + 2Н2O ↔ , (SiO2)x-1 + Si(ОН)4
Процесс полимеризации: конденсация силанольных групп по схеме
≡ SiOH + HOSi ≡ → ≡SiOSi ≡+ Н2O
Слайд 30ЧАСТЬ 3 УЧЕНИЕ О ФАЗОВЫХ РАВНОВЕСИЯХ И ФАЗОВЫЕ
ДИАГРАММЫ СОСТОЯНИЯ СИЛИКАТНЫХ СИСТЕМ
Общие
ЧАСТЬ 3 УЧЕНИЕ О ФАЗОВЫХ РАВНОВЕСИЯХ И ФАЗОВЫЕ
ДИАГРАММЫ СОСТОЯНИЯ СИЛИКАТНЫХ СИСТЕМ
Общие

Системой называется выделяемое из окружающей среды материальное тело или совокупность тел, ограниченных реальной физической или воображаемой математической поверхностью, которые могут взаимодействовать между собой или другими телами энергетически или путем обмена веществом.
внешние параметры - температура и давление,
внутренние параметры - концентрация, удельный объем или другие удельные величины
изобарно-изотермический потенциал или энергия Гиббса для закрытых систем является функцией независимых параметров—температуры Т и давления р:
G = H —TS = U — TS + pV, где H —энтальпия; U — внутренняя энергия; S —энтропия.
Фазой называется часть или совокупность гомогенных частей системы, отделенных от других частей системы поверхностью раздела и характеризующихся в отсутствие внешнего поля сил одинаковыми во всех своих точках составом и свойствами.
Слайд 31Простые или сложные вещества, наименьшее число которых необходимо и достаточно для образования
Простые или сложные вещества, наименьшее число которых необходимо и достаточно для образования

Число независимых компонентов К системы определяется по формуле K=K0- n ,где К0 — общее число соединений, существующих в системе; п — число независимых уравнений, с помощью которых можно связать концентрации веществ, составляющих фазы системы ПРИМЕР: MgO, SiO2, MgO·SiO2 и 2MgO·SiO2. В этой системе возможны две независимые реакции: MgO + SiO2↔:MgO·SiO2 и 2MgO + SiO2 ↔ 2 MgO·SiO2
Для данной системы Ко = 4, n=2 и число независимых компонентов К =4—2 = 2, т. е. система двухкомпонентная. В рассматриваемой системе возможна еще одна реакция: MgO·SiO2 +MgO ↔ 2 MgO·SiO2, но она зависима от С(MgO·SiO2)
Равновесным называется такое состояние системы, которое характеризуется при постоянных внешних условиях неизменностью во времени термодинамических параметров и отсутствием в системе потоков вещества и теплоты. Оно обладает минимальной энергией Гиббса G. Для равновесных систем dG = 0 и d2G>0. Признаком равновесного состояния является неизменность в системе с течением времени числа и природы существующих фаз.
Термодинамическими степенями свободы (f) называются независимые параметры системы находящейся в равновесии, изменение которых в определенных пределах не вызывает нарушения фазового равновесия, т. е. не приводит к изменению природы и числа существующих фаз.
Слайд 32ПРАВИЛО ФАЗ ГИББСА f=K+m–P , т. е.
число степеней свободы (f) равновесной
ПРАВИЛО ФАЗ ГИББСА f=K+m–P , т. е.
число степеней свободы (f) равновесной
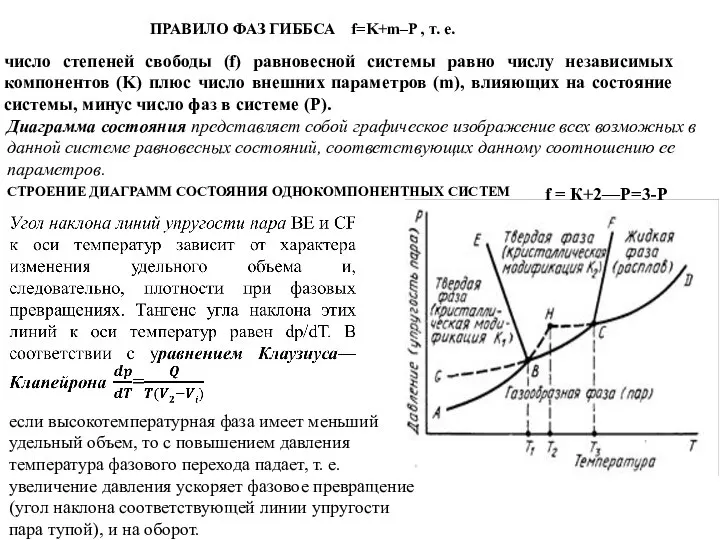
Диаграмма состояния представляет собой графическое изображение всех возможных в данной системе равновесных состояний, соответствующих данному соотношению ее параметров.
СТРОЕНИЕ ДИАГРАММ СОСТОЯНИЯ ОДНОКОМПОНЕНТНЫХ СИСТЕМ
f = К+2—Р=3-P
если высокотемпературная фаза имеет меньший удельный объем, то с повышением давления температура фазового перехода падает, т. е. увеличение давления ускоряет фазовое превращение (угол наклона соответствующей линии упругости пара тупой), и на оборот.
Слайд 33СИСТЕМА SiO2
характерные для системы SiO2 отклонения:
1. фазовые превращения между главными модификациями происходят
СИСТЕМА SiO2
характерные для системы SiO2 отклонения:
1. фазовые превращения между главными модификациями происходят
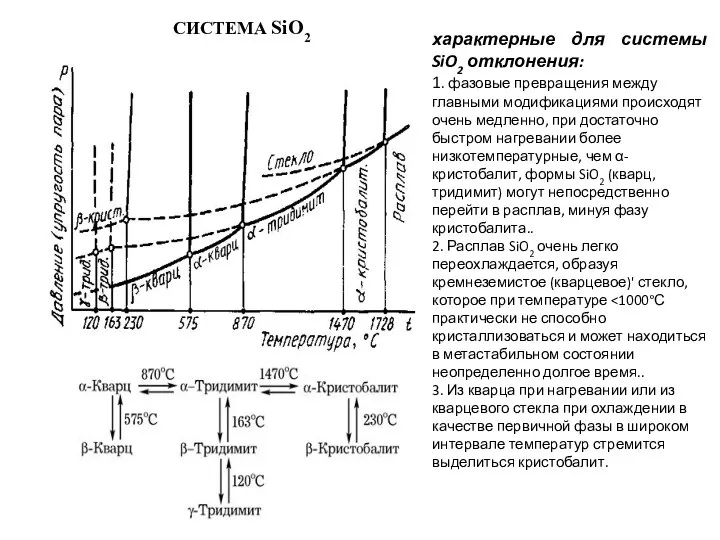
2. Расплав SiO2 очень легко переохлаждается, образуя кремнеземистое (кварцевое)' стекло, которое при температуре <1000°С практически не способно кристаллизоваться и может находиться в метастабильном состоянии неопределенно долгое время..
3. Из кварца при нагревании или из кварцевого стекла при охлаждении в качестве первичной фазы в широком интервале температур стремится выделиться кристобалит.
Слайд 34СИСТЕМА А12O3
разновидности глинозема, например δ-, η-, θ-, χ-, ρ Al2O3, были обнаружены
СИСТЕМА А12O3
разновидности глинозема, например δ-, η-, θ-, χ-, ρ Al2O3, были обнаружены

α- Al2O3, встречающийся в природе в виде минерала корунда
γ- Al2O3 -технический глинозем
Система Al2O3 имеет существенное значение для технологии высокоогнеупорных, абразивных, химически стойких и других керамических материалов. В виде монокристаллов корунд находит применение в квантовых оптических генераторах, парамагнитных усилителях, квантовых счетчиках для регистрации инфракрасного излучения и т. д.
Слайд 35СИСТЕМА MgO
Оксид магния MgO — единственное кислородное соединение магния. Это соединение не
СИСТЕМА MgO
Оксид магния MgO — единственное кислородное соединение магния. Это соединение не

MgO является искусственным материалом, получаемым химической и термической обработкой природных соединений магния — магнезита MgCO3, доломита MgCO3·CaCO3, брусита Mg(OH)2, сжиганием металлического магния в кислороде, а также из морской воды. Свойства образующегося при этом продукта сильно зависят от вида сырьевого материала, способа получения и температуры термической обработки.
Слабообожженный MgO (каустический магнезит), возникающий в результате обжига при температурах менее 1000°С, обладает повышенной склонностью к гидратации и используется как вяжущее вещество. Обжиг при высокой температуре порядка 1700... 1750°С и выше приводит к спеканию MgO, сопровождаемому обычно процессом рекристаллизации, т. е. ростом зерен. Такой спеченный MgO представляет собой уже керамический материал.
Спеченный MgO как керамический материал обладает достаточно
хорошей прочностью, высокими огнеупорностью и щелочестойкостью.
Слайд 36ДВУХКОМПОНЕНТНЫЕ ДИАГРАММЫ СОСТОЯНИЯ
правило фаз Гиббса f=K+1—Р=2+1-P=3-P
Координатные оси. Двухкомпонентные диаграммы состояния строятся в
ДВУХКОМПОНЕНТНЫЕ ДИАГРАММЫ СОСТОЯНИЯ
правило фаз Гиббса f=K+1—Р=2+1-P=3-P
Координатные оси. Двухкомпонентные диаграммы состояния строятся в

Вертикали составов. Вертикалью состава называется перпендикуляр, опущенный из любой точки диаграммы на ось концентраций или восстановленный к ней из какой либо точки этой оси (например, вертикали ab, d—А2В2, а1b1 ). Всем точкам этого перпендикуляра соответствует один и тот же состав с одинаковым содержанием компонентов. Изотермами на двухкомпонентных диаграммах состояния являются прямые, проведенные параллельно оси концентраций..
Под условным термином «путь кристаллизации» понимается описываемая на диаграмме последовательность фазовых изменений и изменений составов жидкой и твердой фаз при охлаждении расплава данного состава; под «путем плавления» — та же последовательность, но для твердой смеси, подвергающейся нагреванию вплоть до ее полного расплавления. Следует отметить, что для одного и того же состава графически путь кристаллизации и путь плавления идентичны, но противоположны по направлению и последовательности фазовых превращений.
Слайд 37Диаграмма состояния двухкомпонентной системы с эвтектикой без химических соединений и твердых растворов
Кривые
Диаграмма состояния двухкомпонентной системы с эвтектикой без химических соединений и твердых растворов
Кривые
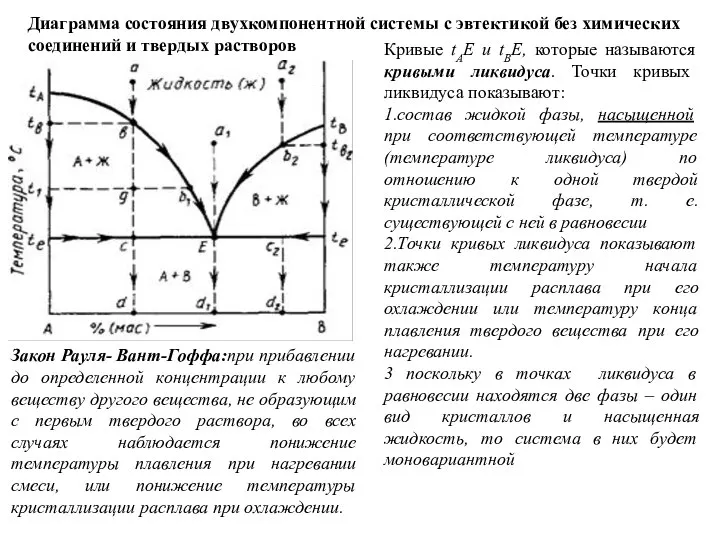
1.состав жидкой фазы, насыщенной при соответствующей температуре (температуре ликвидуса) по отношению к одной твердой кристаллической фазе, т. е. существующей с ней в равновесии
2.Точки кривых ликвидуса показывают также температуру начала кристаллизации расплава при его охлаждении или температуру конца плавления твердого вещества при его нагревании.
3 поскольку в точках ликвидуса в равновесии находятся две фазы – один вид кристаллов и насыщенная жидкость, то система в них будет моновариантной
Закон Рауля- Вант-Гоффа:при прибавлении до определенной концентрации к любому веществу другого вещества, не образующим с первым твердого раствора, во всех случаях наблюдается понижение температуры плавления при нагревании смеси, или понижение температуры кристаллизации расплава при охлаждении.
Слайд 38Ветви кривых ликвидуса пересекаются в точках, называемых точками эвтектики, а составы, соответствующие
Ветви кривых ликвидуса пересекаются в точках, называемых точками эвтектики, а составы, соответствующие

В точках эвтектики в равновесии находятся три фазы: одна жидкая и две твердые А и В, поэтому в соответствии с правилом фаз точки эвтектики выражают инвариантное состояние системы (f=K +1—Р=2 +1—3=0). Это означает, что система из характеризуемой точкой эвтектики состояния не может перейти в другое состояние (т. е. не может изменить свои параметры — температуру и концентрацию), пока не исчезнет хотя бы одна фаза.
Следует отметить, что в точках эвтектики происходит только физический процесс кристаллизации (при охлаждении) или плавления (при нагревании) и кристаллизация в этой точке всегда заканчивается (т. е. жидкая фаза исчезает).
Любая смесь кристаллов А и В начинает плавится при эвтектической температуре, а заканчивает плавление при своей индивидуальной, которая определяется конкретным составом смеси.
Эвтектика
Слайд 39ПРАВИЛО РЫЧАГА И ЕГО ПРИМЕНЕНИЕ ДЛЯ КОЛИЧЕСТВЕННЫХ РАСЧЕТОВ В МНОГОКОМПОНЕНТНЫХ СИСТЕМАХ
ФОРМУЛИРОВКА
ПРАВИЛО РЫЧАГА И ЕГО ПРИМЕНЕНИЕ ДЛЯ КОЛИЧЕСТВЕННЫХ РАСЧЕТОВ В МНОГОКОМПОНЕНТНЫХ СИСТЕМАХ
ФОРМУЛИРОВКА
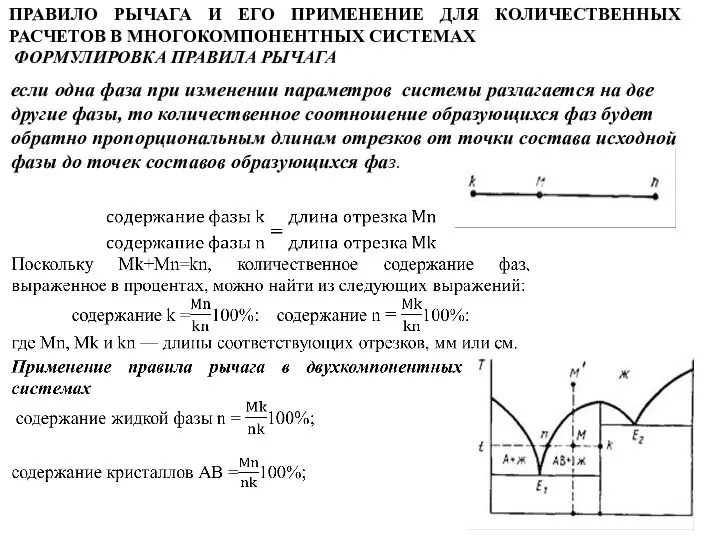
если одна фаза при изменении параметров системы разлагается на две
другие фазы, то количественное соотношение образующихся фаз будет
обратно пропорциональным длинам отрезков от точки состава исходной
фазы до точек составов образующихся фаз.
Слайд 40Диаграмма состояния двухкомпонентной системы с химическим соединением, плавящимся без разложения (конгруэнтно)
Для определения
Диаграмма состояния двухкомпонентной системы с химическим соединением, плавящимся без разложения (конгруэнтно)
Для определения

Признаком конгруентного плавления на диаграмме является тот факт, что вертикаль состава (АВ—tAB) соединения АВ доходит до кривой ликвидуса, которая в точке их пересечения имеет максимум (точка tAB). Точка температурного максимума на кривой ликвидуса называется дистектикой
Слайд 41Диаграмма состояния двухкомпонентной системы с химическим соединением, плавящимся с разложения (инконгруэнтно)
Признаком инконгруентно
Диаграмма состояния двухкомпонентной системы с химическим соединением, плавящимся с разложения (инконгруэнтно)
Признаком инконгруентно
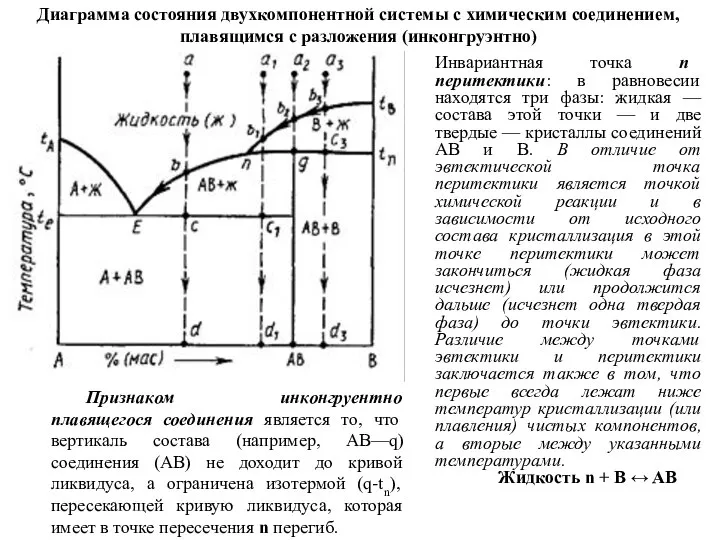
Инвариантная точка п перитектики: в равновесии находятся три фазы: жидкая — состава этой точки — и две твердые — кристаллы соединений АВ и В. В отличие от эвтектической точка перитектики является точкой химической реакции и в зависимости от исходного состава кристаллизация в этой точке перитектики может закончиться (жидкая фаза исчезнет) или продолжится дальше (исчезнет одна твердая фаза) до точки эвтектики. Различие между точками эвтектики и перитектики заключается также в том, что первые всегда лежат ниже температур кристаллизации (или плавления) чистых компонентов, а вторые между указанными температурами.
Жидкость n + B ↔ AВ
Слайд 42Диаграмма состояния двухкомпонентной системы с ликвацией, полиморфными превращениями и химическими соединениями, разлагающимися
Диаграмма состояния двухкомпонентной системы с ликвацией, полиморфными превращениями и химическими соединениями, разлагающимися
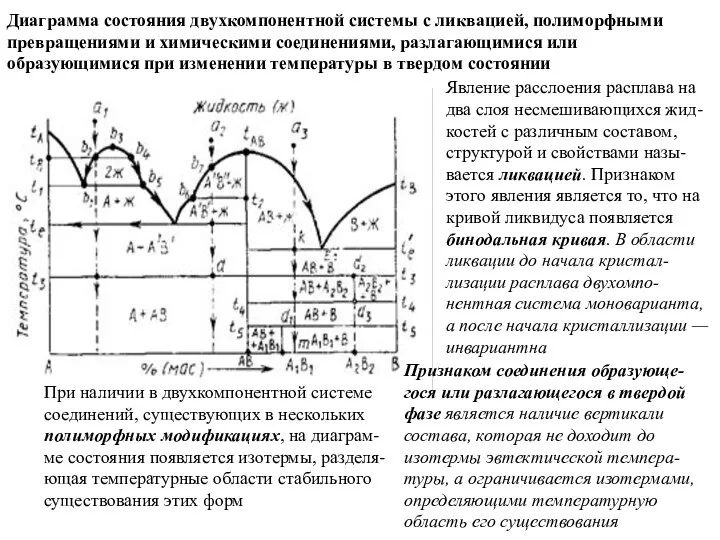
Явление расслоения расплава на два слоя несмешивающихся жид-костей с различным составом, структурой и свойствами назы-вается ликвацией. Признаком этого явления является то, что на кривой ликвидуса появляется бинодальная кривая. В области ликвации до начала кристал-лизации расплава двухомпо-нентная система моноварианта, а после начала кристаллизации — инвариантна
При наличии в двухкомпонентной системе соединений, существующих в нескольких полиморфных модификациях, на диаграм-ме состояния появляется изотермы, разделя-ющая температурные области стабильного существования этих форм
Признаком соединения образующе-гося или разлагающегося в твердой фазе является наличие вертикали состава, которая не доходит до изотермы эвтектической темпера-туры, а ограничивается изотермами, определяющими температурную область его существования
Слайд 43Диаграмма состояния двухкомпонентной системы с непрерывным рядом твердых растворов
Точки на кривой солидуса
Диаграмма состояния двухкомпонентной системы с непрерывным рядом твердых растворов
Точки на кривой солидуса
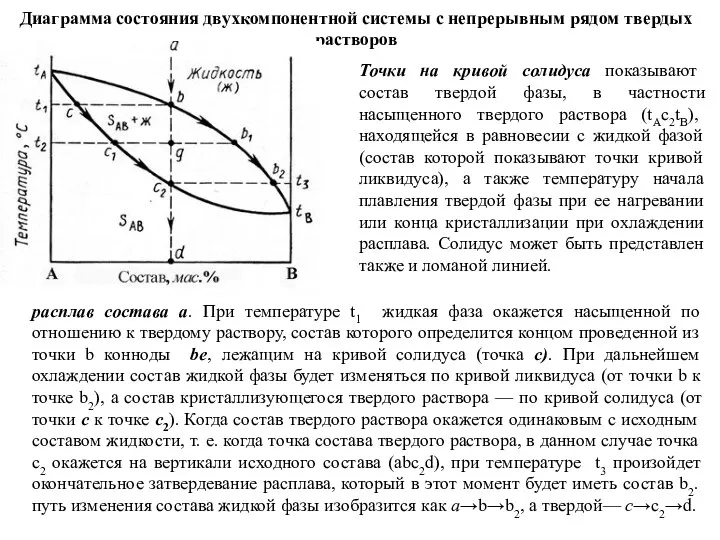
расплав состава а. При температуре t1 жидкая фаза окажется насыщенной по отношению к твердому раствору, состав которого определится концом проведенной из точки b конноды be, лежащим на кривой солидуса (точка с). При дальнейшем охлаждении состав жидкой фазы будет изменяться по кривой ликвидуса (от точки b к точке b2), а состав кристаллизующегося твердого раствора — по кривой солидуса (от точки с к точке с2). Когда состав твердого раствора окажется одинаковым с исходным составом жидкости, т. е. когда точка состава твердого раствора, в данном случае точка с2 окажется на вертикали исходного состава (abc2d), при температуре t3 произойдет окончательное затвердевание расплава, который в этот момент будет иметь состав b2. путь изменения состава жидкой фазы изобразится как а→b→b2, а твердой— c→c2→d.
Слайд 44Диаграмма состояния двухкомпонентной системы с ограниченным рядом твердых растворов
точка E в системах
Диаграмма состояния двухкомпонентной системы с ограниченным рядом твердых растворов
точка E в системах
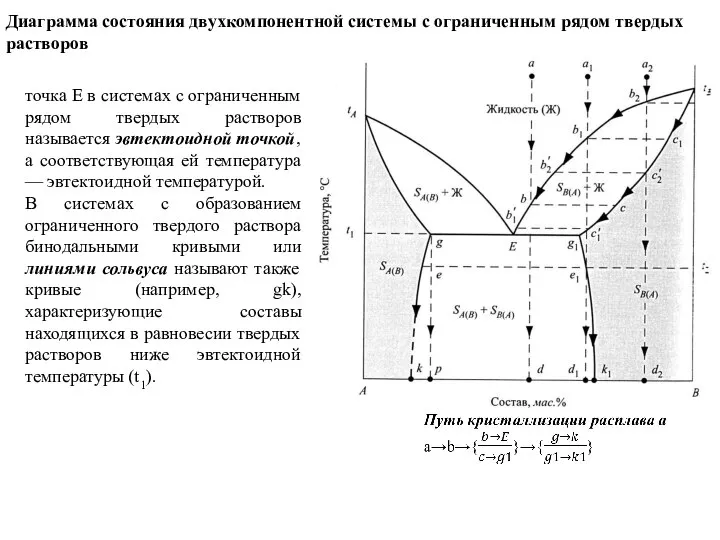
В системах с образованием ограниченного твердого раствора бинодальными кривыми или линиями сольвуса называют также кривые (например, gk), характеризующие составы находящихся в равновесии твердых растворов ниже эвтектоидной температуры (t1).
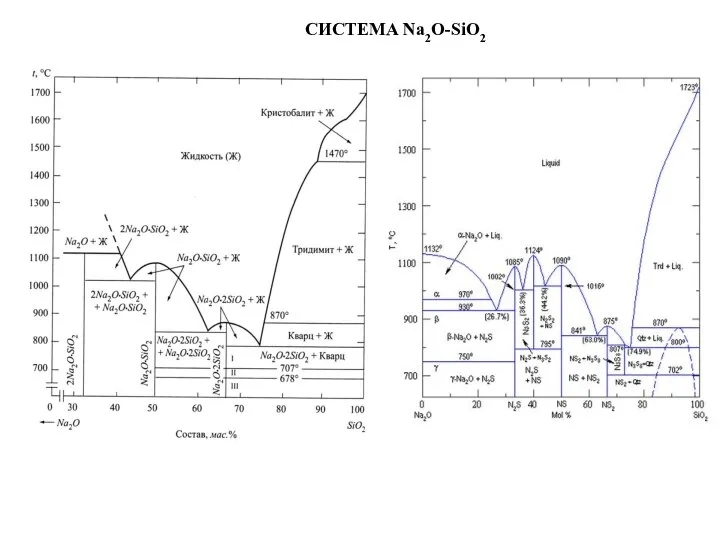
Слайд 45СИСТЕМА Na2O-SiO2
СИСТЕМА Na2O-SiO2
Слайд 46СИСТЕМА CaO- SiO2
Метасиликат кальция CaO·SiO2 имеет две полиморфные модификации: низкотемпературную форму β-
СИСТЕМА CaO- SiO2
Метасиликат кальция CaO·SiO2 имеет две полиморфные модификации: низкотемпературную форму β-
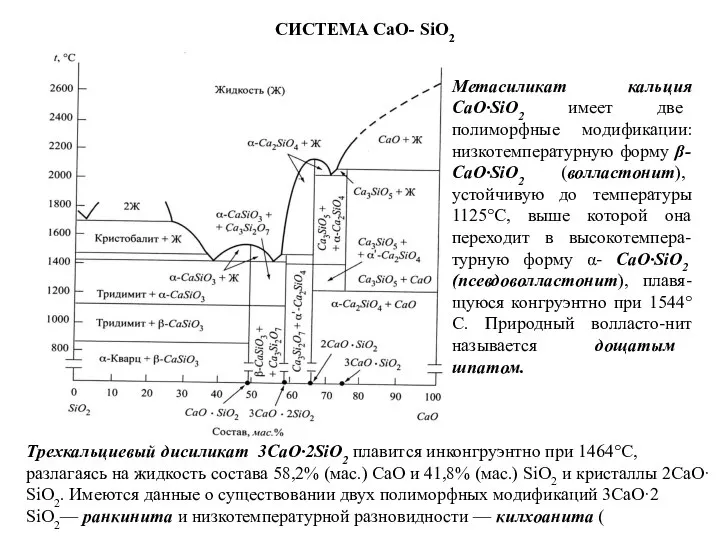
Трехкальциевый дисиликат 3CaO·2SiO2 плавится инконгруэнтно при 1464°С, разлагаясь на жидкость состава 58,2% (мас.) СаО и 41,8% (мас.) SiO2 и кристаллы 2CaO· SiO2. Имеются данные о существовании двух полиморфных модификаций 3CaO·2 SiO2— ранкинита и низкотемпературной разновидности — килхоанита (
Слайд 47Двухкальциевый силикат 2CaO·SiO2 — конгруэнтно плавящееся при 2130°С соединение, обладающее сложным и
Двухкальциевый силикат 2CaO·SiO2 — конгруэнтно плавящееся при 2130°С соединение, обладающее сложным и
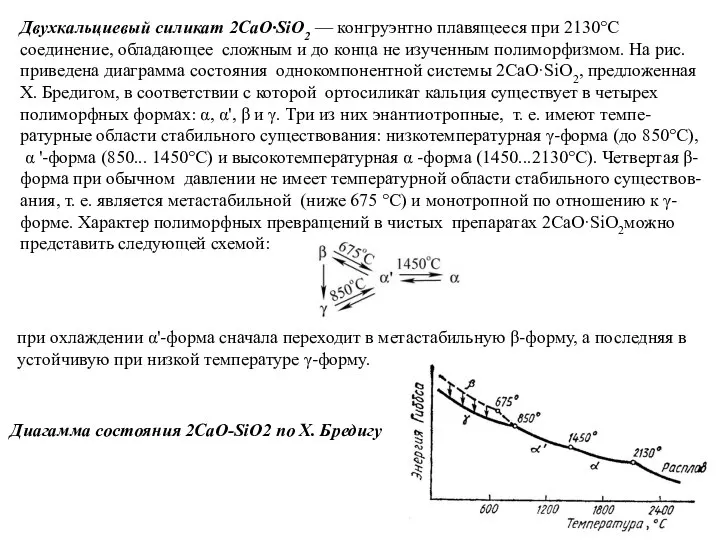
α '-форма (850... 1450°С) и высокотемпературная α -форма (1450...2130°С). Четвертая β-форма при обычном давлении не имеет температурной области стабильного существов-ания, т. е. является метастабильной (ниже 675 °С) и монотропной по отношению к γ-форме. Характер полиморфных превращений в чистых препаратах 2CaO·SiO2можно представить следующей схемой:
при охлаждении α'-форма сначала переходит в метастабильную β-форму, а последняя в
устойчивую при низкой температуре γ-форму.
Диагамма состояния 2CaO-SiO2 по X. Бредигу
Слайд 48Трехкальциевый силикат 3CaO·SiO2. Это соединение имеет область стабильного существования от 1250 до
Трехкальциевый силикат 3CaO·SiO2. Это соединение имеет область стабильного существования от 1250 до

600.-.620°С 920-925°С 970-980°С 990-1000°С 1050°С
ТI ↔ ТII ↔ ТIII ↔ МI ↔ МII ↔ Тр
Слайд 49СИСТЕМА А12O3— SiO2
по Н. Боуэну и Дж. Грейгу
по Н.А. Торопову и Ф.Я.
СИСТЕМА А12O3— SiO2
по Н. Боуэну и Дж. Грейгу
по Н.А. Торопову и Ф.Я.
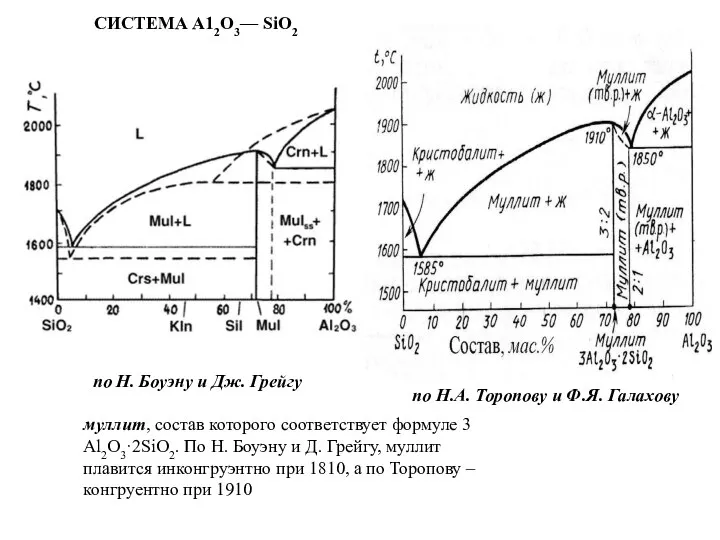
муллит, состав которого соответствует формуле 3 Al2O3·2SiO2. По Н. Боуэну и Д. Грейгу, муллит плавится инконгруэнтно при 1810, а по Торопову – конгруентно при 1910
Слайд 50СИСТЕМА MgO—SiO2
Ортосиликат магния 2MgO·SiO2 (форстерит) — соединение, не имеющее полиморфных разновид-ностей, плавится
СИСТЕМА MgO—SiO2
Ортосиликат магния 2MgO·SiO2 (форстерит) — соединение, не имеющее полиморфных разновид-ностей, плавится
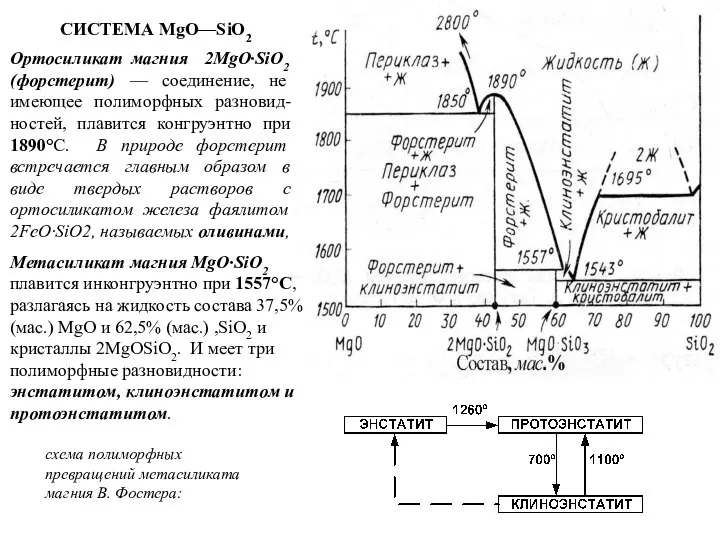
Метасиликат магния MgO·SiO2 плавится инконгруэнтно при 1557°С, разлагаясь на жидкость состава 37,5% (мас.) MgO и 62,5% (мас.) ,SiO2 и кристаллы 2MgOSiO2. И меет три полиморфные разновидности: энстатитом, клиноэнстатитом и протоэнстатитом.
схема полиморфных превращений метасиликата магния В. Фостера:
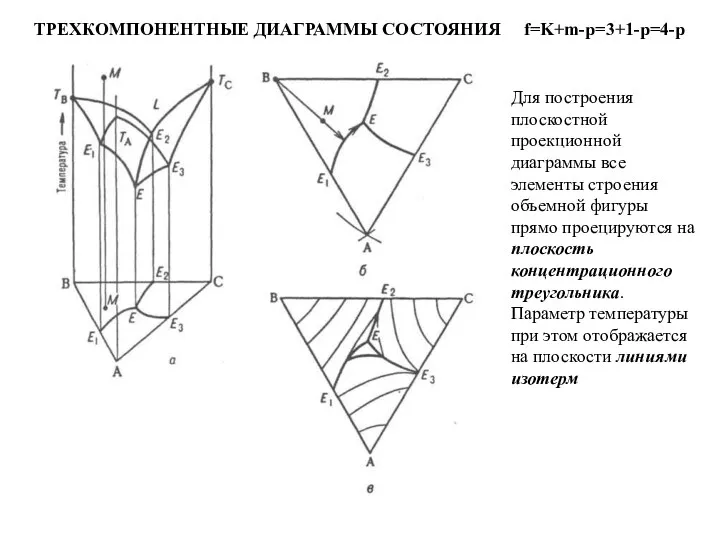
Слайд 51ТРЕХКОМПОНЕНТНЫЕ ДИАГРАММЫ СОСТОЯНИЯ f=K+m-p=3+1-p=4-p
Для построения плоскостной проекционной диаграммы все элементы строения
ТРЕХКОМПОНЕНТНЫЕ ДИАГРАММЫ СОСТОЯНИЯ f=K+m-p=3+1-p=4-p
Для построения плоскостной проекционной диаграммы все элементы строения
Слайд 52ЭЛЕМЕНТЫ СТРОЕНИЯ ТРЕХКОМПОНЕНТНЫХ ДИАГРАММ
1. Все поле треугольника концентраций разделяется пограничными кривыми на
ЭЛЕМЕНТЫ СТРОЕНИЯ ТРЕХКОМПОНЕНТНЫХ ДИАГРАММ
1. Все поле треугольника концентраций разделяется пограничными кривыми на

2. Вдоль пограничных линий в равновесии находятся три фазы – расплав состава точки, лежащей на ней и два ви кристаллов, поля которых разделяет эта линия. Система на пограничных линиях моновариантна
3.Точки составов соединений, являющихся компонентами, образующими данную систе-му, находятся в углах треугольника концентраций, точки составов двойных соедине-ний,располагаются на сторонах треугольника концентраций и точки составов тройных соединений, образуемых тремя компонентами системы, находятся внутри треугольника концентраций
3.Прямые линии, соединяющие точки составов индивидуальных химических соедине-ний, имеющих смежные поля первичной кристаллизации, называются соединитель-ными прямыми. Соединительные прямые можно проводить только между точками составов соединений со смежными полями первичной кристаллизации, т. е. поля крис-таллизации которых, соприкасаются по какой-либо пограничной кривой. Необходимо также иметь в виду, что каждой пограничной кривой на диаграмме состояния соответ-ствует своя соединительная прямая, соединяющая составы кристаллических фаз , ко-торые находятся в равновесии вдоль этой пограничной кривой,. Каждой соединитель-ной прямой соответствует своя пограничная кривая.
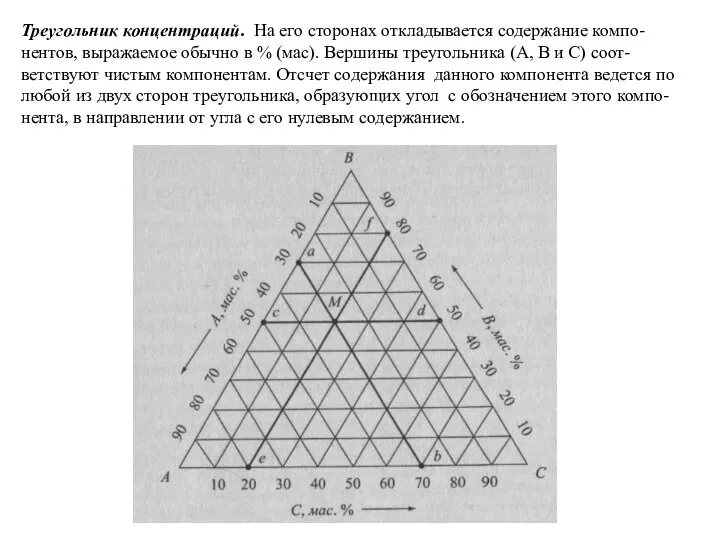
Слайд 53Треугольник концентраций. На его сторонах откладывается содержание компо-нентов, выражаемое обычно в %
Треугольник концентраций. На его сторонах откладывается содержание компо-нентов, выражаемое обычно в %
Слайд 54Трехкомпонентная диаграмма состояния системы с эвтектикой без химических соединений и твердых растворов
Признаком
Трехкомпонентная диаграмма состояния системы с эвтектикой без химических соединений и твердых растворов
Признаком
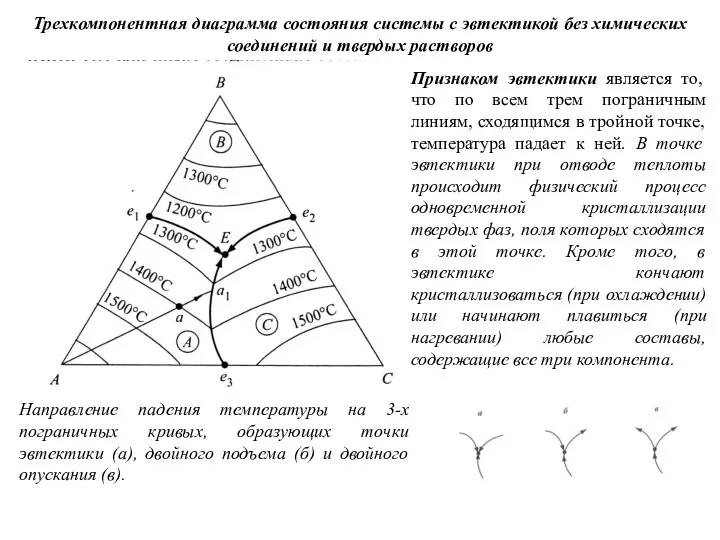
Направление падения температуры на 3-х пограничных кривых, образующих точки эвтектики (а), двойного подъема (б) и двойного опускания (в).
Слайд 55Правило №1 Определение направления падения температуры на пограничных кривых (правило температурного максимума):
Правило №1 Определение направления падения температуры на пограничных кривых (правило температурного максимума):

Правило №2 Определение температуры начала кристаллизации расплава: Температурой начала кристаллизации расплава (или конца плавления твердой смеси) будет температура, соответствующая той изотерме, на которую попадает точка состава этого расплава.
Правило №3 Определение состава первично кристаллизующейся из расплава твердой фазы Первично выпадающей при кристаллизации фазой будут кристаллы того соединения, в поле первичной кристаллизации которого лежит точка состава исходного расплава
Правило №4 Определение первичного пути изменения состава жидкой фазы после начала кристаллизации. При кристаллизации из расплава одной твердой фазы состав жидкой фазы (расплава) изменяется (т. е. путь кристаллизации проходит) от точки состава исходного расплава по продолжению прямой, проведенной через точку состава кристаллизующегося соединения и точку состава исходного расплава, в сторону понижения температуры
Слайд 56Диаграмма состояния трех компонентной системы с двойным (бинарным) химическим соединением АС, плавящимся
Диаграмма состояния трех компонентной системы с двойным (бинарным) химическим соединением АС, плавящимся
Правило №5 Химическое соединение плавится без разложения (конгруентно), ) если точка состава двойного или тройного соединения лежит в собственном поле первичной кристаллизации. Если точка состава соединения лежит вне поля его первичной кристаллизации, то это соединение плавится с разложением, т. е. инконгруэнтно
Слайд 57Правило №6 Определение состава конечных кристаллических фаз после завершения кристаллизации трехкомпонентного расплава
Правило №6 Определение состава конечных кристаллических фаз после завершения кристаллизации трехкомпонентного расплава

Конечными продуктами кристаллизации являются те три соединения, точки составов которых лежат в вершинах элементарного треугольника, внутри которого находится точка состава исходного расплава.
Правило №7 Расположение тройной эвтектики
Тройная эвтектика всегда располагается внутри того элементарного треугольника, в вершинах которого находятся фазы. Кристаллизующиеся в этой эвтектике, т.е. точка эвтектики всегда лежит в собственном элементарном треугольнике.
Правило №7 определение конечной точки кристаллизации
Конечной точкой кристаллизации трехкомпонентного расплава является та тройная точка, в которой сходятся поля первичной кристаллизации конечных фаз кристаллизации
Слайд 58ПРИМЕНЕНИЕ ПРАВИЛА РЫЧАГА В ТРЕХКОМПОНЕНТНЫХ СИСТЕМАХ
1.Определение количественного содержания фаз образовавшихся за
ПРИМЕНЕНИЕ ПРАВИЛА РЫЧАГА В ТРЕХКОМПОНЕНТНЫХ СИСТЕМАХ
1.Определение количественного содержания фаз образовавшихся за

2. Определение количественного содержания фаз, образовавшихся за весь путь кристаллизации при наличии в системе жидкой и двух твердых фаз
2.1.содержание жидкой и всей твердой фазы (суммарное содержание кристаллов В + АC)
2.2. содержание кристаллов В и АC в отдельности в общей массе твердой фазы
3. Определение количественного соотношения твердых фаз, выделяющихся из расплава в данный момент кристаллизации АC:В= k'-В: k'-АC
Слайд 59Диаграмма состояния трехкомпонентной системы с двойным химическим соединением (AC ), плавящимся инконгруэнтно
Правило
Диаграмма состояния трехкомпонентной системы с двойным химическим соединением (AC ), плавящимся инконгруэнтно
Правило
Для определения состава фаз, на которые разлагается при плавлении соединение АС, рекомендуется определить конечную точку кристаллизации этого вещества. АС будет при плавлении разлагаться на расплав, состава этой точки и кристаллы, находящиеся в равновесии с этим расплавом. Изотерма, на которой лежит эта конечная точка, определит температуру плавления АС.
Слайд 60конгруэнтные и инконгруэнтные пограничные линии: На конгруэнтных пограничных кривых происходит физический процесс
конгруэнтные и инконгруэнтные пограничные линии: На конгруэнтных пограничных кривых происходит физический процесс

Правило №10. Определение характера пограничной линии.
Для определения характера пограничной линии необходимо в точках, ограничивающих этот участок, провести касательные в этой кривой. Если эти касательные пересекают соответствующую соединительную прямую, соединяющую точки состава твердых фаз, находящихся в равновесии вдоль этой пограничной кривой, то она будет на данном участке конгруэнтной, а если не пересекает — инконгруэнтной.
Следует отметить, что одна и та же пограничная кривая на разных участках может иметь разный характер, то есть линия может менять свой характер, а значит и менять суть процессов, которые на ней происходят.
Слайд 61Правило №11. Определение характера процесса вдоль инконгруентной пограничной линии.
На инконгруэнтных пограничных кривых
Правило №11. Определение характера процесса вдоль инконгруентной пограничной линии.
На инконгруэнтных пограничных кривых

На данной диаграмме линия e3G носит инконгруентны характер и вдоль нее происходит реакция А+ жидкость↔АС, причем при охлаждении реакция идет слева направо, а при нагревании – в обратном направлении
Правило №12 Чтобы определить, сойдет ли путь кристаллизации с инконгруэнтной пограничной кривой, а если сойдет, то в какой ее точке, необходимо соединить прямой линией точку состава исходного расплава с точкой состава того соединения, которое выделяется в результате реакции при охлаждении, и продолжить эту прямую в направлении указанной пограничной прямой. Если эта прямая не пересекает пограничную кривую, путь кристаллизации с нее не сойдет и будет продолжаться до ближайшей тройной точки. Если же эта прямая пересекает пограничную кривую, то в точке пересечения путь кристаллизации покинет пограничную кривую и пойдет по продолжению указанной прямой, пересекая поле первичной кристаллизации соединения, выделяющегося в результате реакции на этой пограничной кривой.
Слайд 62ТОЧКА ДВОЙНОГО ПОДЪЕМА
Тройная инвариантная точка G отличается от тройной эвтектики Е,
ТОЧКА ДВОЙНОГО ПОДЪЕМА
Тройная инвариантная точка G отличается от тройной эвтектики Е,

Правило №13 . Определение характера процесса, происходящего в точке двойного подъема
В точке двойного подъема при отнятии теплоты при постоянной температуре (система инвариантна), отвечающей этой точке, происходит химическая реакция взаимодействия жидкой фазы состава этой точки с одним из трех находящихся в равновесии с расплавом в этой точке кристаллических соединений. В результате этой реакции реагирующее соединение полностью или частично исчезает, а два других соединения кристаллизуются из расплава. С жидкостью взаимодействует то соединение, от поля первичной кристаллизации которого отходит единственная пограничная кривая с падающей от точки двойного подъема температурой, а два других соединения, находящихся в равновесии с жидкостью вдоль указанной пограничной кривой, кристаллизуются из расплава.
При нагревании процесс идет в обратном направлении.
В данном случае в точке G при охлаждении с расплавом состава этой точки взаимодействуют кристаллы А, а выделяются кристаллы АС и В.
А + ЖG→АС + В
Слайд 63Диаграмма состояния трехкомпонентной системы с двойным химическим соединением (AC), разлагающимся при нагревании
Диаграмма состояния трехкомпонентной системы с двойным химическим соединением (AC), разлагающимся при нагревании
Правило № 14 Признак двойного химического соединения, разлагающегося при нагревании в твердом состоянии
Если точка состава двойного соединения лежит вне поля его первичной кристаллизации, а последнее расположено внутри треугольника концентраций, не примыкая к стороне треугольника, на которой лежит точка состава этого двойного соединения, то оно при нагревании разлагается в твердом состоянии.
Слайд 64инвариантная тройная точка двойного опускания G, для которой по одной пограничной линии
инвариантная тройная точка двойного опускания G, для которой по одной пограничной линии

Правило № 15 Определение характера процесса, протекающего в точке двойного опускания В точке двойного опускания при постоянной температуре, отвечающей этой точке, происходит химическая реакция взаимодействия жидкой фазы состава этой точки с двумя из трех кристаллических соединений, находящихся в равновесии в этой точке, в результате чего эти реагирующие соединения полностью или частично исчезают, а третье соединение кристаллизуется из расплава. С жидкостью взаимодействуют те два соединения, которые находятся в равновесии с жидкостью вдоль единственной пограничной кривой с падающей к точке двойного опускания температурой, а выделяется из расплава то соединение, поле первичной кристаллизации которого граничит с двумя пограничными кривыми с падающей от точки двойного опускания температурой. При нагревании процесс идет в обратном направлении. В данном случае: ЖидкостьG + А + С↔АС
Правила № 16 Сначала находят две соединительные прямые, соответствующие двум пограничным кривым с падающей от точки двойного опускания температурой. Затем соединяют прямой линией точку двойного опускания и точку состава исходного расплава и определяют, какую из двух указанных соединительных прямых пересекает продолжение этой прямой. Дальнейший путь кристаллизации пойдет по той пограничной кривой, которой соответствует именно эта соединительная прямая, т. е. по той пограничной кривой, вдоль которой в равновесии находятся соединения, точки составов которых соединяет эта прямая.
Слайд 65Диаграмма состояния трехкомпонентной системы с тройным химическим соединением, плавящимся конгруэнтно, полиморфными превращениями
Диаграмма состояния трехкомпонентной системы с тройным химическим соединением, плавящимся конгруэнтно, полиморфными превращениями
В этом случае на диаграмме появляется область расслоения жидкой фазы, ограниченная би-нодальной кривой 1-2-3. Точки ветвей этой кривой (mт1 и nn1) показывают составы двух образующихся при расслоении жидких фаз, находящихся в равновесии. Составы этих фаз определяются экспериментально и точки этих составов соединяются прямыми — кон-нодами (например, тn), концы которых лежат на ветвях бино-дальной кривой. Таким образом, например, жидкая фаза состава т находится в равновесии с другой несмешивающейся с ней жидкой фазой состава n.
Слайд 66Диаграмма состояния трехкомпонентной системы с тройным химическим соединением, плавящимся инконгруэнтно
Признаком тройного соединения,
Диаграмма состояния трехкомпонентной системы с тройным химическим соединением, плавящимся инконгруэнтно
Признаком тройного соединения,
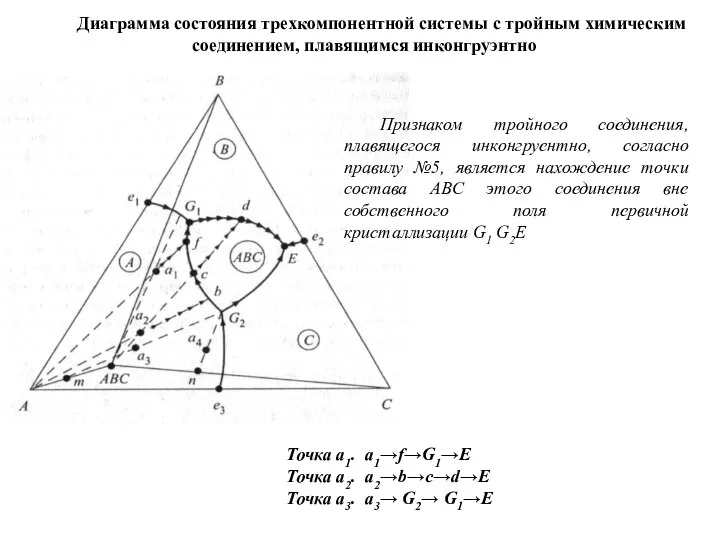
Точка а1. а1→f→G1→E
Точка а2. a2→b→c→d→E
Точка а3. a3→ G2→ G1→E
Слайд 67Последовательность операций для определения пути кристаллизации
Определить химический состав исходного расплава, соответствующей
Последовательность операций для определения пути кристаллизации
Определить химический состав исходного расплава, соответствующей

Определить температуру начала кристаллизации.
Определить состав первично выпадающей фазы.
Определить конечные фазы и конечную точку кристаллизации. (Определять конечную точку кристаллизации рекомендуется сразу для того, чтобы с самого начала ограничить весь путь кристаллизации начальной точкой, которая дана, и конечной точкой, что позволит избежать ошибки при определении пути кристаллизации).
Определить первичный путь изменения состава жидкой фазы. (В поле всегда выделяется один вид кристаллов)
Когда точки состава жидкой фазы дойдут до пограничной кривой, определить ее характер (конгруэнтный или инконгруэнтный).
Определить характер процесса, происходящего на пограничной кривой (кристаллизации 2-х фаз или химическая реакция; в последнем случае определить какая реакция).
При движении точки состава жидкой фазы вдоль пограничной кривой, проверить (или определить, если на ней не нанесены стрелки) направление падения температуры на этой кривой.
В случае, если путь кристаллизации идет по инконгруэнтной кривой, определить сойдет ли с нее путь кристаллизации и, если сойдет, то в какой точке этой кривой и как он пойдет дальше.
При попадании в тройную точку определить ее характер (точка эвтектики, двойного подъема или опускания).
Определить характер процесса, происходящего в тройной точке (совместная кристаллизация 3-х фаз или химическая реакция, в последнем случае определить какая реакция).
В случае, если путь кристаллизации попадает в точку двойного опускания определить дальнейший путь кристаллизации, т.е. по какой из двух пограничных кривых с падающей от точки температурой пойдет путь кристаллизации при дальнейшем понижении температуры.
Слайд 68СИСТЕМА Na2O-CaO-SiO2
Богатое кремнеземом тройное соединение девитрит Na2O·3CaO·6SiO2 плавится инконгруэтно при 1047°С, разлагаясь
СИСТЕМА Na2O-CaO-SiO2
Богатое кремнеземом тройное соединение девитрит Na2O·3CaO·6SiO2 плавится инконгруэтно при 1047°С, разлагаясь
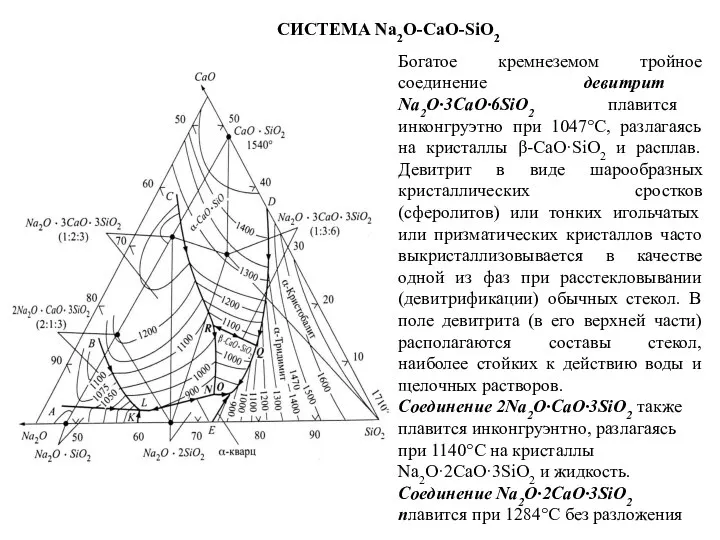
Соединение 2Na2O·CaO·3SiO2 также плавится инконгруэнтно, разлагаясь при 1140°С на кристаллы Na2O·2СаО·3SiO2 и жидкость. Соединение Na2O·2CaO·3SiO2 плавится при 1284°С без разложения
Слайд 69СИСТЕМА CaO-Al2O3-SiO2
Тройные соединения в этой системе представлены анортитом (известковым полевым шпатом) СаО·Al2O3·2
СИСТЕМА CaO-Al2O3-SiO2
Тройные соединения в этой системе представлены анортитом (известковым полевым шпатом) СаО·Al2O3·2

анортит СаО·Al2O3·2 SiO2
Области составов технических продуктов в системе СаО — Al2O3— SiO2: 1 – портландцемент; 2 — основные шлаки; 3 — кислые шлаки; 4 —стекло; 5 — дина-совые огнеупоры; 6 — фарфор; 7 —шамотные огнеупоры; 8 — муллитовые огне-упоры; 9 — корунд; 10 — глиноземистый цемент
3CaO·Al2O3·3 SiO2 (гроссуляр) и пироксен CaO·Al2O3·SiO
Слайд 70СИСТЕМА MgO- Al2O3- SiO2
Кордиерит 2MgO·2Al2O3·5SiO2 плавится инконгруэнтно при 1540°С, разлагаясь на жидкость
СИСТЕМА MgO- Al2O3- SiO2
Кордиерит 2MgO·2Al2O3·5SiO2 плавится инконгруэнтно при 1540°С, разлагаясь на жидкость
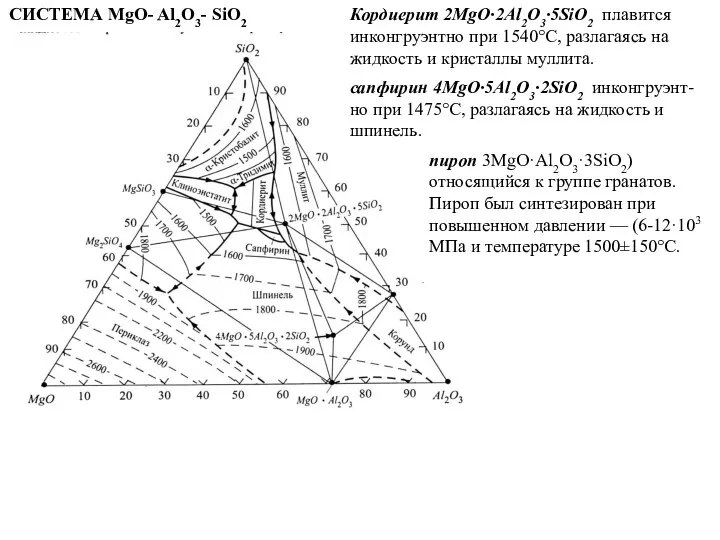
сапфирин 4MgO·5Al2O3·2SiO2 инконгруэнт-но при 1475°С, разлагаясь на жидкость и шпинель.
пироп 3MgO·Al2O3·3SiO2) относящийся к группе гранатов. Пироп был синтезирован при повышенном давлении — (6-12·103 МПа и температуре 1500±150°С.
Слайд 71СИСТЕМА СаО—MgO — SiO2
Монтичеллит CaO·-MgO·SiO2 является соединением, плавящимся инконгруэнтно при 1485°С с
СИСТЕМА СаО—MgO — SiO2
Монтичеллит CaO·-MgO·SiO2 является соединением, плавящимся инконгруэнтно при 1485°С с
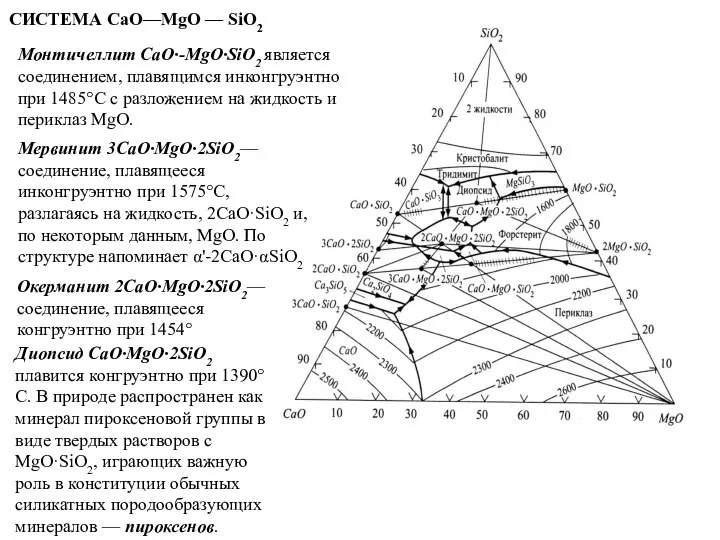
Мервинит 3CaO·MgO·2SiO2— соединение, плавящееся инконгруэнтно при 1575°С, разлагаясь на жидкость, 2CaO·SiO2 и, по некоторым данным, MgO. По структуре напоминает α'-2CaO·αSiO2
Окерманит 2CaO·MgO·2SiO2— соединение, плавящееся конгруэнтно при 1454°
Диопсид CaO·MgO·2SiO2 плавится конгруэнтно при 1390°С. В природе распространен как минерал пироксеновой группы в виде твердых растворов с MgO·SiO2, играющих важную роль в конституции обычных силикатных породообразующих минералов — пироксенов.
Слайд 72МЕТОДЫ ПОСТРОЕНИЯ ДИАГРАММ СОСТОЯНИЯ
ДИНАМИЧЕСКИЙ МЕТОД ПОСТРОЕНИЯ ДИАГРАММ СОСТОЯНИЯ
СТАТИЧЕСКИЙ МЕТОД ПОСТРОЕНИЯ ДИАГРАММ СОСТОЯНИЯ
Принцип
МЕТОДЫ ПОСТРОЕНИЯ ДИАГРАММ СОСТОЯНИЯ
ДИНАМИЧЕСКИЙ МЕТОД ПОСТРОЕНИЯ ДИАГРАММ СОСТОЯНИЯ
СТАТИЧЕСКИЙ МЕТОД ПОСТРОЕНИЯ ДИАГРАММ СОСТОЯНИЯ
Принцип
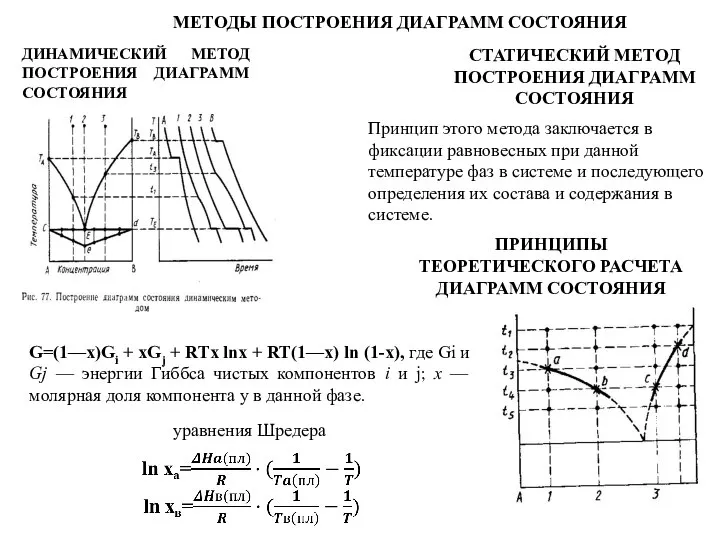
ПРИНЦИПЫ ТЕОРЕТИЧЕСКОГО РАСЧЕТА
ДИАГРАММ СОСТОЯНИЯ
G=(1—x)Gi + xGj + RTx lnx + RT(1—x) ln (1-х), где Gi и Gj — энергии Гиббса чистых компонентов i и j; х — молярная доля компонента у в данной фазе.
уравнения Шредера
Слайд 73ЧАСТЬ 4 ПРОЦЕССЫ ПРИ СИНТЕЗЕ СИЛИКАТНЫХ И ДРУГИХ ТУГОПЛАВКИХ СОЕДИНЕНИЙ
ДИССОЦИАЦИЯ
Диссоциация –химический процесс
ЧАСТЬ 4 ПРОЦЕССЫ ПРИ СИНТЕЗЕ СИЛИКАТНЫХ И ДРУГИХ ТУГОПЛАВКИХ СОЕДИНЕНИЙ
ДИССОЦИАЦИЯ
Диссоциация –химический процесс
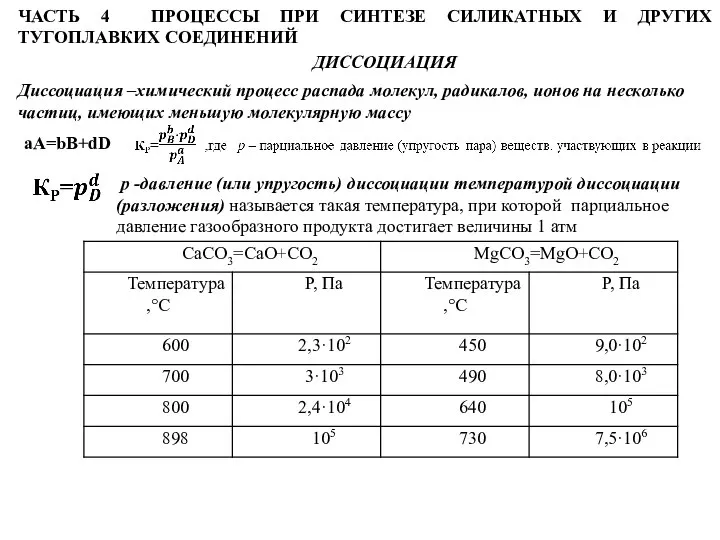
aA=bB+dD
р -давление (или упругость) диссоциации температурой диссоциации
(разложения) называется такая температура, при которой парциальное
давление газообразного продукта достигает величины 1 атм
Слайд 74Температура диссоциации зависит от природы вещества, например для карбонатов щелочноземельных металлов повышается
Температура диссоциации зависит от природы вещества, например для карбонатов щелочноземельных металлов повышается

MgCO3(640°C)˂CaCO3(900°C)˂SrCO3(1100°C)˂BaCO3(1400°C)
Реальная температура разложения зависит от: степени дисперсности вещества, степени дефектности кристаллической решетки вещества и наличия примесей.
Механизм диссоциации рассмотрим на примере разложения кальцита CaCO3.
При подводе к системе тепла процесс начинается с распада в решетке кальцита карбонатного аниона CaCO3→ Cа2++ CO2+ O2-
Ионы O2- диффундируют в решетке кальцита из объема к поверхности зерна очень медленно и в ней они накапливаются. При этом анионы кислорода реагируют с Cа2+ с образованием СаО, но он в этот момент не представляет собой самостоятельной фазы, а образует твердый раствор с CaCO3. По мере развития процесса в этом твердом растворе увеличивается концентрация СаО, и со временем достигается пересыщение раствора, что приводит к массовому образованию и росту зародышей новой фазы СаО.
Как только возникла новая фаза СаО, так и образовалась граница раздела фаз СаО- CaCO3, и это приводит к интенсификации диссоциации, поскольку распад CO32- на границе идет намного легче.
Молекулы СО2 вначале адсорбируются твердой фазой, образуя комплексы СаСО3(тв)·СО2(г)
После достижения предельной концентрации адсорбции происходит обратный процесс десорбции молекул углекислого газа. Эти молекулы диффундируют к поверхности зерен м удаляются в атмосферу
Слайд 75ДЕГИДРАТАЦИЯ
В зависимости от вида и роли воды в структуре ее можно разделить
ДЕГИДРАТАЦИЯ
В зависимости от вида и роли воды в структуре ее можно разделить

Конституционную,
Кристаллизационную,
Адсорбционную.
При этом конституционная и кристаллизационная относится к химически связанной, а адсорбционная – к физически связанной воде.
Конституционная вода входит в структуру соединений в виде аниона ОН- и реже иона гидроксония Н3О+, которые являются элементами строения кристаллической решетки. Соединения, содержащие ОН- называются гидроксидами. Удаление такой воды сопровождается полным разрушением структуры исходного соединения и образованием оксида с совершенно иной структурой.
Кристаллизационная вода входит в состав минералов в виде молекул Н2О, а сами вещества называются гидратами. При этом, гидраты могут иметь в своем составе либо строго постоянное содержание молекул воды (кристаллогидраты), либо ее содержание может варьироваться.
В кристаллогидратах молекулярная вода входит в состав кристаллической решетки, занимая в ней определенные кристаллографические положения. Удаление такой воды, как и в случае гидроксидов, сопровождается полным разрушением структуры исходного соединения с образованием соединения с иной структурой.
Адсорбционная (гигроскопическая) вода содержит физически связанную воду, которая удерживается на поверхности частиц, а также в порах и капиллярах зерен за счет сил межмолекулярного и электростатического взаимодействия
Слайд 76Дегидратация – процесс удаления из минералов связанной воды, который происходит под воздействием
Дегидратация – процесс удаления из минералов связанной воды, который происходит под воздействием

Дегидратацию может инициировать нагревание вещества, понижение влажности окружающей среды, взаимодействие с другим веществом, связывающим воду (осушителем). Термин дегидратация обычно применяется в отношении удаления конституционной и кристаллизационной воды, в отношении удаления адсорбционной воды принят термин обезвоживание, а если речь идет об удалении капельно-жидкой воды, то говорят о сушке.
Потеря конституционной воды является частным случаем реакции диссоциации
Есть такие кристаллогидраты, которые при нагревании сначала плавятся в своей кристаллизационной воде. При этом возможны два случая.
Кристаллогидрат может плавиться без разложения (конгруентно), образуя насыщенный раствор. При нагревании раствор закипает, и его температура повышается до тех пор, пока раствор не станет насыщенным, после чего он кипит при постоянной температуре, пока не образуется безводный продукт. Так ведет себя гипосульфит натрия Na2SO4·10H2O
Кристаллогидрат может плавиться инконгруентно, образуя безводную соль или гидрат с меньшим содержанием воды и насыщенный по отношению к ним раствор, который выкипает при постоянной температуре. Так дегидратируется мирабилит Na2SO4·10 H2O или медный купорос CuSO4·5H2O
Слайд 77РЕАКЦИИ ВЕЩЕСТВ В ТВЕРДОМ СОСТОЯНИИ
(ТВЕРДОФАЗОВЫЕ РЕАКЦИИ)
Под твердофазовьши реакциями понимают реакции, протекающие за
РЕАКЦИИ ВЕЩЕСТВ В ТВЕРДОМ СОСТОЯНИИ
(ТВЕРДОФАЗОВЫЕ РЕАКЦИИ)
Под твердофазовьши реакциями понимают реакции, протекающие за

В реальных условиях твердофазовые реакции обычно протекают в порошкообразных смесях. При этом одно из реагирующих веществ называют покрывающим, а другое — покрываемым компонентом. Покрывающий компонент, как правило, обладает большим коэффициентом диффузии (обычно, но не всегда он имеет более низкую температуру плавления). При реакции частицы покрывающего компонента как бы обволакивают, покрывают зерна покрываемого компонента.
Слайд 78Диффузионные процессы при твердофазовых реакциях
В зависимости от пути перемещения диффундирующих частиц различают
Диффузионные процессы при твердофазовых реакциях
В зависимости от пути перемещения диффундирующих частиц различают

Слайд 79Механизм диффузии в твердых телах
Механизм диффузии катиона в кристаллической решетке (0 —
Механизм диффузии в твердых телах
Механизм диффузии катиона в кристаллической решетке (0 —

1. Перемещение иона из узла решетки (регулярное положение) в междоузлие (иррегулярное положение), а затем вновь в узел за счет выталкивания находящегося там иона
2. Перемещение иона из узла решетки в междоузлие и диффузия по междоузлиям.
3. Перемещение иона из узла или междоузлия в вакантный (незанятый) узел. При этом перемещение иона из узла в вакансию равносильно движению последних в противоположном направлении.
Слайд 80Особенности реакций в твердом состоянии
1. Направление химической реакции в смесях твердых веществ
Особенности реакций в твердом состоянии
1. Направление химической реакции в смесях твердых веществ

2. Процесс взаимодействия твердых компонентов имеет ступенчатый характер.
3. Твердофазовые реакции всегда идут с выделением тепла, т.е. являются экзотермическими.
4. Если при твердофазовом взаимодействии не образуются твердые растворы и не возникает значительных количеств газовой и жидкий фаз, то термодинамическоое равновесие в реакции практически не может быть достигнуто, т.е. реакция идет водном направлении до конца, пока не будет полностью израсходован по крайней мере один из реагирующих компонентов
5. Равновесие может быть достигнуто при малой теплоте реакции и значительной разнице между суммой теплоемкостей исходных веществ и продуктов реакции, но эти условия в реальных силикатных системах, как правило, не выполняются. Следует, однако, подчеркнуть, что степень завершенности реакции определяется не только термодинамическими, но и чисто кинетическими факторами, поэтому практически твердофазовые реакции могут и не доходить до конца.
Слайд 81Кинетика твердофазовых реакций
Видоизмененная формула Яндера для изотермических условий имеет вид:
(3), Где
Кинетика твердофазовых реакций
Видоизмененная формула Яндера для изотермических условий имеет вид:
(3), Где
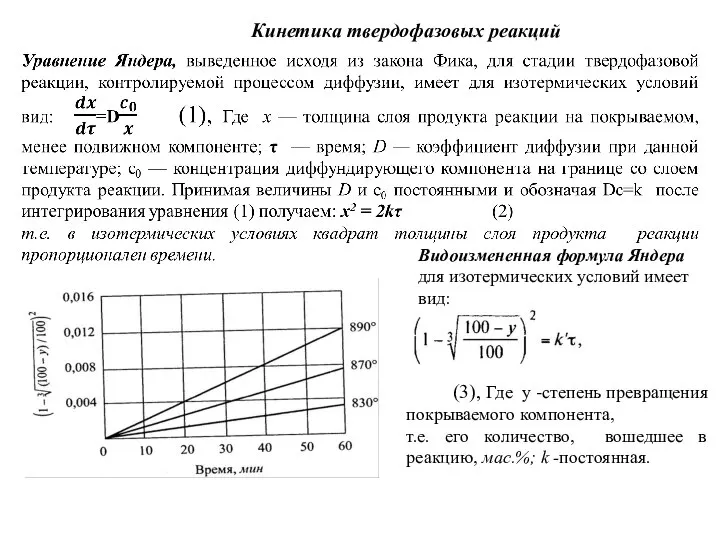
т.е. его количество, вошедшее в реакцию, мас.%; k -постоянная.
Слайд 82A.M. Гинстлинг и Б.И. Броунштейн рассмотрели кинетическую модель процесса твердофазового взаимодействия, учитывающую
A.M. Гинстлинг и Б.И. Броунштейн рассмотрели кинетическую модель процесса твердофазового взаимодействия, учитывающую
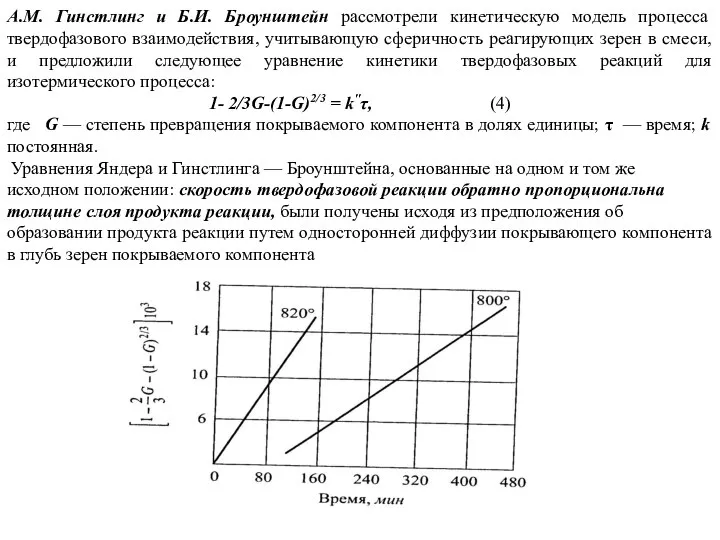
1- 2/3G-(1-G)2/3 = k''τ, (4)
где G — степень превращения покрываемого компонента в долях единицы; τ — время; k постоянная.
Уравнения Яндера и Гинстлинга — Броунштейна, основанные на одном и том же исходном положении: скорость твердофазовой реакции обратно пропорциональна толщине слоя продукта реакции, были получены исходя из предположения об образовании продукта реакции путем односторонней диффузии покрывающего компонента в глубь зерен покрываемого компонента
Слайд 83Факторы, влияющие на скорость твердофазовых реакций
1. Температура.
где А - коэффициент, формально равный
Факторы, влияющие на скорость твердофазовых реакций
1. Температура.
где А - коэффициент, формально равный

температура Таммана которую для силикатов с очень грубым приближением можно принять равной 0,8Тпл, где Тпл — температура плавления вещества
2. Гранулометрический состав порошков
Давление.
4. Присутствие газовой или жидкой фазы
Слайд 84СПЕКАНИЕ
Сущность, движущая сила и виды спекания
В общем случае под спеканием понимается происходящий
СПЕКАНИЕ
Сущность, движущая сила и виды спекания
В общем случае под спеканием понимается происходящий

Степень спекания можно характеризовать относительной плотностью ρотн=ρкаж/Dист
или относительной пористостью Потн=П2/П1,
ρкаж _ кажущаяся плотность (отношение массы тела к его объему, включая объем пор); Dист _ истинная плотность (отношение массы тела к его объему, исключая объем пор); П1 и П2 — общая пористость, соответственно, до и после спекания.
При ρотн = 1 и Потн = 0 достигается абсолютное спекание материала, при котором его общая пористость становится равной нулю.
С термодинамической точки зрения спекание представляет собой нестационарный необратимый процесс перехода системы в более стабильное, устойчивое состояние за счет самопроизвольного уплотнения дисперсного пористого тела. Движущей силой процесса спекания является поверхностная энергия.
Слайд 85Твердофазовое спекание
Величину этого всестороннего давления сжатия (р) можно оценить из соотношения
р =σ/r·П(1-П0),
Твердофазовое спекание
Величину этого всестороннего давления сжатия (р) можно оценить из соотношения
р =σ/r·П(1-П0),

Если r ~ 2•10-6 м, σ ~ 1 Н/м, П0 = 0,5 и П = 0,4, то величина давления окажется равной р ~ 105 Па (~1 атм), т.е. довольно значительной величиной
Слайд 86Механизм твердофазового спекания
По Френкелю, твердофазовое спекание осуществляется за счет диффузионной ползучести твердого
Механизм твердофазового спекания
По Френкелю, твердофазовое спекание осуществляется за счет диффузионной ползучести твердого

Слайд 87Механизм твердофазового спекания
Б.Я. Пинес дал механизму твердофазового спекания атомистическое объяснение, исходя из
Механизм твердофазового спекания
Б.Я. Пинес дал механизму твердофазового спекания атомистическое объяснение, исходя из

Пинес исходил из того, что концентрация вакансий в кристаллическом теле вблизи его поверхности (так же как и давление пара над поверхностью любой конденсированной фазы) зависит от кривизны этой поверхности:
где ξr - концентрация вакансий вблизи искривленной поверхности с радиусом кривизны r, ξ0 - равновесная концентрация вакансий вблизи плоской поверхности в объеме кристалла, не пересекающей поры; σ — поверхностное натяжение; V0 — объем, приходящийся на одну вакансию в кристалле; k — постоянная Больцмана; Т — абсолютная температура.
Слайд 88Кинетика твердофазового спекания
Я.И. Френкель описал кинетику спекания на стадии, характеризующейся исчезновением открытых
Кинетика твердофазового спекания
Я.И. Френкель описал кинетику спекания на стадии, характеризующейся исчезновением открытых

где r — радиус поры; τ — время; σ и η| — соответственно поверх-ностное натяжение и вязкость среды, окружающей пору.
Отсюда время полного зарастания поры
где r0 — начальный радиус поры при τ = 0.
Б.Я. Пинес вывел следующее кинетическое уравнение процесса спекания:
где а — постоянная кристаллической решетки спекающегося материала; D — коэффициент диффузии
продолжительность (τ) полного зарастания поры имеет вид:
Процесс слияния мелких пор в крупные («поедание» мелких пор крупными) называется процессом коалесценции пор («внутренним» спеканием в отличие от «внешнего» спекания, сопровождающегося уменьшением общей пористости)
. Я.Е. Гегузин дает следующее выражение для критериального (граничного) размера пор (гкр), определяющего, какие по размеру поры будут в результате коалесценции зарастать, а какие увеличиваться в размере:
p1 = 2σ/r
Δ=хr—х0— величина пересыщения вакансий вблизи поверхности поры.
Слайд 89Жидкостное спекание
Спекание с участием жидкой фазы (расплава), образующегося в твердом зернистом теле
Жидкостное спекание
Спекание с участием жидкой фазы (расплава), образующегося в твердом зернистом теле
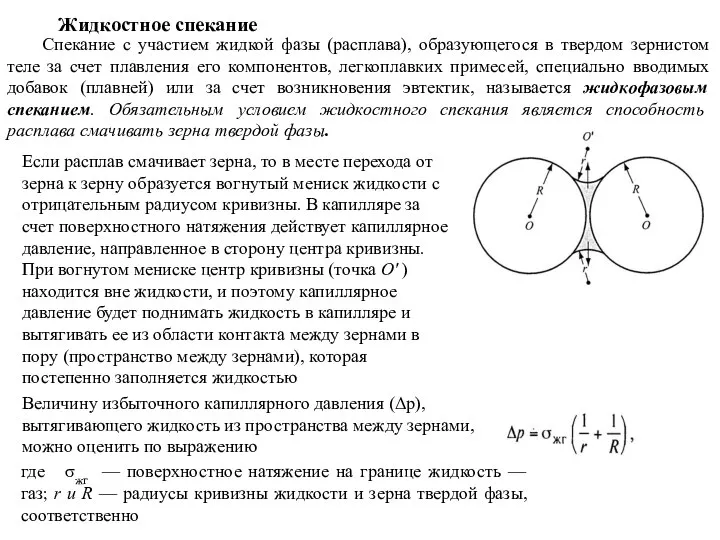
Величину избыточного капиллярного давления (Δр), вытягивающего жидкость из пространства между зернами, можно оценить по выражению
где σжг — поверхностное натяжение на границе жидкость — газ; r и R — радиусы кривизны жидкости и зерна твердой фазы, соответственно
Если расплав смачивает зерна, то в месте перехода от зерна к зерну образуется вогнутый мениск жидкости с отрицательным радиусом кривизны. В капилляре за счет поверхностного натяжения действует капиллярное давление, направленное в сторону центра кривизны. При вогнутом мениске центр кривизны (точка О' ) находится вне жидкости, и поэтому капиллярное давление будет поднимать жидкость в капилляре и вытягивать ее из области контакта между зернами в пору (пространство между зернами), которая постепенно заполняется жидкостью
Слайд 90Спекание за счет процесса “испарние — конденсация”
Механизм подобного переноса вещества с одной
Спекание за счет процесса “испарние — конденсация”
Механизм подобного переноса вещества с одной

Условием развития такого механизма является то,
Чтобы при температуре обжига упругость пара
составляла порядка 1...10 Па
Центры зерен при этом виде спекания практически не сближаются, т.е. ощутимая усадка отсутствует, а общая пористость материала не уменьшается, происходит только перераспределение пор по размерам и изменение их формы, т.е. спекание не сопровождается существенным уплотнением материала, хотя его прочность за счет увеличения контактов между зернами повышается
Спекание за счет пластической деформации под давлением - горячее прессование
Реакционное спекание представляет собой процесс уплотнения и упрочнения материала за счет химической реакции при высокой температуре в зернистом теле между спекаемым материалом и внешним (газовым, паровым или жидким) реагентом.
Слайд 91Факторы, влияющие на процесс спекания
1. Температура и время спекания
2. Гранулометрический состав порошков
Скорость
Факторы, влияющие на процесс спекания
1. Температура и время спекания
2. Гранулометрический состав порошков
Скорость

увеличением начальной общей поверхности зернистого тела, что равносильно повышению свободной поверхностной энергии, т.е. движущей силы процесса спекания;
сокращением пути диффузии вакансий и атомов за счет уменьшения расстояния между источником и поглотителями вакансий;
увеличением числа контактов между зернами в единице объема, т.е. числа перемычек, перемещение которых приводит к заполнению пор материалом.
Скорость и степень спекания растут с увеличением температуры, а при данной темпера-туре, если она достаточно велика, — с увеличением продолжительности выдержки.
3. Степень дефектности кристалл. решетки компонентов спекающегося материала
4. Вязкость и поверхностное натяжение расплава
Уменьшение вязкости, ускоряют процесс спекания, однако вязкость не должна быть излишне низкой, поскольку в этом случае может произойти деформация изделий под действием собственного веса. Повышение поверхностного натяжения жидкой фазы, стягивающего пору, при условии хорошего смачивания ею зерен твердой фазы также способствует жидкостному спеканию.
Слайд 92РЕКРИСТАЛЛИЗАЦИЯ
Рекристаллизация — происходящий в твердой фазе процесс роста одних кристаллов твердого тела
РЕКРИСТАЛЛИЗАЦИЯ
Рекристаллизация — происходящий в твердой фазе процесс роста одних кристаллов твердого тела

Первичная рекристаллизация представляет собой процесс, при котором в твердом теле, подвергнутом пластической деформации, при нагревании происходит образование центров кристаллизации и последующий рост кристаллов, свободных от искажений, за счет кристаллов, искаженных при деформации
Градиент искажений (ΔH):
где H1 и H2 — степень искажения решетки в первом и втором сравниваемых пунктах тела, определяемая, например, плотностью дислокаций; L1-2 — расстояние между этими пунктами, i — интенсивность процесса зародышеобразования при данной температуре; k — коэффициент пропорциональности; п — число искажений в единице объема
i=k·ΔH·n
где Qn и Qc — энергии активации скорости зародышеобразования и скорости роста кристаллов соответственно; n0 и co —константы; R — газовая постоянная
Слайд 93Вторичная рекристаллизация
Вторичная рекристаллизация представляет собой происходящий при нагревании твердого тела процесс роста
Вторичная рекристаллизация
Вторичная рекристаллизация представляет собой происходящий при нагревании твердого тела процесс роста

Движущей силой процесса вторичной рекристаллизации является стремление системы к уменьшению внутренней энергии за счет уменьшения поверхностной энергии, поскольку превращение мелких кристаллов в крупные приводит к уменьшению суммарной поверхности зерен
Скорость (I) перемещения границ между зернами в основном определяется двумя факторами: величиной межфазной поверхностной энергии (σ) и степенью кривизны поверхности между соприкасающимися зернами, характеризуемой радиусом кривизны r:
m - коэффициент, характеризующий подвижность частиц
Слайд 94Механизм роста зерен при вторичной рекристаллизации, обусловленного перемещением межзеренных границ, заключается в
Механизм роста зерен при вторичной рекристаллизации, обусловленного перемещением межзеренных границ, заключается в
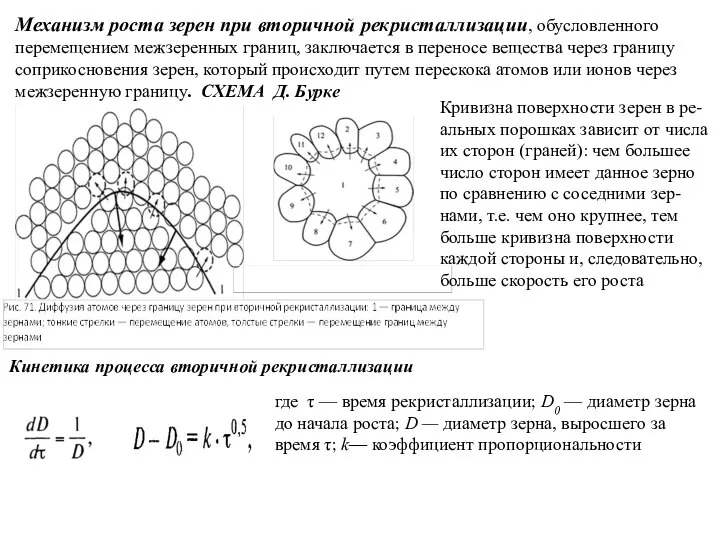
Кривизна поверхности зерен в ре-альных порошках зависит от числа их сторон (граней): чем большее число сторон имеет данное зерно по сравнению с соседними зер-нами, т.е. чем оно крупнее, тем больше кривизна поверхности каждой стороны и, следовательно, больше скорость его роста
Кинетика процесса вторичной рекристаллизации
где τ — время рекристаллизации; D0 — диаметр зерна до начала роста; D — диаметр зерна, выросшего за время τ; k— коэффициент пропорциональности
Слайд 95ПЛАВЛЕНИЕ
Плавление — происходящий при нагревании фазовый переход вещества из твердого состояния в
ПЛАВЛЕНИЕ
Плавление — происходящий при нагревании фазовый переход вещества из твердого состояния в
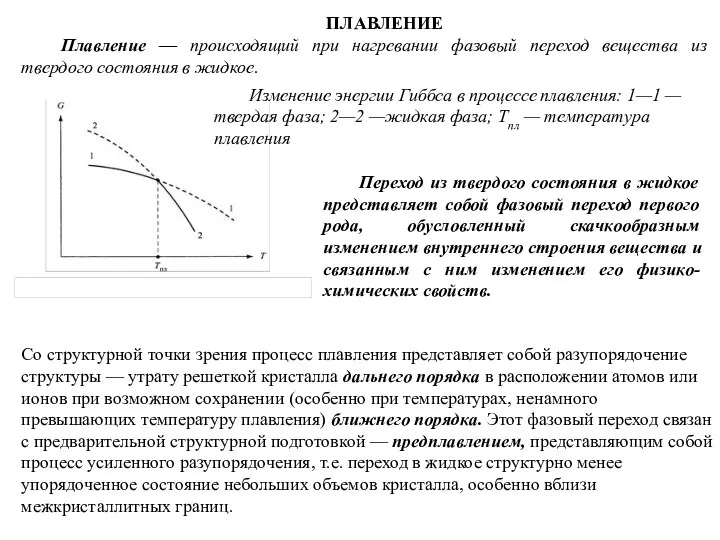
Изменение энергии Гиббса в процессе плавления: 1—1 — твердая фаза; 2—2 —жидкая фаза; Tпл — температура плавления
Переход из твердого состояния в жидкое представляет собой фазовый переход первого рода, обусловленный скачкообразным изменением внутреннего строения вещества и связанным с ним изменением его физико-химических свойств.
Со структурной точки зрения процесс плавления представляет собой разупорядочение структуры — утрату решеткой кристалла дальнего порядка в расположении атомов или ионов при возможном сохранении (особенно при температурах, ненамного превышающих температуру плавления) ближнего порядка. Этот фазовый переход связан с предварительной структурной подготовкой — предплавлением, представляющим собой процесс усиленного разупорядочения, т.е. переход в жидкое структурно менее упорядоченное состояние небольших объемов кристалла, особенно вблизи межкристаллитных границ.
Слайд 96Температура плавления, определяющая их тугоплавкость. Условием высокой темпе-ратуры плавления (Tпл) является соотношение
Температура плавления, определяющая их тугоплавкость. Условием высокой темпе-ратуры плавления (Tпл) является соотношение
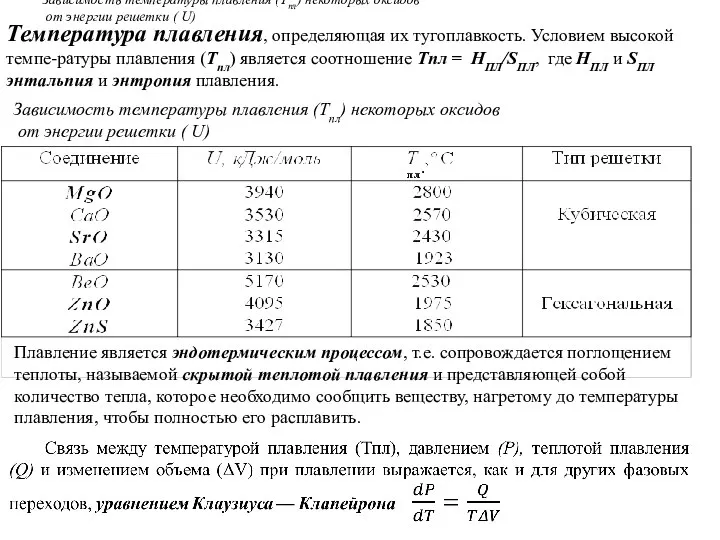
Зависимость температуры плавления (Tпл) некоторых оксидов
от энергии решетки ( U)
Зависимость температуры плавления (Tпл) некоторых оксидов
от энергии решетки ( U)
Плавление является эндотермическим процессом, т.е. сопровождается поглощением теплоты, называемой скрытой теплотой плавления и представляющей собой количество тепла, которое необходимо сообщить веществу, нагретому до температуры плавления, чтобы полностью его расплавить.
Слайд 97КРИСТАЛЛИЗАЦИЯ
Кристаллизация представляет собой фазовое превращение, в результате которого из структурно неупорядоченной фазы
КРИСТАЛЛИЗАЦИЯ
Кристаллизация представляет собой фазовое превращение, в результате которого из структурно неупорядоченной фазы

Кристаллизация может происходить только из пересыщенных растворов или переохлажденных расплавов Степень переохлаждения определяется величиной Т0 — T, где Т0 — температура ликвидуса, Т— температура, при которой при данных условиях начинается кристаллизация расплава
Различают две связанные друг с другом стадии кристаллизации: образование центров (зародышей) кристаллизации и рост кристаллов
Гомогенное образование центров кристаллизации
Флуктуащонная теория рассматривает процесс гомогенного зародышеобразования как результат флуктуации свойств жидкости, представляющих собой мгновенные локальные изменения средних значений свойств, например плотности в отдельных микрообъемах, вызываемые непрерывным тепловым движением атомов, ионов и других частиц. При флуктуациях в отдельных точках жидкости происходит случайное сближение частиц и образование динамичных группировок с кристаллоподобной структурой, напоминающей расположение частиц в кристаллическом теле.
Слайд 98Гомогенное образование центров кристаллизации
Образование любой новой поверхности требует затрат энергии, что для
Гомогенное образование центров кристаллизации
Образование любой новой поверхности требует затрат энергии, что для
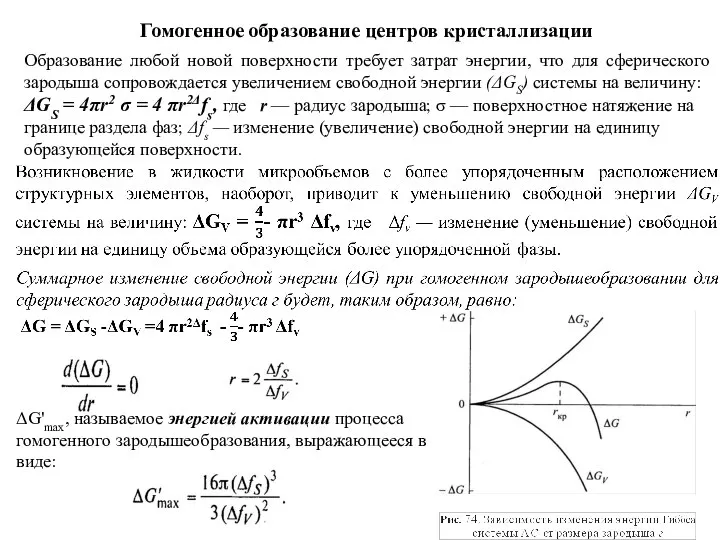
ΔGS = 4πr2 σ = 4 πr2Δfs, где r — радиус зародыша; σ — поверхностное натяжение на границе раздела фаз; Δfs — изменение (увеличение) свободной энергии на единицу образующейся поверхности.
ΔG'max, называемое энергией активации процесса гомогенного зародышеобразования, выражающееся в виде:
Слайд 99Гетерогенное образование центров кристаллизации
По Фольмеру, энергию активации ΔG''mах процесса гетерогенного зародышеобразования можно
Гетерогенное образование центров кристаллизации
По Фольмеру, энергию активации ΔG''mах процесса гетерогенного зародышеобразования можно

ΔG''mах = ΔG'mах.·f(θ),
где ΔG'mах — энергия активации процесса гомогенного зародышеобразования; f(θ) — функция от краевого угла смачивания θ
Если зародыш представляет собой шаровой сегмент, то f(θ).— (функция Фольмера) равна:
наиболее эффективными затравками, выполняющими роль центров кристаллизации, могут служить:
1) частицы кристаллизующегося вещества;
2) частицы другого вещества, изоморфного с кристаллизующимся;
3) частицы, дающие с кристаллизующимся веществом закономерно ориентированные сростки (эпитаксии);
4) частицы вещества, которые легко адсорбируют на своей поверхности атомы кристаллизующегося вещества.
Слайд 100Рост кристаллов
Дислокационный механизм роста кристаллов: 1 — атомная ступенька на грани кристалла
Рост кристаллов
Дислокационный механизм роста кристаллов: 1 — атомная ступенька на грани кристалла
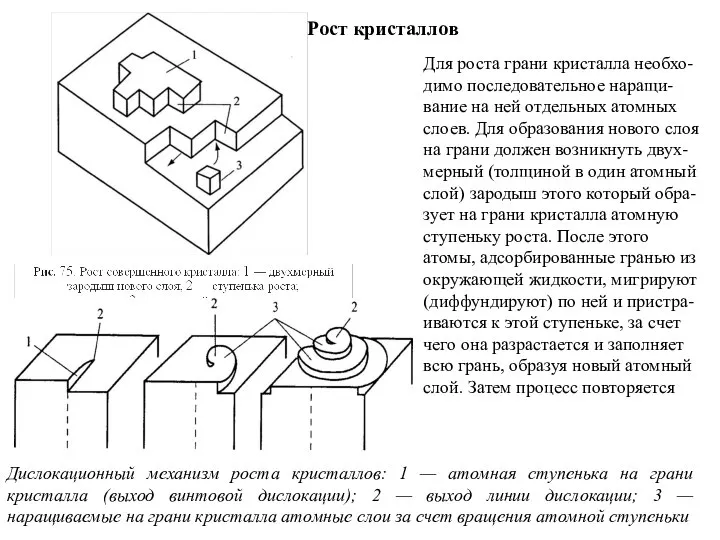
Для роста грани кристалла необхо-димо последовательное наращи-вание на ней отдельных атомных слоев. Для образования нового слоя на грани должен возникнуть двух-мерный (толщиной в один атомный слой) зародыш этого который обра-зует на грани кристалла атомную ступеньку роста. После этого атомы, адсорбированные гранью из окружающей жидкости, мигрируют (диффундируют) по ней и пристра-иваются к этой ступеньке, за счет чего она разрастается и заполняет всю грань, образуя новый атомный слой. Затем процесс повторяется
Слайд 101Кинетика процесса зародышеобразования и роста кристаллов
Скорость гомогенного образования центров кристаллизации, пропорциональная вероятности
Кинетика процесса зародышеобразования и роста кристаллов
Скорость гомогенного образования центров кристаллизации, пропорциональная вероятности

Слайд 102Уравнение Р. Беккера, для скорости гомогенного зародышеобразования в конденсированных системах имеет вид:
Кинетика
Уравнение Р. Беккера, для скорости гомогенного зародышеобразования в конденсированных системах имеет вид:
Кинетика

Где:G'mах—энергия активации процесса гомогенного зародышеобразования; Q — энергия активации процесса диффузии частиц через фазовую границу раздела между зародышем и раствором или расплавом; А— константа
U=λ·f
где λ — диаметр частиц вещества, переходящего из жидкой фазы в твердую; f — частота захвата частиц поверхностью кристалла
Частота захвата частиц поверхностью кристалла зависит от трех факторов:
термодинамической движущей силы этого процесса,
частоты столкновения частиц с поверхностью кристалла \
числа атомов, внедряющихся в структуру кристалла (поскольку часть частиц может вновь уйти с поверхности кристалла).
Термодинамическая движущая сила выражается величиной ΔGV/RT, частота столкновения — величиной 3D/λ2 (D — коэффициент диффузии). Если, кроме этого, через α обозначить число частиц, приобретающих на поверхности кристалла необходимую структурную ориентацию, т.е. число частиц, внедряющихся в кристалл, то выражение для скорости роста кристаллов приобретает вид:
где ΔНУ — теплота фазового превращения, отнесенная к единице объема; Т0 — равновесная температура фазового перехода; Т — температура поверхности раздела фаз; (Т0— Т)— степень переохлаждения,
D = D0exp(-Δ Q/RT),
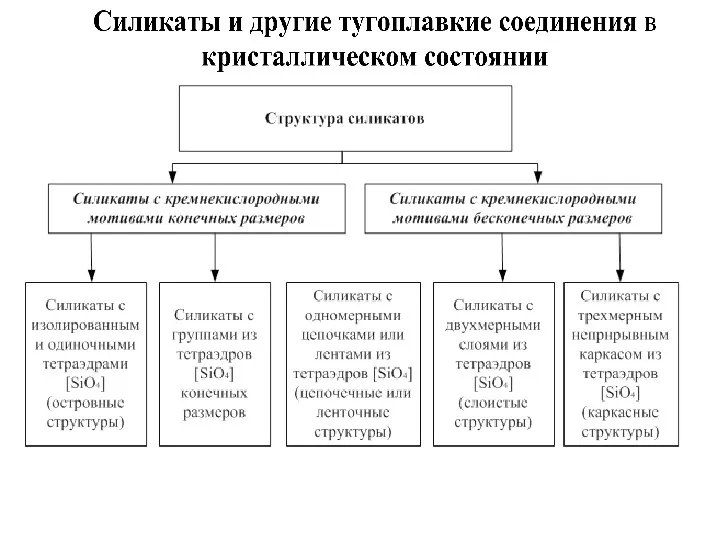
 Спирты
Спирты Предмет химии, простые и сложные вещества
Предмет химии, простые и сложные вещества Композитный материал
Композитный материал Презентация на тему Окислительно – восстановительные реакции
Презентация на тему Окислительно – восстановительные реакции  Химия липидов
Химия липидов Основания, их классификация и свойства
Основания, их классификация и свойства Расчеты по уравнениям химических реакций
Расчеты по уравнениям химических реакций Презентация на тему Белки. Строение и свойства
Презентация на тему Белки. Строение и свойства  Применение ЦОР на уроках биологии и химии
Применение ЦОР на уроках биологии и химии Химическое равновесие
Химическое равновесие 8-9-10 химические формулы
8-9-10 химические формулы Карбонат натрия
Карбонат натрия Химический элемент Франций (Fr)
Химический элемент Франций (Fr) Метод валентных связей
Метод валентных связей Свине́ц (Plumbum;Pb)
Свине́ц (Plumbum;Pb) Презентация на тему Характеристика щелочных металлов 9 класс
Презентация на тему Характеристика щелочных металлов 9 класс  Металлы общая характеристика
Металлы общая характеристика Углеводы
Углеводы Медь и ее сплавы
Медь и ее сплавы Химия. 8 класс
Химия. 8 класс Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Фестиваль песчаных скульптур
Фестиваль песчаных скульптур Электронная структура атома углерода. Лекция 3
Электронная структура атома углерода. Лекция 3 Виготовлення водних розчинів з заданою масовою часткою розчиненої речовини
Виготовлення водних розчинів з заданою масовою часткою розчиненої речовини Стехиометрические законы химии
Стехиометрические законы химии Генетическая связь между классами неорганических соединений
Генетическая связь между классами неорганических соединений 175 – летию со дня рождения Дмитрия Ивановича Менделеева посвящается… АВТОР ПРЕЗЕНТАЦИИ: учитель химии МОУ СОШ №2 города Ртищево Саратовской области ПОПКОВА Е.Г.
175 – летию со дня рождения Дмитрия Ивановича Менделеева посвящается… АВТОР ПРЕЗЕНТАЦИИ: учитель химии МОУ СОШ №2 города Ртищево Саратовской области ПОПКОВА Е.Г. Основания. Классификация. Химические и физические свойства
Основания. Классификация. Химические и физические свойства