Слайд 3Электронная конфигурация ns2np5

Слайд 5Распространённость галогенов в природе
CaF2 — плавиковый шпат
Na3AlF6 — криолит
NaCl — поваренная соль (каменная соль)
KCl — сильвин
KCl∙MgCl2∙6H2O —

карналлит
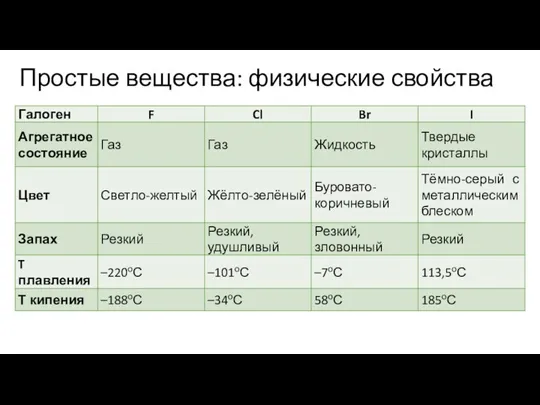
Слайд 7Простые вещества: физические свойства
Слайд 8Способы получения галогенов
1. Получение фтора.
2KHF2 → 2K + H2 + 2F2
3. Получение брома.
2HBr +

Cl2 → Br2 + 2HCl
MnO2 + 4HBr → MnBr2 + Br2 + 2H2O
4. Получение йода.
2KI + Cl2 → I2 + 2KCl
2KI + MnO2 + 2H2SO4 → I2 + K2SO4 + MnSO4 + 2H2O
Слайд 9Способы получения галогенов
2. Получение хлора.
Электролиз расплава хлорида натрия
NaCl → Na+ + Cl−
K(–): Na+

+1e → Na0
A(+): 2Cl− ̶ 2e → Cl20
2Na+ + 2Cl− → 2Na º + Cl2º
2NaCl → 2Na + Cl2
Электролиз раствора хлорида натрия
NaCl → Na+ + Cl−
K(–): 2H2O + 2e → H2° + 2OH−
A(+): 2Cl− ̶ 2e → Cl20
2H2O + 2Cl− → H2°↑ + 2OH− + Cl2°↑
2NaCl + 2H2O → H2↑ + 2NaOH + Cl2↑
В лаборатории
MnO2 + 4HCl → MnCl2 + Cl2↑ + 2H2O
2KMnO4 + 16HCl → 2MnCl2 + 2KCl + 5Cl2↑ + 8H2O
KClO3 + 6HCl → KCl + 3Cl2↑ + 3H2O
K2Cr2O7 + 14HCl → 2CrCl3 + 2KCl + 3Cl2↑ + 7H2O
Слайд 10Химические свойства галогенов
1. Взаимодействие с металлами и неметаллами
1.1. Галогены не горят на

воздухе:
2F2 + O2 → 2OF2
1.2. Взаимодействие с серой:
S + Cl2 → SCl2 (S2Cl2)
S + 3F2 → SF6
1.3. Взаимодействие с фосфором и углеродом:
2P + 5Cl2 → 2PCl5
2P + 3Cl2 → 2PCl3
2F2 + C → CF4
1.4. Взаимодействие с металлами:
3Cl2 + 2Fe → 2FeCl3
I2 + Fe → FeI2
Cl2 + Cu → 2CuCl2
I2 + 2Cu → 2CuI
3Cl2 + 2Al → 2AlCl3
1.5. Взаимодействие с водородом:
F2 + H2 → 2HF
Cl2 + H2 → 2HCl
Br2 + H2 → 2HBr
I2 + H2 ↔ 2HI
1.6. Взаимодействие с галогенами:
Cl2 + F2 → 2ClF
Cl2 + I2 + H2O → HCl + HIO3
Слайд 11Химические свойства галогенов
2. Взаимодействие со сложными веществами
2.1. Растворение в воде:
Cl2 + H2O

↔ HCl + HClO
Cl2 + 6H2O ↔ 5HCl + HClO3
2F2 + 2H2O → 4HF + O2
2.2. Растворение в щелочах:
Сl2 + 2NaOH(хол.) → NaCl + NaClO + H2O
3Cl2 + 6NaOH(гор.) → 5NaCl + NaClO3 + 3H2O
2Сl2 + 2Са(OH)2(хол.) → СaCl2 + Сa(ClO)2 + 2H2O
2.3. Взаимодействие с солями и галогеноводородами:
Cl2 + 2NaI → 2NaCl + I2
Cl2 + 2NaBr → 2NaCl + Br2
2.4. Взаимодействие с восстановителями:
Cl2 + H2S → S + 2HCl
Cl2 + H2O2 → 2HCl + O2









 Периодическая система Д.И. Менделеева
Периодическая система Д.И. Менделеева Презентация на тему ОВР в органической химии
Презентация на тему ОВР в органической химии  Презентация на тему Золото
Презентация на тему Золото  Презентация на тему Неметаллы, особенности строения
Презентация на тему Неметаллы, особенности строения  Алгоритм решения задач по химии.
Алгоритм решения задач по химии. Физика полимеров Ч1
Физика полимеров Ч1 Наука химия. Интеллектуальная игра. 5-8 класс
Наука химия. Интеллектуальная игра. 5-8 класс Алмаз. Свойства алмазов
Алмаз. Свойства алмазов Процесс образования неметаллических включений в стали
Процесс образования неметаллических включений в стали Строение электронных оболочек атомов
Строение электронных оболочек атомов Круговорот серы в природе
Круговорот серы в природе Оценка возможности повышения эффективности процесса гидрирования бутилен- бутадиеновой фракции
Оценка возможности повышения эффективности процесса гидрирования бутилен- бутадиеновой фракции Французский физик, химик, металловед 1850 - 1936
Французский физик, химик, металловед 1850 - 1936 Что такое электрон?
Что такое электрон? Бериллий, магний и щелечноземельные металлы
Бериллий, магний и щелечноземельные металлы Строение материалов. Дефекты кристаллической структуры
Строение материалов. Дефекты кристаллической структуры Алкены
Алкены Ионные равновесия в растворах
Ионные равновесия в растворах Химическая идентификация основных классов биомолекул
Химическая идентификация основных классов биомолекул Презентация на тему Ковалентная химическая связь
Презентация на тему Ковалентная химическая связь  Природные источники углеводородов
Природные источники углеводородов Металлы
Металлы Презентация на тему Йод
Презентация на тему Йод  Электролитическая диссоциация. Электролиты и неэлектролиты
Электролитическая диссоциация. Электролиты и неэлектролиты Тепловой эффект
Тепловой эффект Презентация на тему Углерод
Презентация на тему Углерод  Аммиак NH3
Аммиак NH3 Презентация на тему Щавелевая кислота
Презентация на тему Щавелевая кислота