Содержание
- 2. Обобщить и закрепить знания о сущности процессов окисления и восстановления; окислительно-восстановительных реакциях. Актуализировать знания и умения
- 3. Степень окисления у свободных атомов и у атомов с ковалентной неполярной связью равно нулю. О20 ;
- 4. Пример 1: Определить степени окисления элементов в оксиде натрия Na2O. Степень окисления кислорода равна 6 –
- 5. Вопросы для повторения: 10.02.2012 Какие реакции называются окислительно-восстановительными? Что такое окисление? Какой процесс называют восстановлением? Как
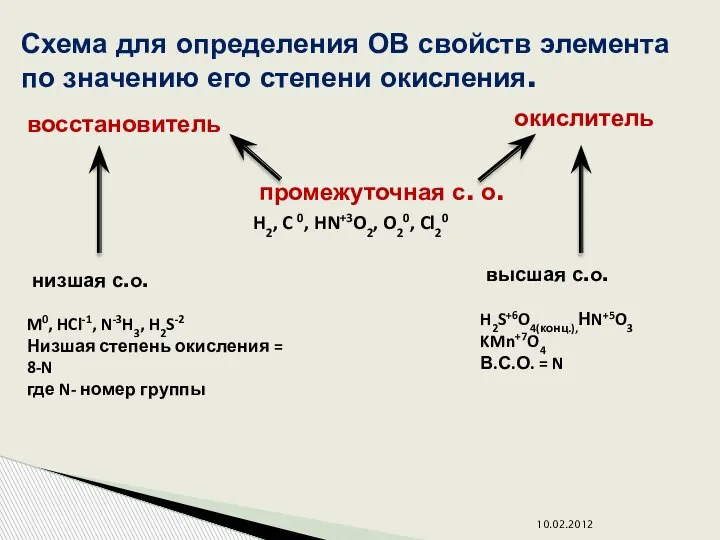
- 6. 10.02.2012 Схема для определения ОВ свойств элемента по значению его степени окисления. восстановитель окислитель промежуточная с.
- 7. Определите степень окисления элементов в следующих соединениях: КСIO3, НСIO4, Са(НСО3)2 , О2 , (NH4)2Cr2O7, NaNO2, H2SeO3,
- 8. Hg+ S = HgS NaNO3 = NaNO2 + O2 CuCl2 + NaOH = NaCl+ Cu(OH)2 Укажите
- 9. Al(OH)3 = Al2O3 + H2O H2O + P2O5 = H3PO4 Mg + HCl = MgCl2 +
- 10. 1) Во всех ли случаях происходит изменение степеней окисления химических элементов? 2) Зависит ли это от
- 11. Реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ . Реакции, при которых
- 12. Расставить степени окисления всех элементов. Выбрать элементы, изменившие степень окисления. Выписать эти элементы и показать схематично
- 13. KMn +7 O4 + HCl-1→ Mn +2Cl2 + KCl + Cl20 + H2O 10.02.2012 Пример. Mn+7
- 14. Расставить коэффициенты методом электронного баланса: NH3 + SO2 → N2 + S + H2O Cl2+ KOH
- 16. Скачать презентацию












 Химия вокруг нас. 10 класс
Химия вокруг нас. 10 класс Облик и габитус кристаллов
Облик и габитус кристаллов Гидролиз солей. Лекция №18
Гидролиз солей. Лекция №18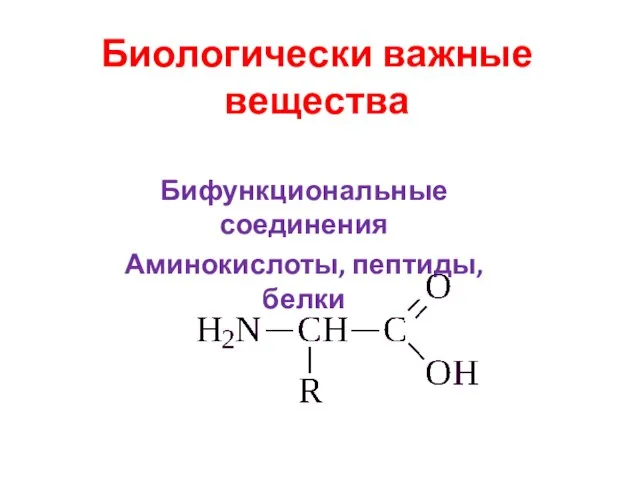 Биологически важные вещества. Бифункциональные соединения. Аминокислоты, пептиды, белки
Биологически важные вещества. Бифункциональные соединения. Аминокислоты, пептиды, белки Л-1-4
Л-1-4 Химия цвета
Химия цвета Дисперсные системы
Дисперсные системы Стеклоткани. Виды стеклотканей
Стеклоткани. Виды стеклотканей Аллотропные модификации углерода
Аллотропные модификации углерода Технология растворов на неводных растворителях
Технология растворов на неводных растворителях Периодическая система химических элементов Д.И. Менделеева. Знаки химических элементов
Периодическая система химических элементов Д.И. Менделеева. Знаки химических элементов Металловедение
Металловедение Углеводороды
Углеводороды Общая характеристика неметаллов. 9 класс
Общая характеристика неметаллов. 9 класс Мышьяк. Висмут. Сурьма
Мышьяк. Висмут. Сурьма Практико-ориентировочный проект Оксиды на службе у человека
Практико-ориентировочный проект Оксиды на службе у человека Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Взаимодействие элементов-неметаллов между собой. 8 класс
Взаимодействие элементов-неметаллов между собой. 8 класс Спирты (алканолы)
Спирты (алканолы) Ароматерапия
Ароматерапия Начало репликации. Направление движения вилки репликации
Начало репликации. Направление движения вилки репликации Современные подходы к преподаванию химии
Современные подходы к преподаванию химии Синтез-газ
Синтез-газ Важнейшие классы неорганических соединений. Соли
Важнейшие классы неорганических соединений. Соли Chemia kosmetyczna
Chemia kosmetyczna Карбоновые кислоты. Сложные эфиры. Жиры
Карбоновые кислоты. Сложные эфиры. Жиры Казанская химическая школа
Казанская химическая школа Фотографии к исследовательской работе в рамках конкурса УРАЛХИМиЯ
Фотографии к исследовательской работе в рамках конкурса УРАЛХИМиЯ