Содержание
- 2. Задача 1. В 150 г воды растворили 50 г фосфорной кислоты. Найти массовую долю кислоты в
- 3. Задача 2 . Смешали 120 г раствора серной кислоты с массовой долей 20% и 40 г
- 4. Задача 3. К 180,0 г 8%-ного раствора хлорида натрия добавили 20 г NaCl. Массовая доля хлорида
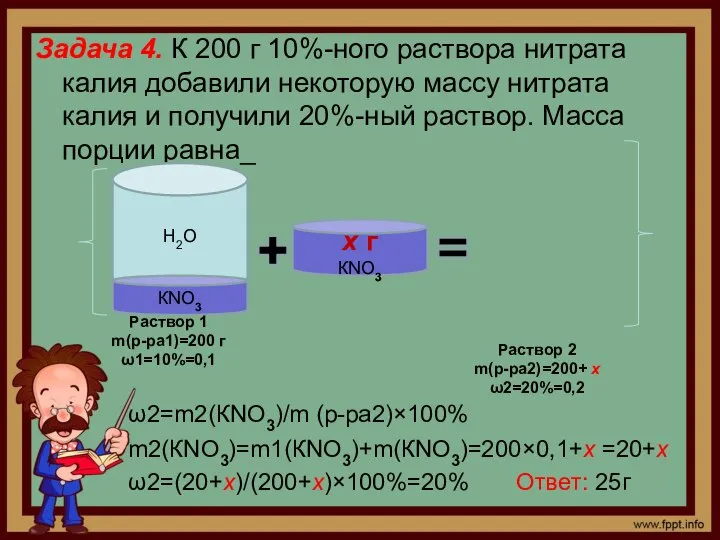
- 5. Задача 4. К 200 г 10%-ного раствора нитрата калия добавили некоторую массу нитрата калия и получили
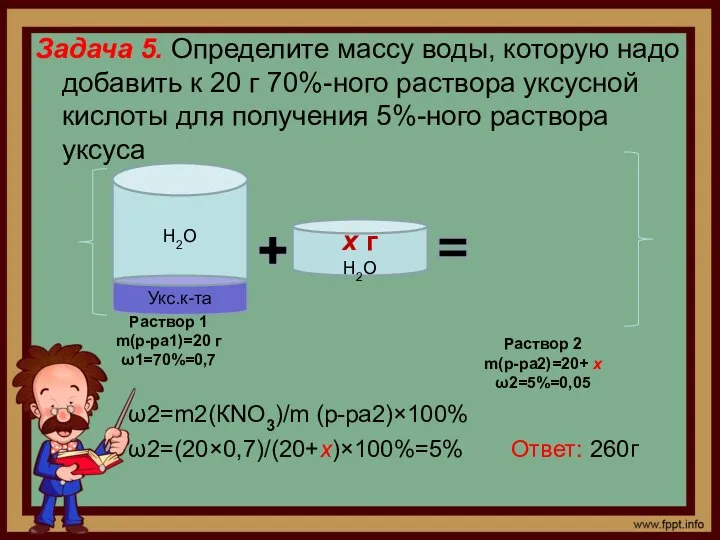
- 6. Задача 5. Определите массу воды, которую надо добавить к 20 г 70%-ного раствора уксусной кислоты для
- 7. Разберем решение двух видов задач из С4 ЕГЭ
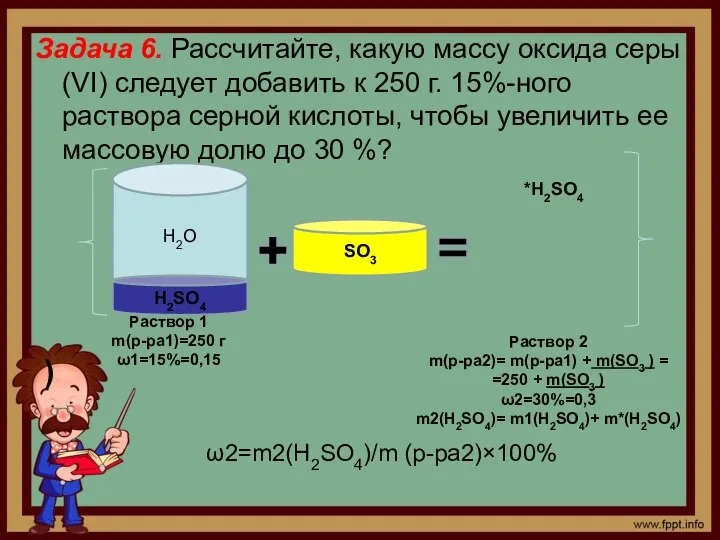
- 8. Задача 6. Рассчитайте, какую массу оксида серы (VI) следует добавить к 250 г. 15%-ного раствора серной
- 9. m2(Н2SО4)= m1(Н2SО4)+ m*(Н2SО4), где m*(Н2SО4) – масса серной кислоты, образовавшейся в ходе реакции SО3 +Н2О =
- 10. Задача 7. Рассчитайте, сколько граммов карбида алюминия следует добавить к 150 г 21%-ного раствора азотной кислоты,
- 12. Скачать презентацию






 Кислород и озон
Кислород и озон Ароматические углеводороды. Взаимное влияние радикалов в молекуле толуола
Ароматические углеводороды. Взаимное влияние радикалов в молекуле толуола Химические свойства амфотерных оксидов и гидроксидов
Химические свойства амфотерных оксидов и гидроксидов Соли. Составление формул и номенклатура
Соли. Составление формул и номенклатура Презентация на тему Угольная кислота и её соли (9 класс)
Презентация на тему Угольная кислота и её соли (9 класс)  Презентация на тему Железо 9 класс
Презентация на тему Железо 9 класс  Фізика гірських порід і процесів. Хімічні зв'язки в мінералах. Іонний зв'язок
Фізика гірських порід і процесів. Хімічні зв'язки в мінералах. Іонний зв'язок Графен. Нобелевская премия 2016
Графен. Нобелевская премия 2016 Получение и реакции пиразина
Получение и реакции пиразина Понятие о веществе. Свойства веществ
Понятие о веществе. Свойства веществ Новые грани парфюмерии. Задача 5
Новые грани парфюмерии. Задача 5 Алкины. Строение алкинов
Алкины. Строение алкинов Классификация спиртов
Классификация спиртов Реакционная способность химических соединений. Лекция 9
Реакционная способность химических соединений. Лекция 9 Отрасли химии
Отрасли химии Водород – топливо будущего
Водород – топливо будущего Конструкционные и специальные материалы холодильной техники
Конструкционные и специальные материалы холодильной техники Углеводы
Углеводы Особенности растворов высокомолекулярных соединений (ВМС). Вязкость растворов ВМС. Набухание. Рубежный контроль №1
Особенности растворов высокомолекулярных соединений (ВМС). Вязкость растворов ВМС. Набухание. Рубежный контроль №1 Строение атома. Связь основных характеристик атома с его положением в таблице Д.И. Менделеева. Способы изображения строения
Строение атома. Связь основных характеристик атома с его положением в таблице Д.И. Менделеева. Способы изображения строения Чему равно общее количество электронов в атоме?
Чему равно общее количество электронов в атоме? Чистые вещества и смеси
Чистые вещества и смеси Сульфиты. Виды сульфидов
Сульфиты. Виды сульфидов Классификация и номенклатура ОС
Классификация и номенклатура ОС Кинетика химических и биохимических процессов. Часть 1
Кинетика химических и биохимических процессов. Часть 1 Презентация по Химии "Законы газового состояния вещества"
Презентация по Химии "Законы газового состояния вещества"  Биологически важные реакции монофункциональных соединений. Реакционная способность спиртов, фенолов, тиолов, аминов
Биологически важные реакции монофункциональных соединений. Реакционная способность спиртов, фенолов, тиолов, аминов Электронное строение атомов бора и фосфора
Электронное строение атомов бора и фосфора