Содержание
- 2. Образование раствора: Физическая теория Химическая Взаимодействие частиц: Силы Ван-дер-Ваальса Ион-дипольное Специфичное
- 3. Растворы газов в газах: Общее давление газовой смеси равно сумме парциальных давлений всех входящих в неё
- 4. Растворимость газов в жидкостях Растворимость газа в жидкости прямо пропорциональна его давлению над жидкостью Закон Генри
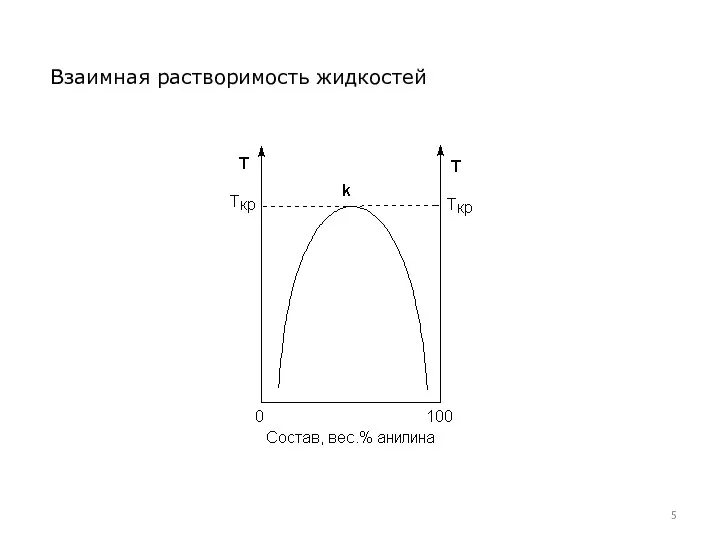
- 5. Взаимная растворимость жидкостей
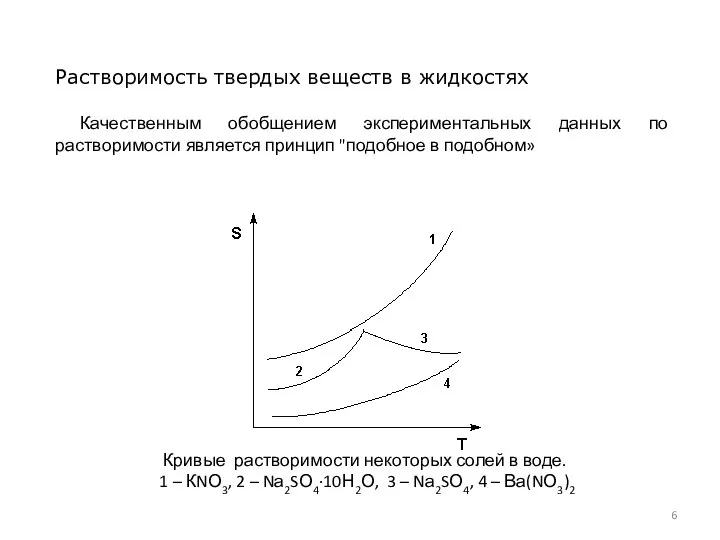
- 6. Растворимость твердых веществ в жидкостях Качественным обобщением экспериментальных данных по растворимости является принцип "подобное в подобном»
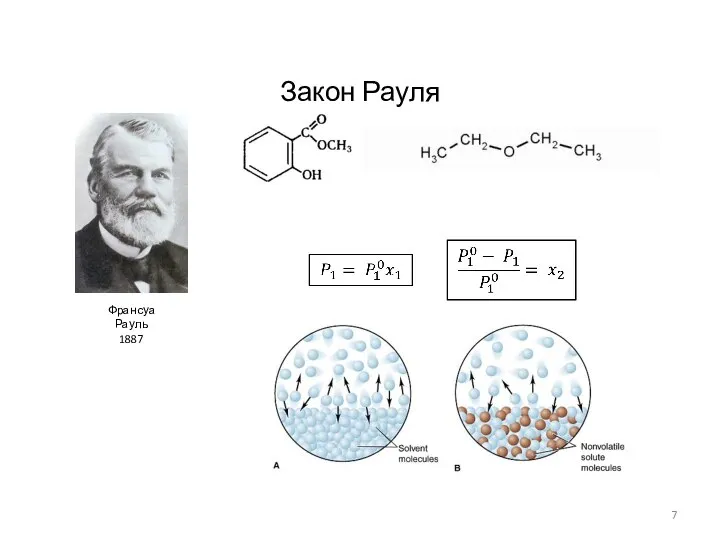
- 7. Закон Рауля Франсуа Рауль 1887
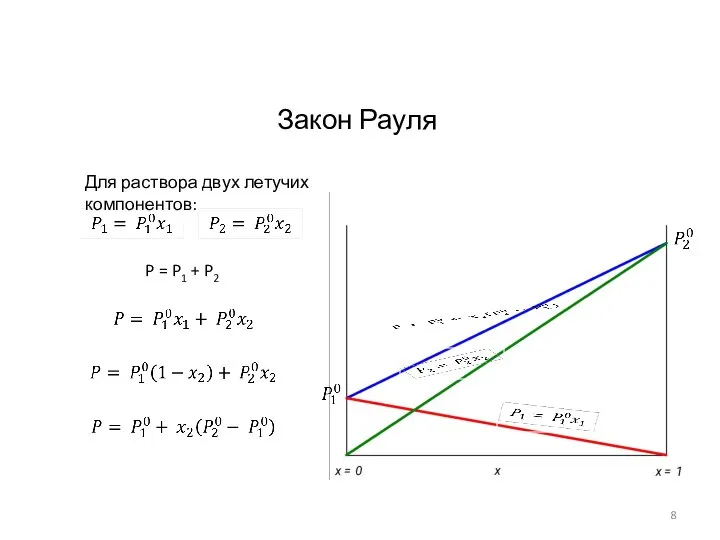
- 8. Закон Рауля P = P1 + P2 Для раствора двух летучих компонентов:
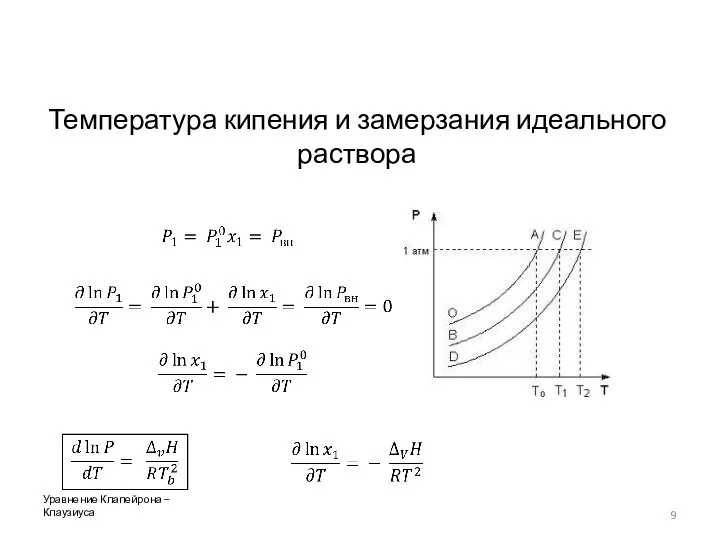
- 9. Температура кипения и замерзания идеального раствора Уравнение Клапейрона – Клаузиуса
- 10. Температура кипения и замерзания идеального раствора Уравнение Клапейрона – Клаузиуса
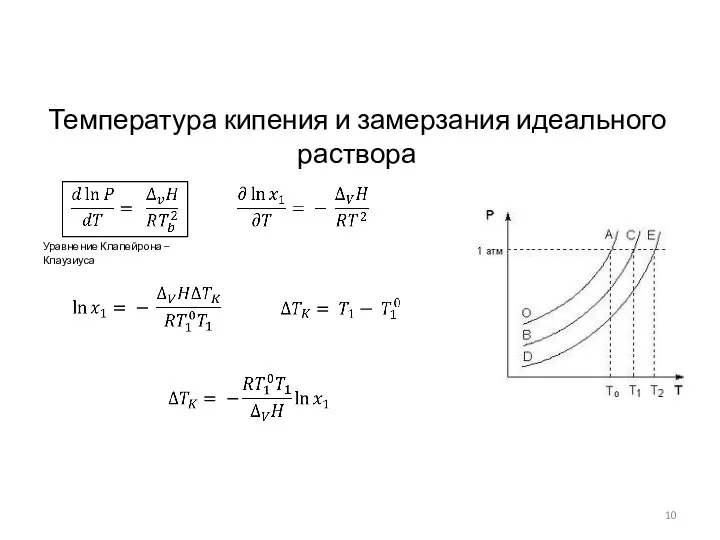
- 11. Температура кипения и замерзания идеального раствора
- 12. Температура кипения и замерзания идеального раствора Эбуллиоскопическая постоянная
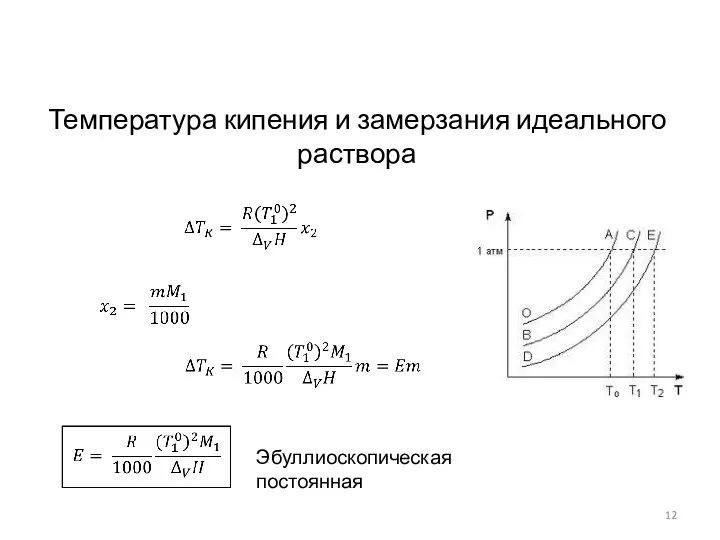
- 13. Температура кипения и замерзания идеального раствора
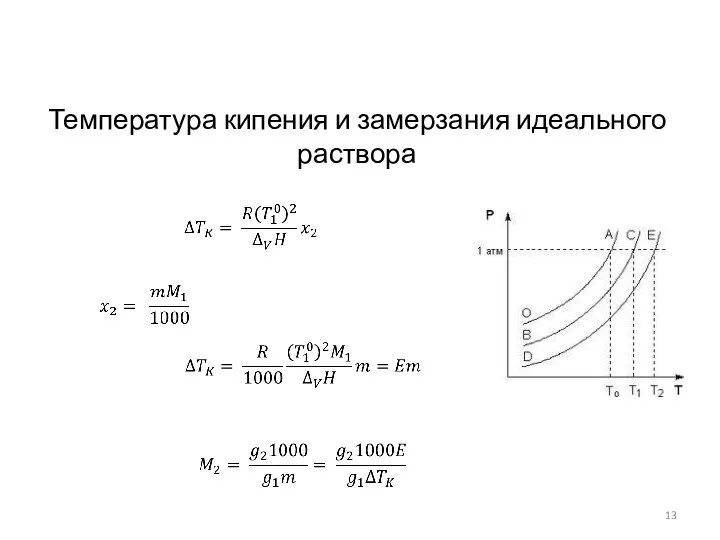
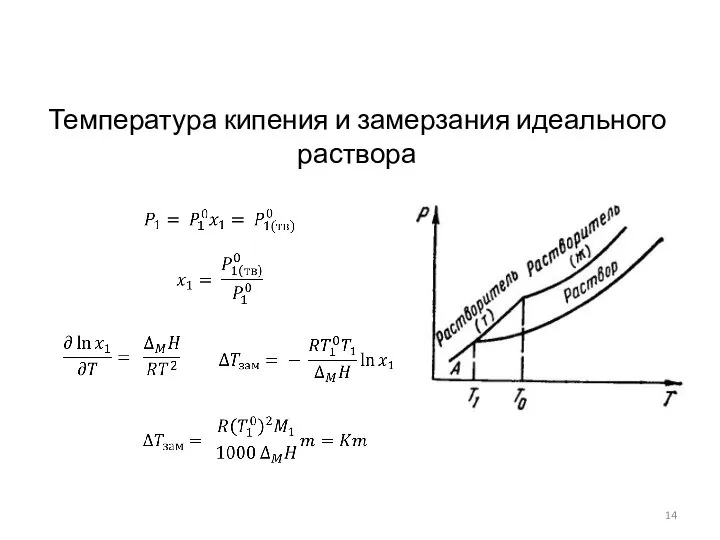
- 14. Температура кипения и замерзания идеального раствора
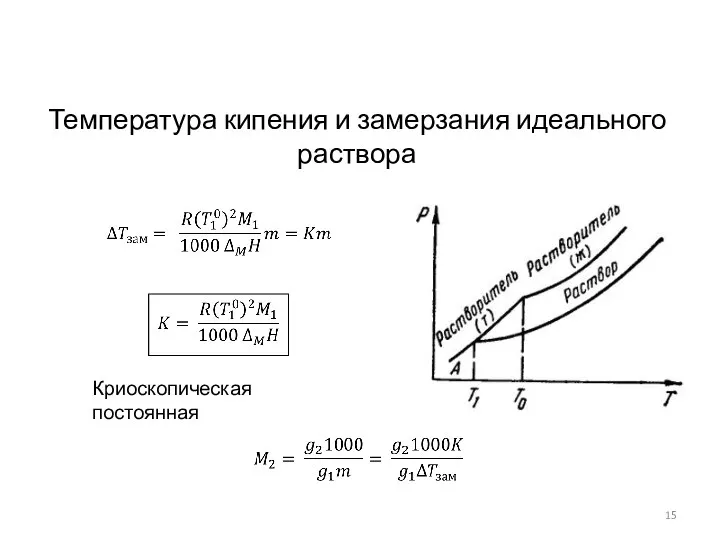
- 15. Температура кипения и замерзания идеального раствора Криоскопическая постоянная
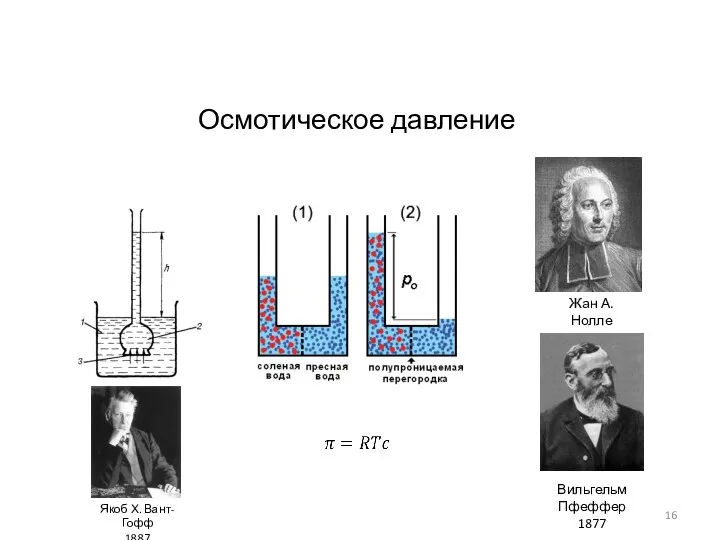
- 16. Осмотическое давление Жан А. Нолле 1748 Вильгельм Пфеффер 1877 Якоб Х. Вант-Гофф 1887
- 17. При установлении равновесия Осмотическое давление
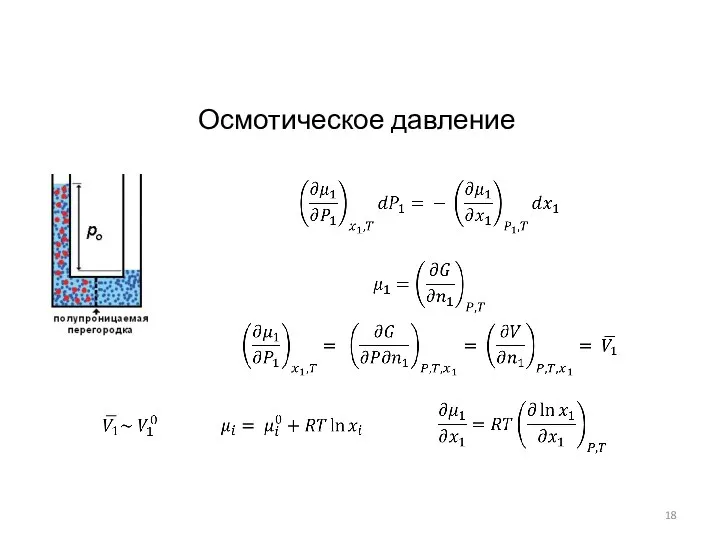
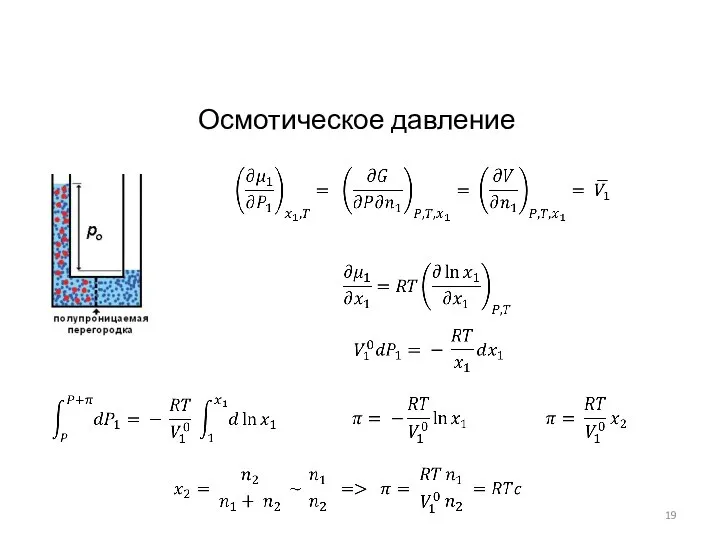
- 18. Осмотическое давление
- 19. Осмотическое давление
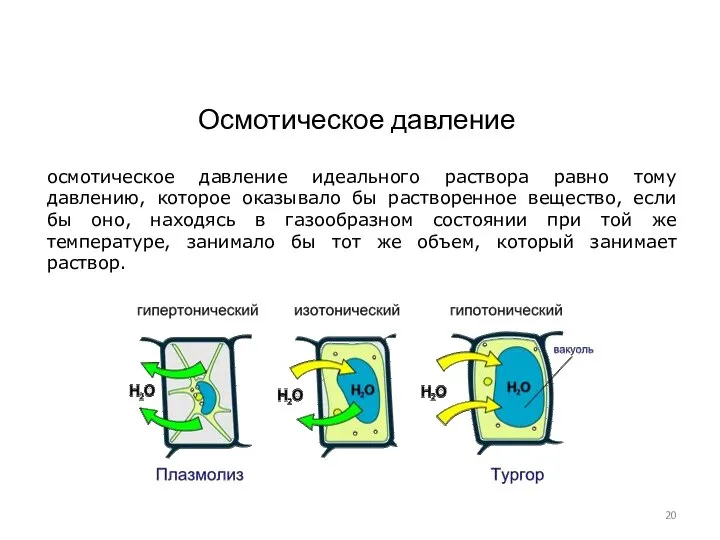
- 20. осмотическое давление идеального раствора равно тому давлению, которое оказывало бы растворенное вещество, если бы оно, находясь
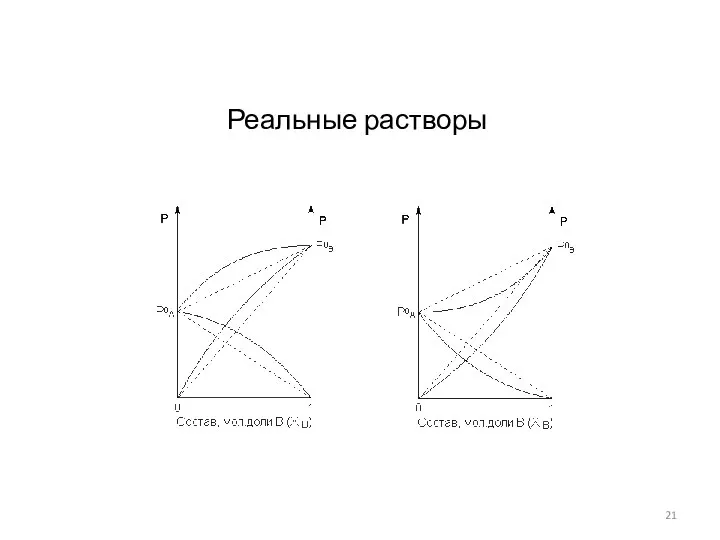
- 21. Реальные растворы
- 22. Реальные растворы Причины отклонения: Изменение сил взаимодействия между молекулами при образовании раствора Изменение среднего размера частиц
- 23. С. Аррениус предложил теорию электролитической диссоциации, основывающуюся на следующих постулатах: 1. Электролиты в растворах распадаются на
- 24. АaВb aАx- + bВy+ РАСТВОРЫ ЭЛЕКТРОЛИТОВ Для бинарного (распадающегося на два иона) электролита
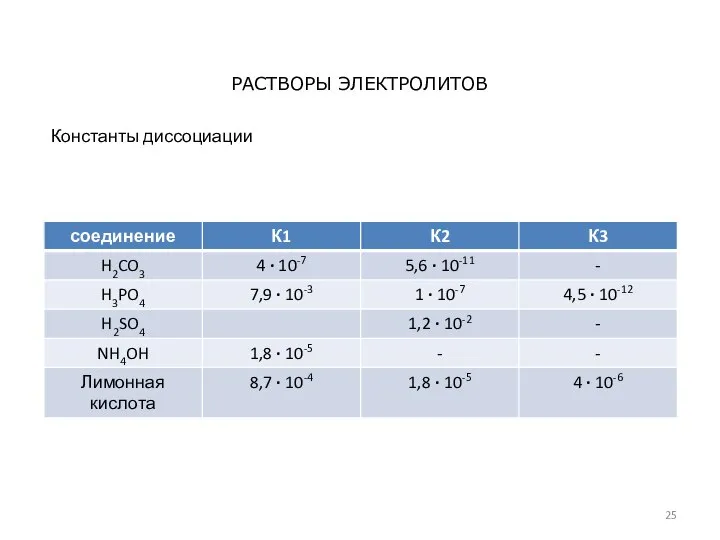
- 25. Константы диссоциации РАСТВОРЫ ЭЛЕКТРОЛИТОВ
- 26. закон разбавления Оствальда. РАСТВОРЫ ЭЛЕКТРОЛИТОВ изотонический коэффициент показывает, во сколько раз общее число молекул и ионов
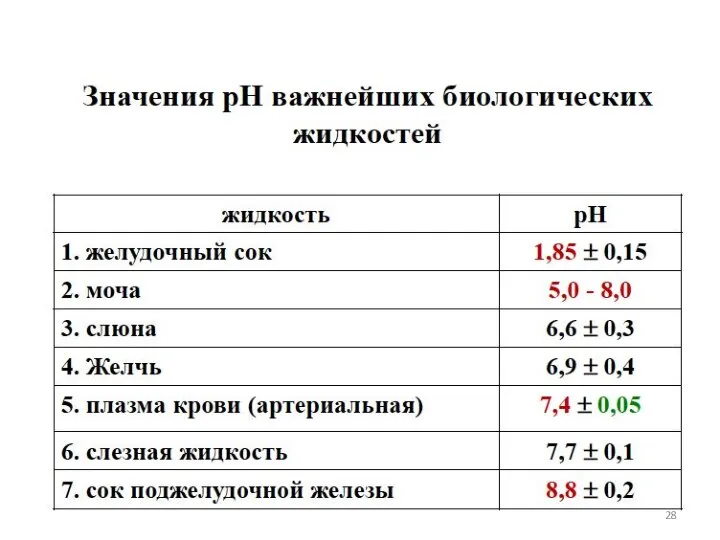
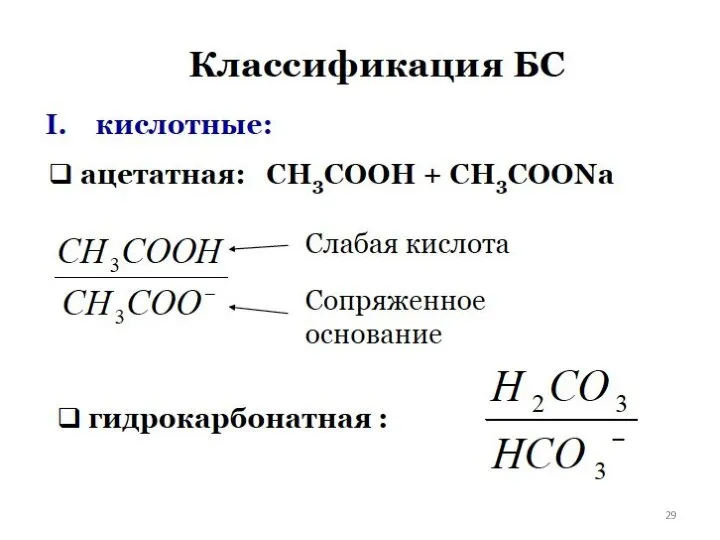
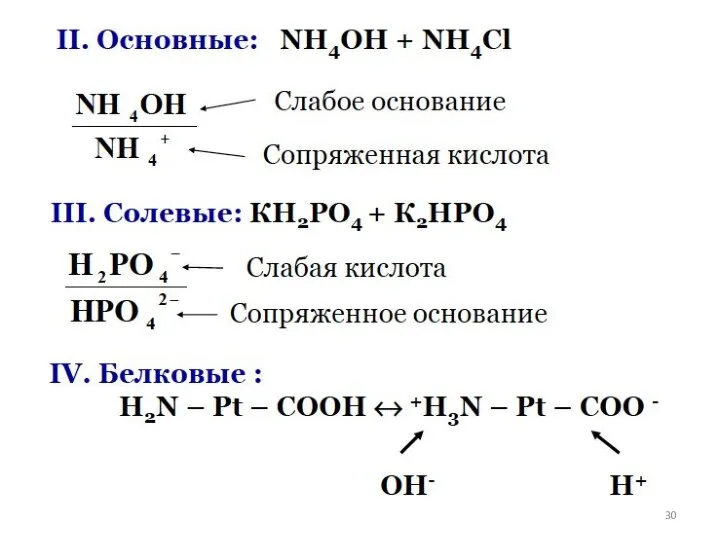
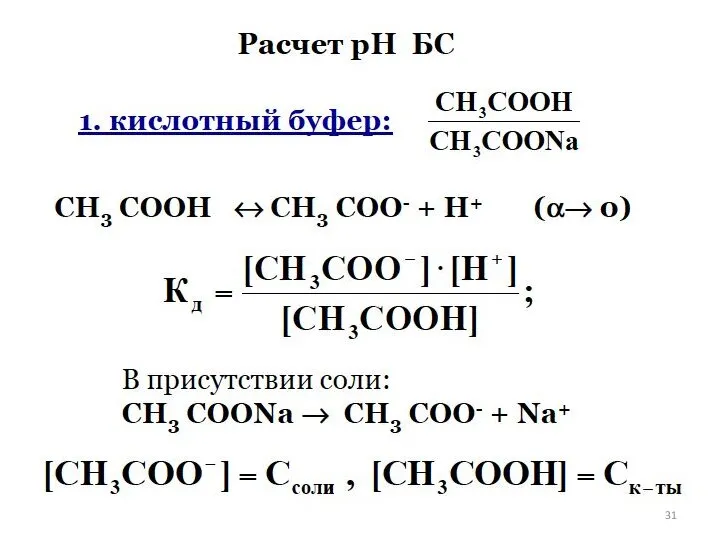
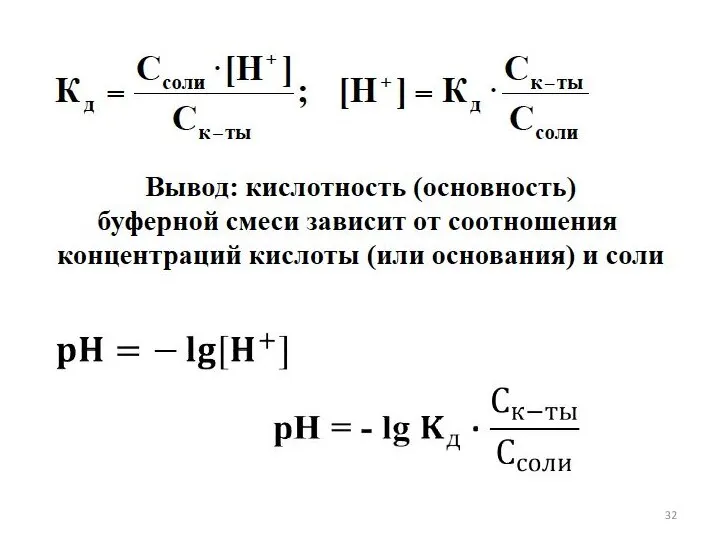
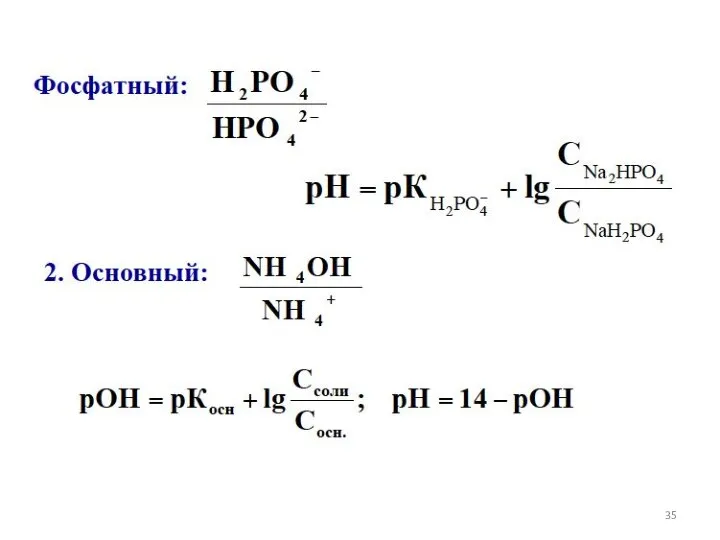
- 27. БУФЕРНЫЕ РАСТВОРЫ
- 40. Скачать презентацию














 Разбор ДЗ. Титрование – общие моменты
Разбор ДЗ. Титрование – общие моменты Систематизация знаний по периодической системе химических элементов
Систематизация знаний по периодической системе химических элементов DOC-20221011-WA0003
DOC-20221011-WA0003 История развития технологий термического крекинга в России и мире
История развития технологий термического крекинга в России и мире Классификация неорганических веществ
Классификация неорганических веществ Многообразие органических веществ
Многообразие органических веществ Воздух. Относительная плотность газов
Воздух. Относительная плотность газов Ксилит. Получение
Ксилит. Получение Обобщение знаний об углеводородах
Обобщение знаний об углеводородах Презентация на тему Вещества и их свойства
Презентация на тему Вещества и их свойства  Химия как наука. Краткая история развития химии. Значение химии
Химия как наука. Краткая история развития химии. Значение химии Характеристика переходного элемента на основании его положения в периодической системе Д.И. Менделеева
Характеристика переходного элемента на основании его положения в периодической системе Д.И. Менделеева Калийные удобрения. Лекция 28
Калийные удобрения. Лекция 28 Калий. В природе
Калий. В природе Образование и получение веществ. Естествознание 6 класс
Образование и получение веществ. Естествознание 6 класс Получение бутандиола, как способ переработки природного газа
Получение бутандиола, как способ переработки природного газа Метод проектов: организация деятельности по химии
Метод проектов: организация деятельности по химии Презентация на тему Соли: свойства, получение, применение (8 класс)
Презентация на тему Соли: свойства, получение, применение (8 класс)  Скорость химических реакций
Скорость химических реакций 9-8 кислоты в свете ТЭД (1)
9-8 кислоты в свете ТЭД (1) Металлы в организме человека
Металлы в организме человека Природные источники углеводорода
Природные источники углеводорода Система маркировки пластика
Система маркировки пластика Фуллерены: аллотропы углерода
Фуллерены: аллотропы углерода Правило Марковникова. Полимеризация этилена как основное направление его использования
Правило Марковникова. Полимеризация этилена как основное направление его использования Из опыта формирования и развития универсальных учебных действий при изучении темы Неметаллы
Из опыта формирования и развития универсальных учебных действий при изучении темы Неметаллы Синтез индолов по Неницеску
Синтез индолов по Неницеску Условия среды, вызывающие коррозию металла
Условия среды, вызывающие коррозию металла