Содержание
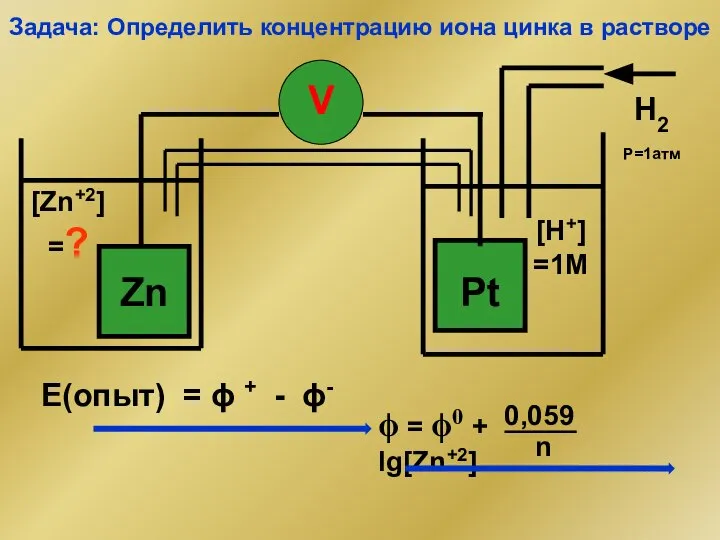
- 2. Задача: Определить концентрацию иона цинка в растворе E(опыт) = ϕ + - ϕ-
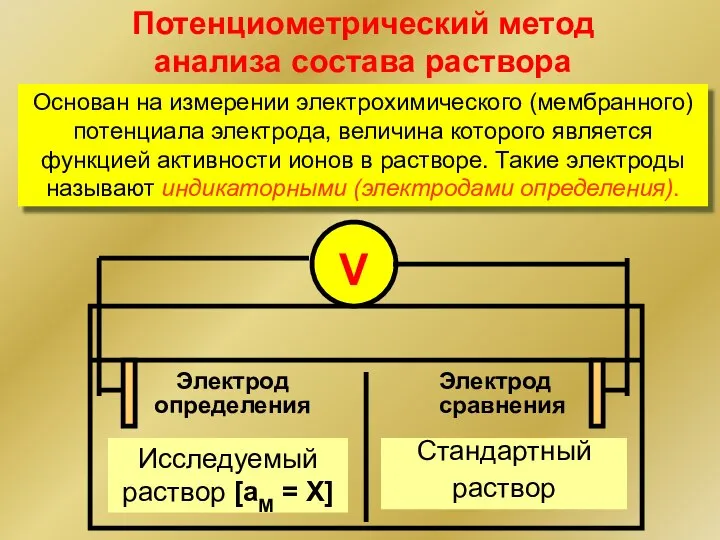
- 3. Потенциометрический метод анализа состава раствора Основан на измерении электрохимического (мембранного) потенциала электрода, величина которого является функцией
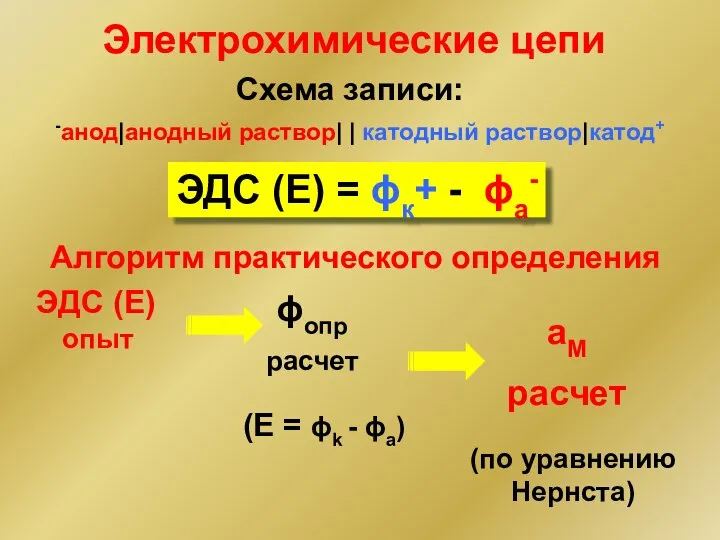
- 4. Схема записи: -анод|анодный раствор| | катодный раствор|катод+ ЭДС (Е) = ϕк+ - ϕа- Электрохимические цепи Алгоритм
- 5. Электроды определения рН-зависимые электроды определения 1. Водородный электрод (Электрод I рода) Редокс-реакция: 2Н++ 2е- ⮀ H2
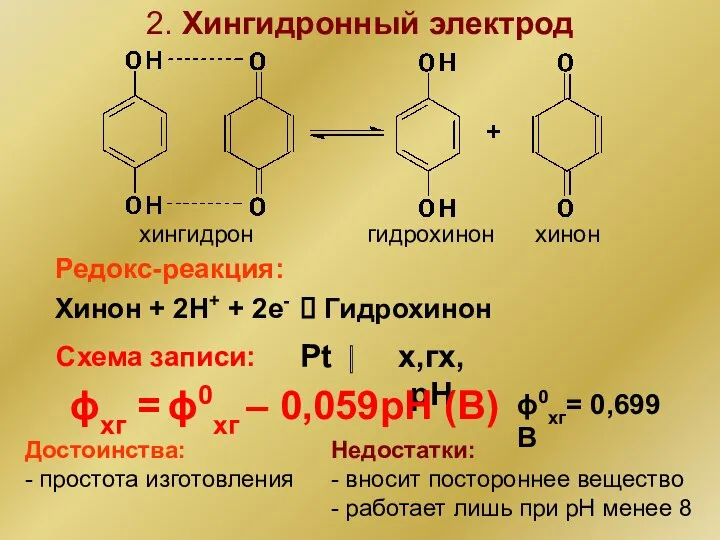
- 6. 2. Хингидронный электрод гидрохинон хинон хингидрон Хинон + 2Н+ + 2е- ⮀ Гидрохинон Редокс-реакция: Схема записи:
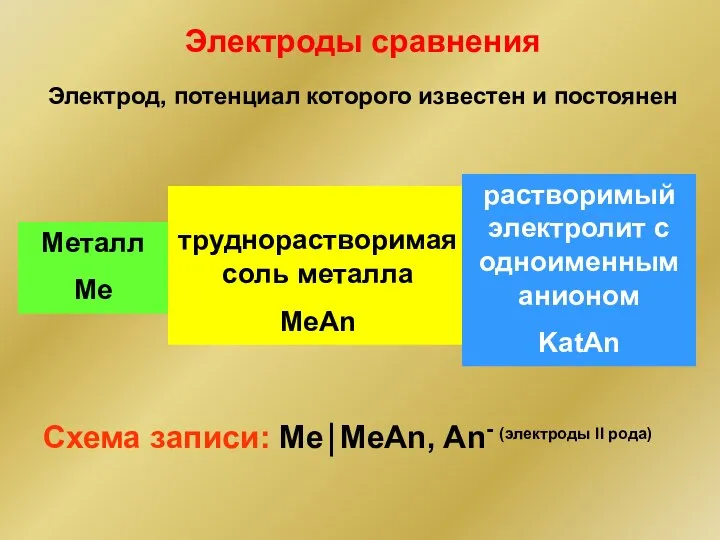
- 7. Металл Me труднорастворимая соль металла MeAn Электроды сравнения Схема записи: Me⏐MeAn, An- (электроды II рода) растворимый
- 8. Хлорсеребряный электрод Редокс-реакция: Ag+ + e- ⮀ Ag Ag+ + Cl- ⮀ AgCl Схема записи: Ag
- 9. Химические цепи состоят из электродов различной природы Электрические цепи гальванического элемента Концентрационные цепи состоят из одинаковых
- 10. Определение рН раствора с помощью хлорсеребряно - водородной химической цепи ϕхс( насыщ.) = 0,202 В >
- 11. Определение рН раствора с помощью хингидрон-хингидронной концентрационной цепи рН раствора в электроде сравнения = 2 Исследуемый
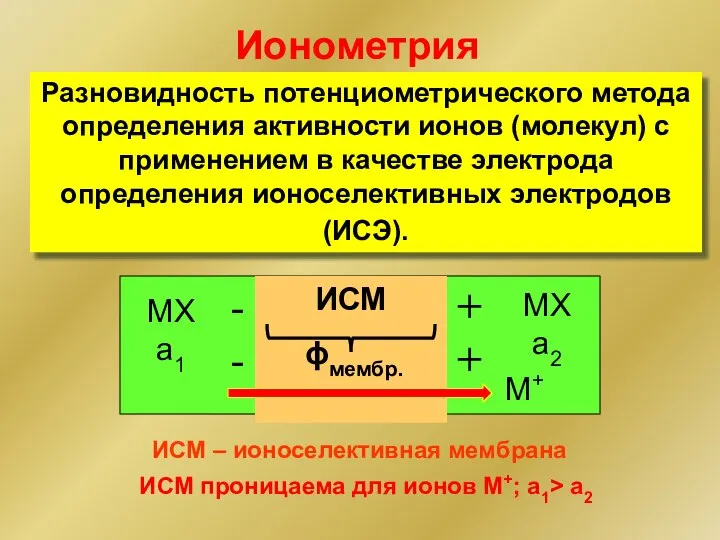
- 12. Разновидность потенциометрического метода определения активности ионов (молекул) с применением в качестве электрода определения ионоселективных электродов (ИСЭ).
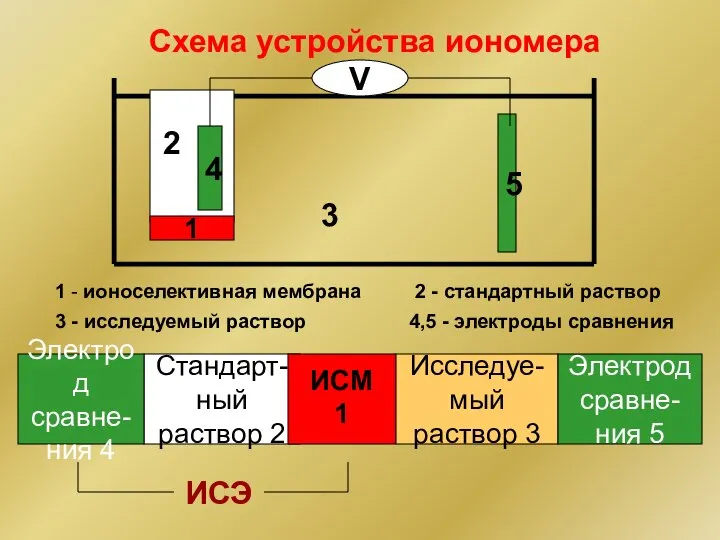
- 13. Стандарт- ный раствор 2 ИСМ 1 3 1 2 1 - ионоселективная мембрана 2 - стандартный
- 14. Мембранный потенциал Z – заряд мигрирующего иона Расчет активных ионных концентраций для идеального электрода Е0 –
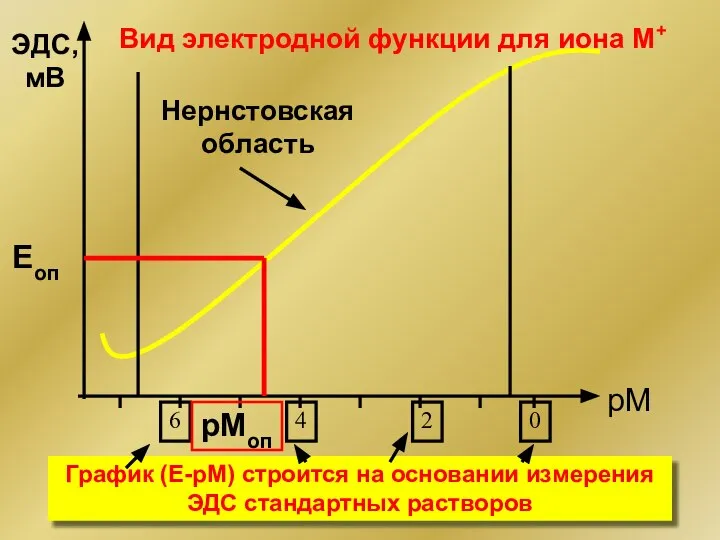
- 15. рМ ЭДС, мВ Нернстовская область Вид электродной функции для иона М+ Eоп pMоп График (Е-рМ) строится
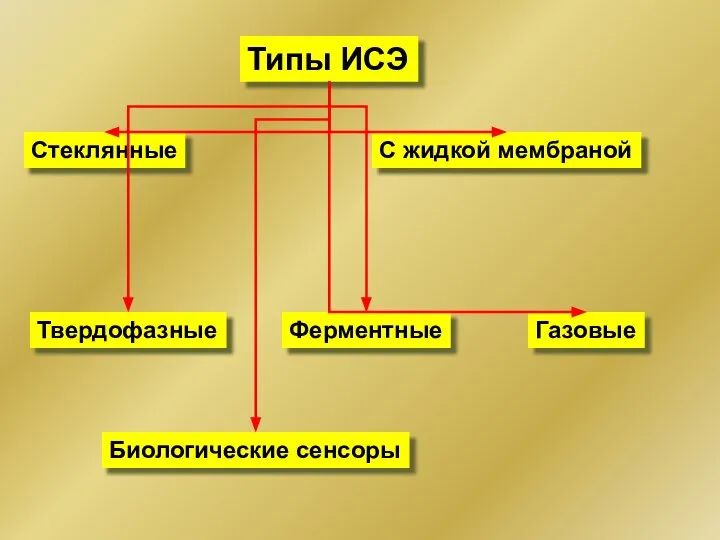
- 16. Типы ИСЭ Стеклянные С жидкой мембраной Твердофазные Газовые Ферментные Биологические сенсоры
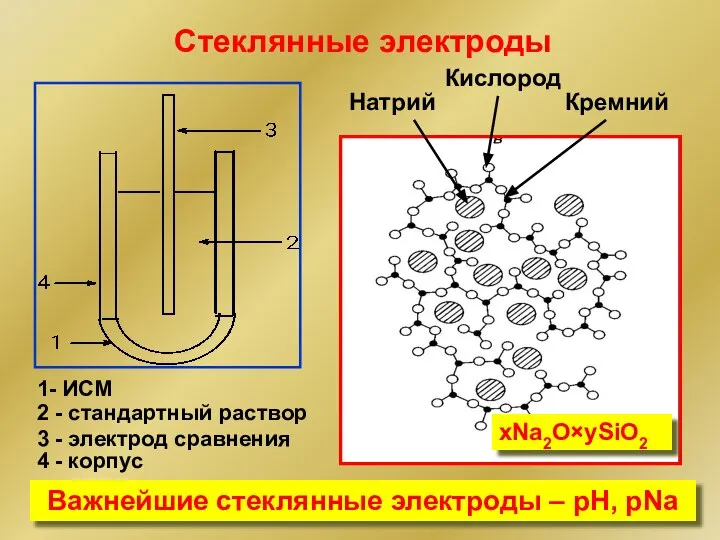
- 17. xNa2O×ySiO2 Стеклянные электроды Натрий Кислород Кремний 1- ИСМ 2 - стандартный раствор 3 - электрод сравнения
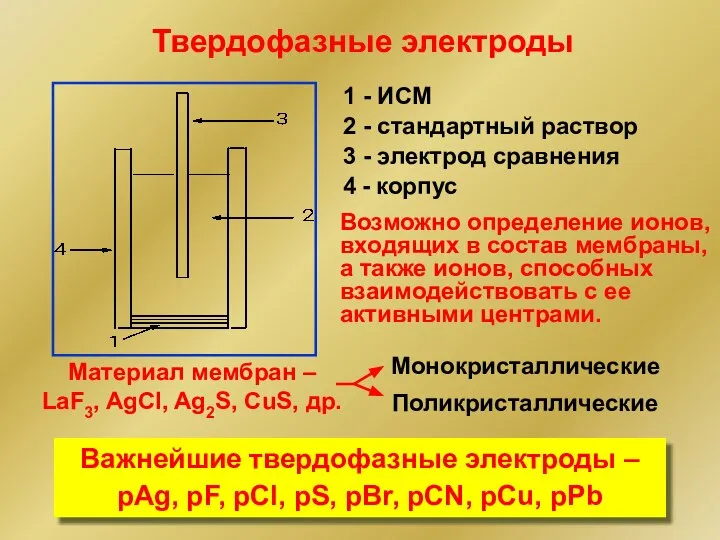
- 18. Твердофазные электроды 1 - ИСМ 2 - стандартный раствор 3 - электрод сравнения 4 - корпус
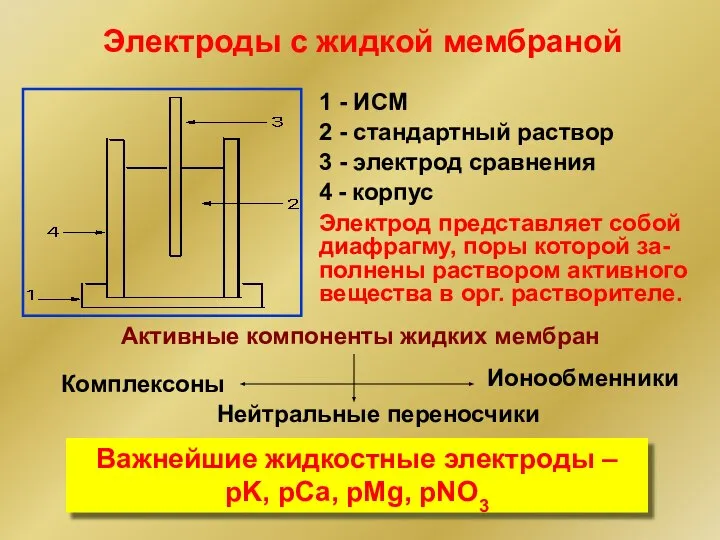
- 19. Электроды с жидкой мембраной 1 - ИСМ 2 - стандартный раствор 3 - электрод сравнения 4
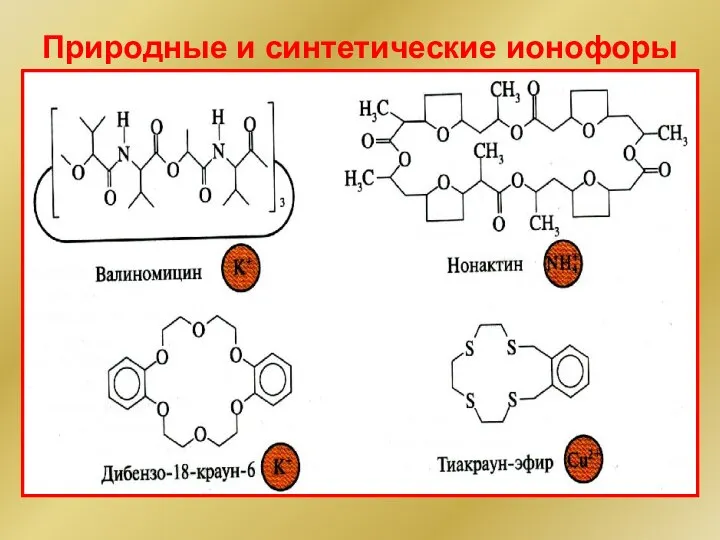
- 20. Природные и синтетические ионофоры
- 21. Газовые электроды Газовые электроды: pCO2, pNH3, pH2S Используется промежуточная реакция, в ходе которой из молекул определяемых
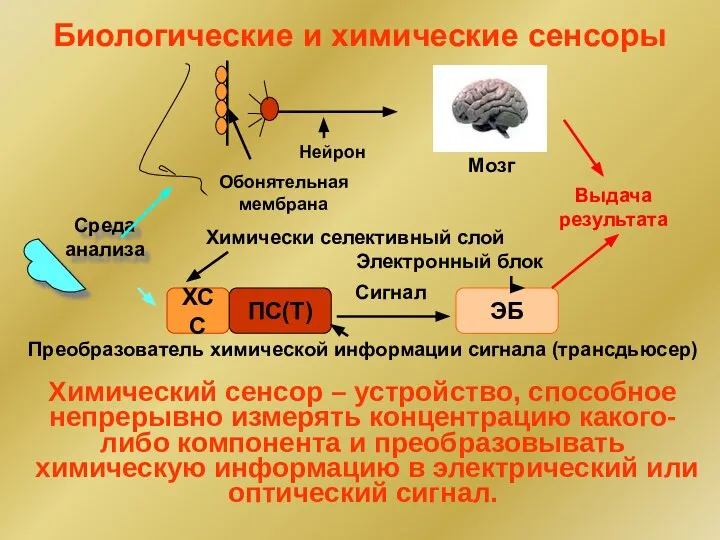
- 22. Биологические и химические сенсоры Среда анализа Обонятельная мембрана Нейрон Мозг Преобразователь химической информации сигнала (трансдьюсер) ХСС
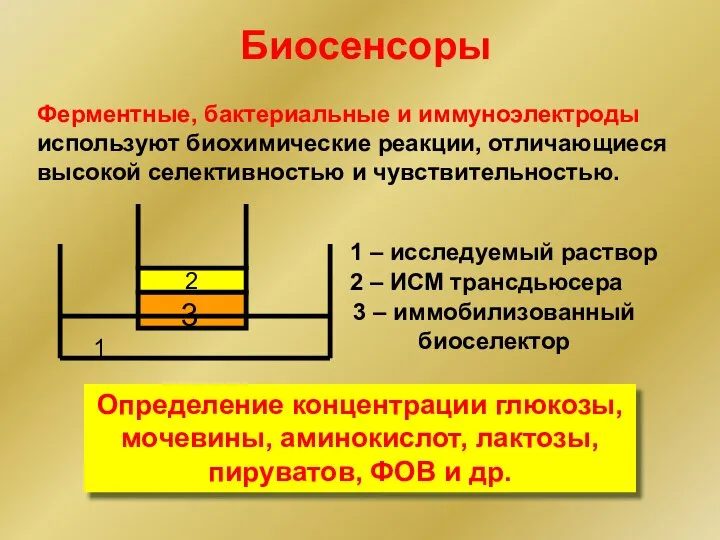
- 23. Биосенсоры Ферментные, бактериальные и иммуноэлектроды используют биохимические реакции, отличающиеся высокой селективностью и чувствительностью. Определение концентрации глюкозы,
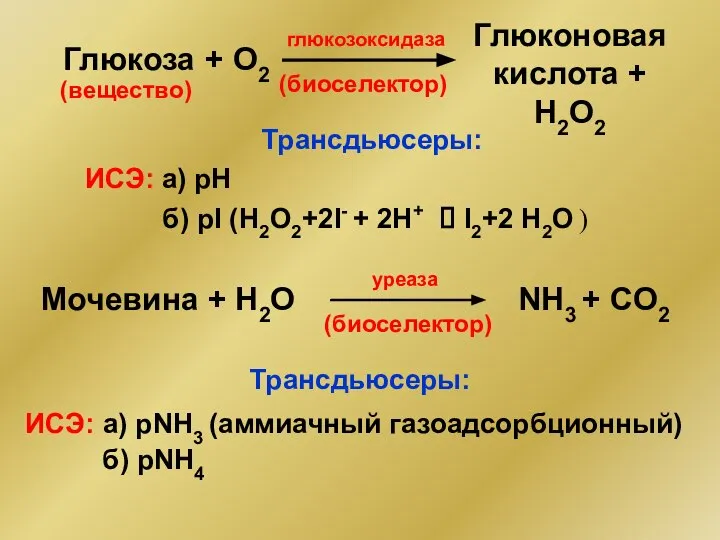
- 24. Глюкоза глюкозоксидаза Глюконовая кислота + Н2О2 Трансдьюсеры: ИСЭ: а) рН б) pI (Н2О2+2I- + 2H+ ⮀
- 25. Преимущества ионометрии Определение активности иона на фоне его общей концентрации (уникальность метода); возможны измерения в окрашенных,
- 27. Скачать презентацию








 Устойчивое развитие
Устойчивое развитие Основы химии буровых растворов
Основы химии буровых растворов Вода – самое удивительное вещество на Земле
Вода – самое удивительное вещество на Земле Полимеры
Полимеры Презентация на тему Кристаллическая решетка
Презентация на тему Кристаллическая решетка  Молекулярно-кинетическая теория. Макро- и микропараметры
Молекулярно-кинетическая теория. Макро- и микропараметры Сахароза (С12Н22О11)
Сахароза (С12Н22О11) Презентация на тему Войди в природу другом
Презентация на тему Войди в природу другом  Небезпечні речовини
Небезпечні речовини Строение электронных оболочек атомов элементов
Строение электронных оболочек атомов элементов Условия преобразования органических веществ
Условия преобразования органических веществ Изучаем химию с Агатой Кристи
Изучаем химию с Агатой Кристи Сера
Сера Химические свойства воды
Химические свойства воды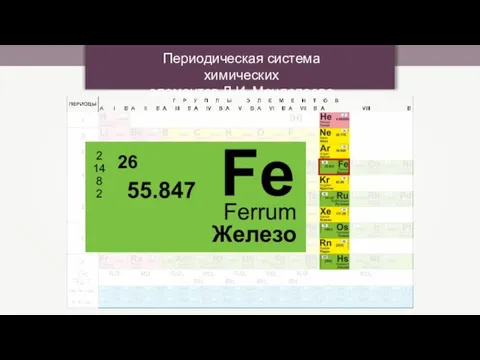 Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Изомерия
Изомерия Эмульсии
Эмульсии Очистка рабочих электродов
Очистка рабочих электродов Ксантановая камедь
Ксантановая камедь Презентация на тему Химия в сельском хозяйстве
Презентация на тему Химия в сельском хозяйстве  Полимеры и пластмассы
Полимеры и пластмассы Приёмы работы с текстом на уроках химии
Приёмы работы с текстом на уроках химии Алмазы
Алмазы Электролиз
Электролиз Периодический закон и периодическая система химических элементов. 11 класс
Периодический закон и периодическая система химических элементов. 11 класс Молекулярная струйная печать
Молекулярная струйная печать Презентация на тему Что такое нано?
Презентация на тему Что такое нано?  Пространственное строение органических соединений
Пространственное строение органических соединений