Содержание
- 3. Обратимость химических реакций. Химическое равновесие.
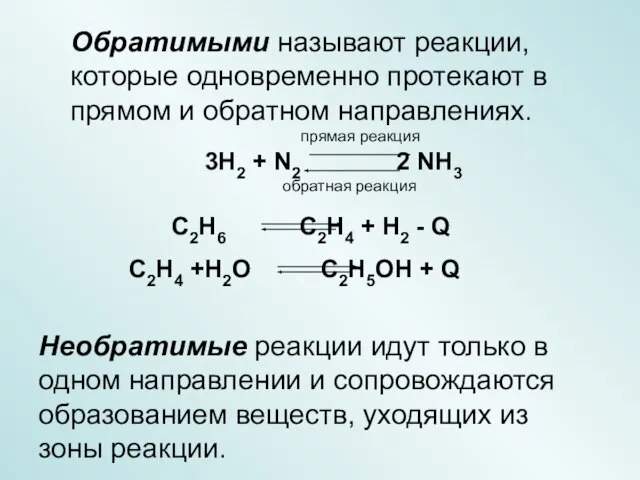
- 4. Обратимые химические реакции. Химическое равновесие. По обратимости обратимые и необратимые.
- 5. Необратимые реакции идут только в одном направлении и сопровождаются образованием веществ, уходящих из зоны реакции.
- 6. Состояние системы, при котором скорость прямой реакции равна скорости обратной реакции, называется химическим равновесием. v пр.
- 7. II. Факторы, влияющие на смещение равновесия. Переход из одного равновесного состояния в другое называется смещением или
- 8. При повышении температуры химическое равновесие смещается в сторону эндотермической реакции.
- 9. Влияние изменения давления. При повышении давления химическое равновесие смещается в сторону меньшего объема.
- 10. Влияние изменения концентрации. При повышении концентрации одного из веществ химическое равновесие смещается в сторону его расходования.
- 12. Скачать презентацию
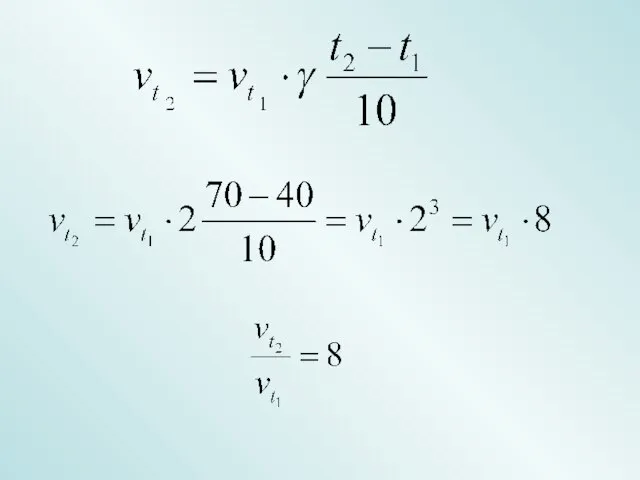







 Скорость химической реакции. Факторы, влияющие на скорость
Скорость химической реакции. Факторы, влияющие на скорость Типы химических реакций
Типы химических реакций Трансляция. Активизирование аминокислоты
Трансляция. Активизирование аминокислоты Эфиры. 10 класс
Эфиры. 10 класс Кремний. Технический кремний
Кремний. Технический кремний Получение этилового спирта из древесины
Получение этилового спирта из древесины Активные формы кислорода (АФК) Reactive Oxygen Species (ROS)
Активные формы кислорода (АФК) Reactive Oxygen Species (ROS) Сульфиты. Сульфаты. Кислотные дожди
Сульфиты. Сульфаты. Кислотные дожди Спазган: применение, форма, свойства, состав
Спазган: применение, форма, свойства, состав Многоатомные спирты
Многоатомные спирты Метод нейтрализации
Метод нейтрализации Металлы. Урок – обобщения
Металлы. Урок – обобщения Железо и его соединения
Железо и его соединения Синтез и магнитные свойства бис(пиразолил)пиридинового комплекса железа II
Синтез и магнитные свойства бис(пиразолил)пиридинового комплекса железа II G11. Химический состав
G11. Химический состав Любовь и химия
Любовь и химия Презентация по Химии "Углекислый газ"
Презентация по Химии "Углекислый газ"  Lecture4-5
Lecture4-5 Основные положения теории строения органических соединений А.М. Бутлерова
Основные положения теории строения органических соединений А.М. Бутлерова Кристаллическое состояние воды - лёд
Кристаллическое состояние воды - лёд Спирты
Спирты Железо
Железо Железо и его соединения
Железо и его соединения Магний и его сплавы
Магний и его сплавы Химические реакции
Химические реакции 11 типы связей
11 типы связей Простые вещества – неметаллы
Простые вещества – неметаллы Теплофизические свойства полимеров. Методы определения теплостойкости полимеров
Теплофизические свойства полимеров. Методы определения теплостойкости полимеров