Содержание
- 2. Электролиты - вещества, растворы и расплавы которых проводят электрический ток (NaCl, NaOH, HCl).
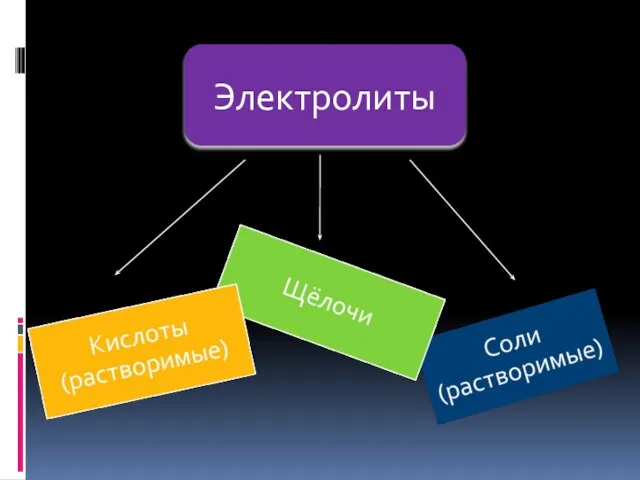
- 3. Электролиты
- 4. Кислоты- это электролиты, которые диссоциируют на катионы водорода и анионы кислотного остатка. HCI = H+ +
- 5. Многоосновные кислоты диссоциируют ступенчато: 1 стадия: H3PO4 H+ + H2PO4- 2 стадия: H2PO4- H+ + HPO42-
- 6. Основания- это электролиты, которые диссоциируют на катионы металлов и анионы гидроксогрупп. NaOH = Na+ + OH-
- 7. Соли - это электролиты, которые диссоциируют на катионы металла и анионы кислотного остатка. Na Cl =
- 8. Вывод: Общие свойства кислот объясняются наличием в них ионов H+ , а общие свойства щелочей –
- 10. Скачать презентацию






 Презентация на тему Физические и химические явления 8 класс
Презентация на тему Физические и химические явления 8 класс  Пятичленные гетероциклы с двумя и более атомами азота
Пятичленные гетероциклы с двумя и более атомами азота Химические свойства металлов. Электрохимический ряд напряжения металлов
Химические свойства металлов. Электрохимический ряд напряжения металлов Фізика гірських порід і процесів. Хімічні зв'язки в мінералах. Іонний зв'язок
Фізика гірських порід і процесів. Хімічні зв'язки в мінералах. Іонний зв'язок Презентация на тему Нанохимия
Презентация на тему Нанохимия  Презентация на тему Альдегиды (10 класс)
Презентация на тему Альдегиды (10 класс)  Классификация методов аналитической химии
Классификация методов аналитической химии Химические свойства алканов. Алканы
Химические свойства алканов. Алканы Химическае препараты
Химическае препараты Пидорасня
Пидорасня Введение в органическую химию. Классификация органических соединений
Введение в органическую химию. Классификация органических соединений Агрегатные состояния вещества
Агрегатные состояния вещества Стелс-материалы
Стелс-материалы Химическая связь
Химическая связь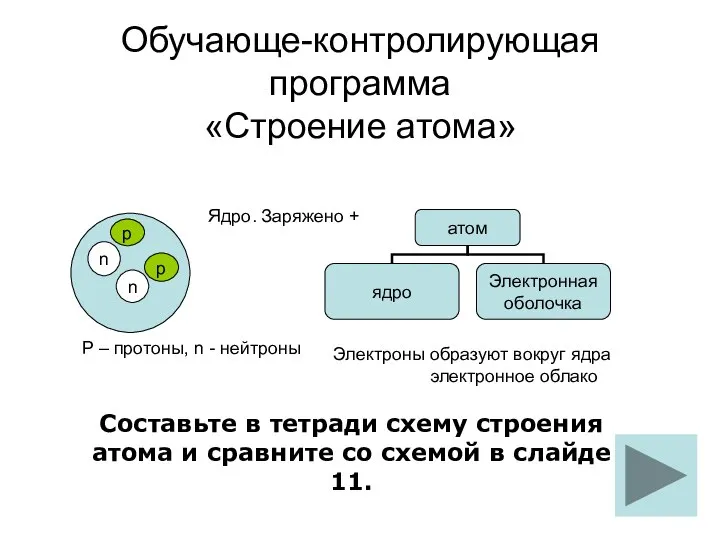 строение атома обуч-контр прогр
строение атома обуч-контр прогр Предельные углеводороды
Предельные углеводороды Особенные свойства муравьиной кислоты
Особенные свойства муравьиной кислоты Спирты
Спирты Капрон
Капрон Реакции
Реакции Неметаллы. Общая характеристика
Неметаллы. Общая характеристика Химия и повседневная жизнь человека. Почистим изделия из металлов
Химия и повседневная жизнь человека. Почистим изделия из металлов Презентация на тему Водород
Презентация на тему Водород  Пятая группа элементов
Пятая группа элементов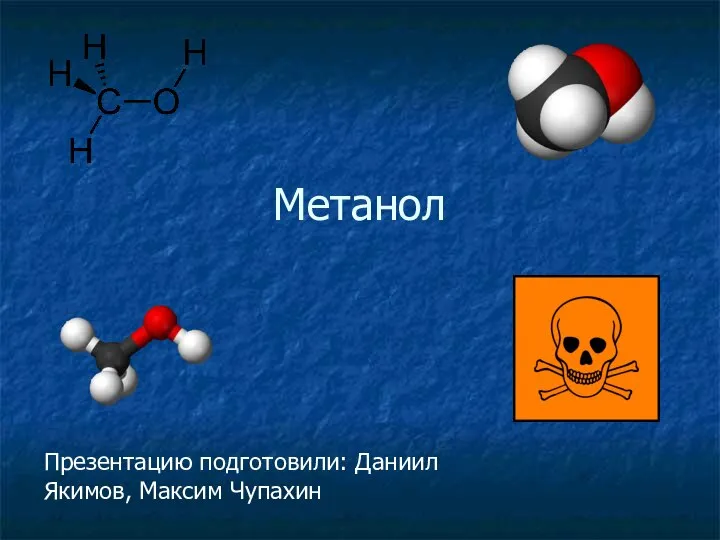 Метанол. Краткая характеристика
Метанол. Краткая характеристика Основания. Классификация
Основания. Классификация Применение муравьиного спирта
Применение муравьиного спирта VVEDENIE_V_OGRANIChESKUYu_KhIMIYu
VVEDENIE_V_OGRANIChESKUYu_KhIMIYu